基质固相分散—气相色谱串联质谱法测定孕妇血清中22种持久性有机污染物
2015-07-09赵鹏施家威李继革徐奋奋龚文杰裘立晓
赵鹏+施家威+李继革+徐奋奋+龚文杰+裘立晓


摘 要 建立了基质固相分散技术-气相色谱串联质谱法(MSPD-GC-QQQ-MS/MS)同时测定孕妇血清中22种持久性有机污染物(艾氏剂、狄氏剂、七氯、灭蚁灵、六六六、多氯联苯和滴滴涕)的方法。血清样品与C18吸附剂混合净化,正己烷溶液洗脱,GC-QQQ-MS/MS测定。采用Agilent J&W DB-35ms(30 m × 0.25 mm ×0.25 μm)分离,正电子离子源(EI+)模式电离,多反应监测模式(MRM)下进行测定,外标法定量。结果表明,在1.0~1000.0 ng/mL的范围内,22种持久性有机污染物的相关系数均大于0.99;在2.0和20.0 ng/mL的添加水平下,所有持久性有机污染物回收率均在75%~115%之间,方法定量限均≤0.15 ng/mL。在比较基质固相分散(MSPD)、液液萃取(LLE)和固相萃取(SPE)提取和净化实际加标血清样品时,MSPD方法的结果中位数更接近真实值,且离散程度最小。本方法适用于人类血清中多种持久性有机物的定性和定量分析。
关键词 基质固相分散技术; 气相色谱串联质谱; 持久性有机污染物; 血清
1 引 言
持久性有机污染物(Persistent organic pollutants, POPs)是一类半挥发性有机物质,它之所以被广泛关注是由于其具有高毒性、持久性、易于生物积累并可以长距离转移 【1】。早在2005年斯德哥尔摩公约中明确规定了首批消除的12类持久性有机污染物(艾氏剂、狄氏剂、异狄氏剂、滴滴涕、七氯、氯丹、灭蚁灵、毒杀芬、六氯苯、多氯联苯、二噁英和呋喃),由于持久性有机污染物可以通过食物链最终累积于人体,并对神经系统、免疫系统以及生育系统造成损伤【2】。因此,对持久性有机污染物的监测是一项长久且必要的工作。
目前,国际上监测人体中持久性有机污染物普遍以血清总脂(Total serum lipid, ng/g lipids)为计量单位。这是因为持久性有机污染物具有亲脂性,其含量与血清中的脂含量密切相关【3】。另外,有学者在分析人体血液中有机氯农药残留时,发现当使用体积基准(ng/mL)时,空腹与否对血清中有机氯农药的水平是有影响的,因此使用血清总脂作为计量单位则使得结果更稳定,且更具可比性【4】。
生物组织中持久性有机污染物的提取和净化方法有很多,目前比较常见的有超声破碎提取法【5】、微波辅助提取法(MAE)【6,7】、液液萃取法(LLE)【8,9】、固相萃取法(SPE)【10,11】等,其中基质固相分散提取法(MSPD)以其简便、高效、安全、价格低廉的特点被广泛用于持久性有机污染物的提取和净化中【12~14】,它直接利用基质固相分散技术去除待测样品中的潜在干扰物,所得洗脱液即可直接用于质谱分析。
本研究基于基质固相分散提取(MSPD)的原理,建立适合提取孕妇血清中22种持久性有机污染物的基质固相分散提取法,然后使用GC-QQQ-MS/MS对持久性有机污染物进行定性定量分析,从而为研究区域人群中持久性有机污染物的分布特点提供技术支持。
2 实验部分
2.1 仪器与试剂
Agilent 7890A气相色谱仪(Palo Alto, CA),7000B三重四极杆串联质谱仪(美国Agilent 公司); 固相萃取装置(美国Agilent 公司); HGC-24氮吹仪(天津恒奥公司); Milli-Q 纯水发生器(美国Millipore 公司); 高速离心机(上海安亭公司)。
C18吸附剂(50 μm, 美国Agilent公司); 正己烷、甲醇和丙酮(色谱级,美国TEDIA公司); ProElut Na2SO4 固相萃取柱(6 mL, 1000 mg, 美国DIKMA公司); 多氯联苯(PCB 28, PCB 30, PCB 52, PCB 73, PCB 101, PCB 118, PCB 138, PCB 153, PCB 155, PCB 180 和PCB 204)购于Dr.Ehrenstorfer公司,纯度大于99%; 六六六(HCH-α, β, γ,ε)、艾氏剂(Aldrin)、狄氏剂(Dieldrin)、灭蚁灵(Mirex)、七氯(Heptachlor)、滴滴涕(p,p′-DDE ; p,p′-DDD; p, p′-DDT)均购于农业环境保护研究所(100 mg/L, 中国天津)。
2.2 标准溶液配制
准确称取11 种多氯联苯标准品各1.0 mg 于10 mL棕色容量瓶中,用正己烷溶解并定容,配成浓度为100 mg/L的标准储备液,于
18 ℃密封保存。分别吸取22种持久性有机污染物各50 μL 于5.0 mL棕色容量瓶中,正己烷定容,配制成混和标准储备溶液,于4 ℃密封保存,待用。
2.3 色谱条件和质谱条件
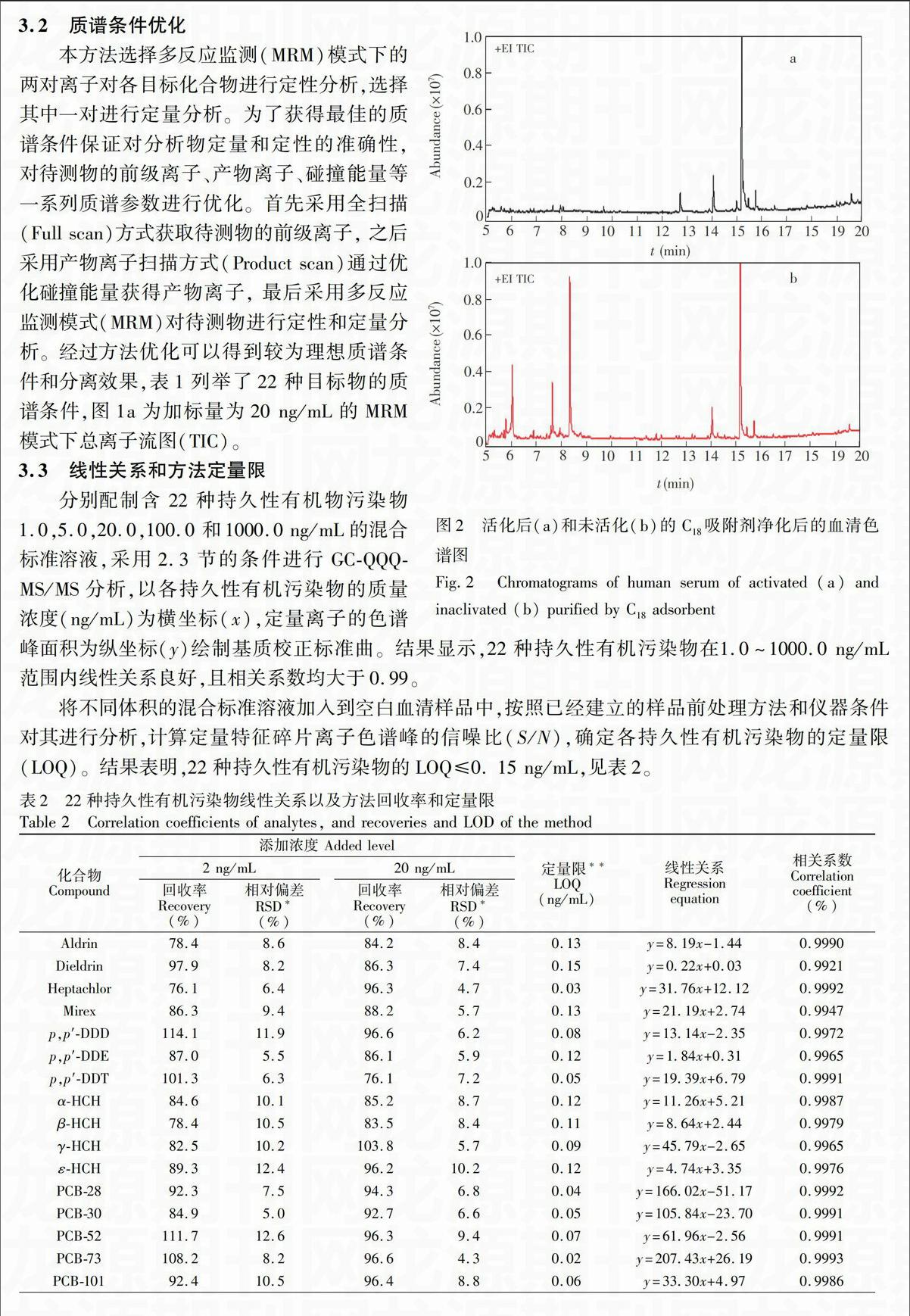
色谱: Agilent J&W DB-35ms 色谱柱(30 m × 0.25 mm ×0.25 μm),程序升温: 初始温度70 ℃,保持2 min,然后以20 ℃/min升温至180 ℃,再以10 ℃/min升温至280 ℃并保持5 min; 进样口温度:260 ℃,进样口压力:195.39 kPa (氦气, 99.999%),恒压模式,采用不分流模式,加标血清样品色谱图及某孕妇血清样品图谱见图1。
称取1.0 g C18吸附剂置于玻璃研钵中,加入0.5 mL甲醇碾磨、活化C18吸附剂。然后吸取0.5 mL 血清样品于研钵中,用玻璃棒将血清与活化的C18吸附剂碾磨混合均匀,并将得到的匀质物填入空柱,使用6 mL 5%丙酮-水溶液清洗并抽干,之后将ProElut Na2SO4固相萃取柱与上述自制小柱连接,最后用4 mL正己烷将目标化合物洗脱,洗脱液在50 ℃条件下,氮气吹干,使用200 μL正己烷溶解残留物,待测。endprint
2.5 血清总脂的计算
血清总脂(TSL)一般可由甘油三酯(Tg)和胆固醇(TC)计算获得 \表2 22种持久性有机污染物线性关系以及方法回收率和定量限
3.4 MSPD, LLE和SPE方法应用的比较
为了比较MSPD、LLE和SPE 3种方法在检测血清中持久性有机污染物的应用, 分别采用本研究建立的基质固相分散(MSPD)-气相色谱串联质谱法、Yao等【17】建立的液-液萃取-气相色谱串联质谱法和Bergonzi等【10】建立的固相萃取(SPE)-气相色谱串联质谱法开展加标回收率实验和精密度实验。以实际血清样本中所添加上述11种多氯联苯为例,经计算加标∑PCBs(ng/mg lipid)的真实值为3.482 ng/mg lipid。通过比较3种方法计算所获得的中位数,本方法所得数值与真实值最接近,且数据离散程度最小。图3显示3种方法测得加标样品中∑PCBs(ng/mg lipid)均小于真实值,另外,加标回收和精密度的实验结果显示。
图3 采用3种检测方法计算所得∑PCBs(ng/mg lipid, n=5)的分布情况
Fig.3 Distribution of ∑PCBs mean concentrations (ng/mg lipid, n=5) with the three methods
每个箱图中三角形代表各自的中位数,箱体上下两端代表25%和75%百分位数,直线标注为真实值。
Each box shows the median as a triangle, the 25th and 75th percentiles as a box. The straight line marks the actual concentration.
本方法和Bergonzi等【10】采用的方法测得的22种持久性有机污染物回收率分别为76.1%~114.1%和74.3%~122.2%,精密度分别为4.3%~12.6%和5.1%~17.6%,Yao等【17】 采用的方法(液-液萃取-气相色谱串联质谱法)运用于加标血清检测时部分多氯联苯和六六六单体回收率几乎为零。综上所述,本方法与上述液液萃取和固相萃取相比,克服了冗长的耗时和大量试剂的耗费,并且通过破坏复杂生物样本结构,增加生物样本与吸附材料的接触表面积,促使固相吸附材料与生物样本产生相互作用力,从而实现目标化合物的高效提取和分离【13】。
3.5 实际样品分析
对38份孕妇血清样品进行分析,每份样品平行测定3次,其中艾氏剂、狄氏剂、灭蚁灵和滴滴涕在此次检测中均未检出(见表3)。32份孕妇血清样品中检出有β-HCH或PCBs单体,其中β-HCH平均浓度为474 ng/g lipid,低于Masuda等【18】在日本调查的结果(564 ng/g lipid); 而∑PCBs的平均浓度为118 ng/g lipid,低于Voorspoels等【19】在比利时的调查结果(237 ng/g lipid),但高于Tan等【2】在新加坡的调查结果(29 ng/g lipid)。
References
1 de Boer J. Anal. Lett., 2012, 45(5-6): 485-494
2 Tan J,Loganath A, Chong Y S, Obbard J P. Toxico. Enviro. Chem., 2008, 90(5): 837-859
3 Haddad S,Poulin P, Krishnan K. Chemosphere, 2000, 40(8): 839-843
4 Phillips D L, Pirke J L, Burse V W, Bernert Jr J T, Omar Henderson L, Needham L L. Arch. Environ. Contam. Toxicol., 1989, 18(4): 495-500
5 Jacobs M N,Covaci A, Gheorghe A, Schepens P. J. Agric. Food Chem., 2004, 52(6): 1780-1788
6 Wang P, Zhang Q, Wang Y, Wang T, Li X. Anal. Chim. Acta, 2010, 663(1): 43-48
7 Tapie N, Budzinski H, Le Ménach K. Anal. Bioanal. Chem., 2008, 391(6): 2169-2177
8 PanM, Ma X D, Song S L, Zhang J X, Liu C, Guo X C. Anal. Lett., 2014, 47(13): 2173-2182
9 SONG Shu-Ling, HU Xiao-Jian, QI Peng, LI Song, TONG Ling, TIAN Qin, MA Xiao-Dong. Chinese J. Anal. Chem., 2015, 43(1): 49-54
宋淑玲, 胡小健, 祁 鹏, 李 松, 佟 玲, 田 芹, 马晓东. 分析化学, 2015, 43(1): 49-54
10 Bergonzi R, De Palma G, Tomasi C, Ricossa M C, Apostoli P. Int. Arch. Occup. Environ. Health, 2009, 82(10): 1241-1247
11 Orta-García S, Pérez-Vzquez F, Gonzlez-Vega C, Varela-Silva J A, Hernndez-Gonzlez L, Pérez-Maldonado I. Sci. Total Environ., 2014, 472: 496~501. doi:10.1016/j.scitotenv. 2013.11.059
12 Labadie P, Alliot F, Bourges C, Desportes A, Chevreuil M. Anal. Chim. Acta, 2010, 675(2): 97-105
13 Barker S A. J. Biochem. Bioph. Meth., 2007, 70(2): 151-162
14 Fidalgo-Used N, Blanco-Gonzlez E, Sanz-Medel A. Anal. Chim. Acta, 2007, 590(1): 1-16
15 CHEN Xiao-Hua. Technology and Application of Solid Phase Extraction. Beijing: Science Press, 2010: 253
陈小华. 固相萃取技术与应用. 北京: 科学出版社, 2010: 253
16 Silva M G D, Aquino A, Dorea H S, Navickiene S. Talanta, 2008, 76(3): 680-684
17 Yao Z, Zhang Y, Jiang G. Bull. Environ. Contam. Tox., 2005, 74(1): 155-161
18 Masuda Y,Haraguchi K, Kono S, Tsuji H, Papke O. Chemosphere, 2005, 58(3): 329-344
19 Voorspoels S, Covaci A, Maervoet J, Schepens P. B. Environ. Contam. Tox., 2002, 69(1): 22-29endprint
