利妥昔单抗联合化疗对高龄弥漫大B细胞性非霍奇金淋巴瘤的疗效探究
2015-07-07王思力黄耘苏蕊方志鸿骆宜茗徐卫
王思力,黄耘,苏蕊,方志鸿,骆宜茗,徐卫
(1.厦门大学附属第一医院 血液科,福建 厦门 361003;2.南京医科大学 临床医学系,江苏 南京 210029)
利妥昔单抗联合化疗对高龄弥漫大B细胞性非霍奇金淋巴瘤的疗效探究
王思力1,黄耘1,苏蕊1,方志鸿1,骆宜茗1,徐卫2
(1.厦门大学附属第一医院 血液科,福建 厦门 361003;2.南京医科大学 临床医学系,江苏 南京 210029)
目的 探究利妥昔单抗联合化疗对高龄弥漫大B细胞性非霍奇金淋巴瘤(diffuse large B cell lymphoma,DLBCL)的疗效。方法 2005年1月~2009年8月厦门大学附属第一医院接收的高龄DLBCL患者34例,其中10例采用单纯的CEOP化疗方案,24例采用利妥昔单联合化疗的R-CEOP治疗方案。比较2种治疗方案下患者近期疗效、长期随访生存率、不良反应和血清中免疫球蛋白的变化。结果 采用R-CEOP治疗方案的患者近期总有效率为66.7%(16/24)、长期随访生存率第1、2、3年为87.5%、75.0%、54.0%,显著高于CEOP组[近期总有效率50.0%(5/10),第1、2、3年长期随访生存率为81.8%、60.0%、40.0%],差异有统计学意义(P<0.05);不良反应发生率(66.7%)及严重程度低于CEOP组(80.0%),血清中IgG、IgA、IgM发生降低变化的百分比(72.7%、77.3%、72.7%)高于CEOP组(20.0%、30.0%、30.0%),两两比较差异有统计学意义(P<0.05)。结论 利妥昔单抗联合化疗对高龄DLBCL疗效确切,高龄DLBCL患者对大部分不良反应可以耐受,但利妥昔单抗易使高龄DLBCL患者血清中免疫球蛋白降低而发生感染。
利妥昔单抗;R-CEOP;CEOP;高龄弥漫大B细胞性非霍奇金淋巴瘤
目前侵袭性淋巴瘤中最常见的是弥漫大B细胞性非霍奇金淋巴瘤(diffuse large B cell lymphoma,DLBCL)[1]。据研究统计表明在欧美国家DLBCL在侵袭性淋巴瘤中占比在30%~40%之间,在亚洲国家中所占的百分比大于40%,虽然在我国DLBCL在侵袭性淋巴瘤中所占的比例未作具体统计,但据推测所占的百分比也将接近于40%[2-3]。利妥昔单抗是采用基因工程而研发出来的一种人鼠嵌合的针对DLBCL细胞表面CD20抗原的抗体[4],利妥昔单抗自1997年被美国FDA批准上市以来,经过多年的临床应用表明其在治疗DLBCL中就有显著的疗效,多项研究表明DLBCL在利妥昔单抗联合化疗下患者总的疗效得到很大提高[5-6]。高龄弥漫大B细胞性非霍奇金淋巴瘤由于患者高龄时机体各种脏器功能的下降,造成患者对药物的耐受性的下降[7]。这一原因导致高龄DLBCL在临床中的治疗非常艰难。目前已有较多文献报道利妥昔单抗联合化疗治疗DLBCL取得显著的疗效,少有文献关于利妥昔单抗联合化疗对高龄DLBCL治疗的报道,因此本研究收集本院在2005年~2009年高龄DLBCL患者的治疗情况,进行回顾性分析,进而探究利妥昔单抗联合化疗对高龄DLBCL的疗效。
1 资料与方法
1.1 一般资料 采用2005年1月~2009年8月厦门大学附属第一医院接受治疗的高龄DLBCL患者34例,其中男性为19例,年龄为65~84岁;女性为15例,年龄为66~83岁。所有患者经组织病理检查均确诊为DLBCL患者。34例患者中第1次复发为1例,第2次复发为2例,第3次复发为1例,其余为初次发病。34例患者中共有24例患者采用了利妥昔单抗联合化疗药(R-CEOP)治疗,10例患者仅采用化疗药治疗,34例患者所采用的化疗方案为CEOP(环磷酰胺+表阿霉素+长春地辛+泼尼松)。实验患者签署知情同意书,并经伦理委员会批准。
1.2 方法
1.2.1 治疗方案:对于24例R-CEOP组的治疗方案为:在进行化疗前1天对联合治疗组进行静脉滴注利妥昔单抗,剂量为375 mg/m2。在治疗的第1天给予患者静脉推注环磷酰胺,剂量为750 mg/m2;在治疗的第1天静脉滴注表阿霉素,剂量为70 mg/m2;在治疗的第1天静脉注射长春地辛,剂量为4 mg;在治疗的第1~5天口服泼尼松,剂量为100 mg/d。对于10例CEOP组仅采用联合治疗组中的化疗药物,而不在化疗前1天静脉滴注利妥昔单抗。每3个周为1个治疗周期。CEOP组和R-CEOP组每例DLBCL患者均接受了2个周期以上的化疗或联合治疗,所有的患者在进行治疗每2个周期后接受疗效评价,每1个周期接受不良反应评价和检测每例患者血清中免疫球蛋白的数值。
1.2.2 疗效评价:参照世界卫生组织对实体瘤治疗疗效的评价标准,将化疗药物治疗组和联合治疗组对DLBCL的治疗疗效分为4个等级,分别为:DLBCL完全缓解(CR)、DLBCL部分缓解(PR)、DLBCL病情稳定(SD)、DLBCL疾病进展(PD)。在患者治疗之后对每位患者进行12~36个月的长期随访,确定患者的生存时间,即患者在本院接受治疗后到最后一次接受随访之间的时间间隔[8]。
1.2.3 不良反应的评价:在每个周期治疗后观察每位DLBCL患者的不同的不良反应。根据世界卫生组织的评价标准,由于药物治疗产生的各种不良反应分为5个等级,分别为无(0级)、轻度(1级)、中度(2级)、重级(3级)、威胁患者生命(4级)。
1.2.4 血清中免疫球蛋白变化的评价:R-CEOP组和CEOP组在进行联合治疗或化疗前1周检测每位患者血清中IgG、IgA、1gM浓度作为每位患者血清中免疫球蛋白的基线值,经过排查24例R-CEOP组患者中有2例为血清中免疫球蛋白的基线值不在正常水平范围内,排除;CEOP组中全部患者血清中免疫球蛋白的基线值在正常水平范围内,故所有CEOP组患者全部纳入统计。经过治疗后复查时每位患者血清中的免疫球蛋白的数值与基线值相比降低20%时认为治疗后血清中免疫球蛋白发生变化。
1.3 统计学方法 采用SPSS17.0进行实验数据分析,等级资料组间比较采用秩和检验,运用Kaplan-Meier法进行组间生存的比较;以P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效评价 R-CEOP组患者经过利妥昔单抗联合化疗药(环磷酰胺、表阿霉素、长春地辛、泼尼松)的治疗后,24例患者中CR为4例,PR为12例,SD为4例,PD为4例,总的治疗有效率为66.7%;CEOP治疗组仅经过化疗药物治疗后,10例患者中CR为3例,PR为2例,SD为2例,PD为3例,ORR为50.0%。采用R-CEOP治疗的总的治疗有效率(66.7%)显著的优于CEOP治疗组(50.0%)(P<0.05,见表1)。
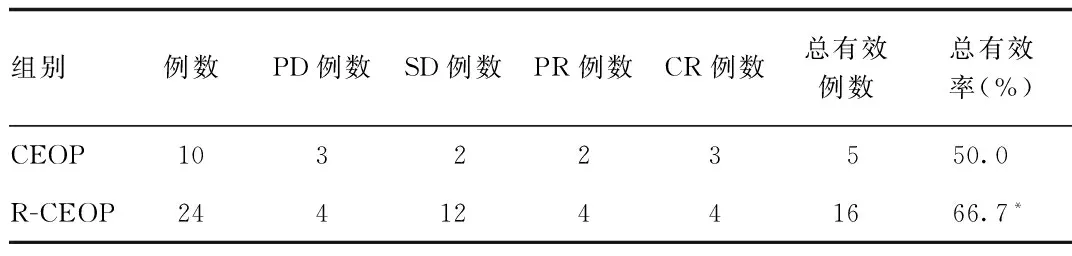
表1 2组治疗方案对近期DLBCL疗效评价Tab.1 Efficacy evaluation of treatment for two groups of recent DLBCL
*P<0.05,与CEOP组比较,compared with CEOP group
2.2 长期随访生存率 所有的DLBCL患者都有完整的长期随访的资料,随访的时间为12~36个月。24例R-CEOP组患者在随访期间死亡例数为11,其中有3例患者是死于联合用药后产生的重度骨髓抑制并发的机体感染,2例患者死于其他的老年病,另外6例是死于肿瘤进展,其余的13例患者存活。10例CEOP组患者在随访期间死亡例数为6例,其中1例患者是死于使用化疗药引起的机体感染,1例死于用药后产生的其他不良反应,4例患者死于肿瘤进展,无患者死于老年病,其余4例患者健存。CEOP组与R-CEOP组在第1、2、3年的生存率分别为87.5%、75.0%、54.0%,81.8%、60.0%、40.0%,2组间在第1、2、3年生存率间存在统计学差异(P<0.05,见表2)。

表2 2组治疗方案生存率(%)Tab.2 Survival rate of two groups(%)
*P<0.05,与CEOP组比较,compared with CEOP group
2.3 不良反应 所有的DLBCL患者在每次治疗后的不良反应检查中均有完整记录。R-CEOP组在治疗期间不良反应发生例数为16例,不良反应发生率为66.7%,常见的不良反应为乏力、恶心、呕吐、贫血等症状较轻,多数为0~2级不良反应,但较为严重和发生率较多的为感染,有3例患者因感染而导致死亡。CEOP组在治疗期间不良反应发生例数为8例,不良反应发生率为80.0%,不良反应发生除了有乏力、恶心、呕吐、贫血等外,还出现了肝、肾、心脏、神经毒性,并且不良反应程度较重,其中有1例患者死于用药后肝肾损伤。
2.4 血清中免疫球蛋白 纳入统计的22例R-CEOP组患者在经过治疗后复查时血清中IgG、IgA、IgM发生降低变化的百分比分别为72.7%、77.3%、72.7%。而全部纳入统计的10例CEOP组患者血清中IgG、IgA、1gM也发生降低,但具有统计学意义的发生降低变化的百分比仅分别为20.0%、30.0%、30.0%。见表3。

表3 2组治疗方案血清中免疫球蛋白Tab.3 Serum immunoglobulin in two groups
*P<0.05,与CEOP组比较,compared with CEOP group
3 讨论
利妥昔单抗是通过基因工程而研发出的人鼠嵌合型的,针对于B淋巴细胞表面上的CD20抗原的抗体,利妥昔单抗通过与CD20抗原特异性结合,当利妥昔单抗与CD20抗原结合后可增加B细胞淋巴瘤对各种化疗药物的敏感性,通过抗体和补体依赖的细胞毒作用来杀死淋巴瘤细胞[9]。由于利妥昔单抗可以增加淋巴瘤对各种化疗药物的敏感性,所以近年来在国内外的临床研究中表明,利妥昔单抗联合化疗药物治疗DLBCL时可以提高化疗药物的疗效,减少化疗药物的使用量,并且由于化疗而产生的不良反应减少[10-11]。自利妥昔单抗被1997年美国FDA批准上市以来,在各国的临床应用中被广泛的应用,并且取得显著的疗效。Pfreundschuh M[12]将18个国家的824位DLBCL患者作为研究对象,对这824位DLBCL患者随机的进行单纯的化疗药物治疗(CHOP治疗方案)和利妥昔单抗联合化疗药物治疗(R-CHOP治疗方案),经过6个周期的治疗,在治疗后再进行长期随访,结果表明R-CHOP组的无病生存率(74.3%)显著高于CHOP组的无病生存率;Pfreundschuh M[13]研究结果表明采用联合治疗和DLBCL组患者的总体有效率(92%)显著优于仅采用化疗药治疗的DLBCL组患者的总体有效率(72%),且在治疗后2年的随访结果表明,联合治疗的生存率(95%)显著的优于仅采用化疗药物治疗;吴国林等[14]在研究吉西他滨、奥沙利铂、地塞米松在利妥昔单抗挽救治疗复发或难治性非霍奇金淋巴瘤的临床观察时,结果表明吉西他滨、奥沙利铂、地塞米松在利妥昔单抗联合作用下对复发难治性 NHL近期疗效有非常显著的效果,并且相应的不良反应较小。由于高龄DLBCL患者机体功能的衰退,心肝脾肾等重要器官功能下降,造成高龄的DLBCL患者在接受化疗时即使在标准剂量下化疗,患者往往会产生多种严重的不良反应,最终使很多DLBCL患者在进行化疗时因为严重的不良反应而死亡。由于利妥昔单抗可以增加淋巴细胞对化疗药物的敏感性,可以在进行化疗时减少化疗药物的使用剂量而又不影响疗效,利妥昔单抗的这一显著优点在各种脏器功能减退的高龄DLBCL患者显现的更为重要。本研究中采用R-CEOP治疗方案的DLBCL患者的总体有效率显著的高于采用CEOP治疗方案的总体有效率;在治疗后的1~3年的随访结果R-CEOP治疗方案的DLBCL患者的第1、2、3年的生存率均显著高于采用CEOP治疗方案的生存率。这2个结果即可说明高龄的DLBCL患者采用利妥昔单抗联合化疗的治疗方案可以获得优于仅采用化疗的治疗方案的疗效。另外本研究中采用R-CEOP治疗方案的DLBCL患者在进行联合治疗后所发生的不了反应发生率和严重程度低于仅采用CEOP的治疗方案,这表明联合治疗方案在可以提高治疗效果和生存率的同时可以降低不良反应的产生,而这一结果可能是与利妥昔单抗提高化疗药物的敏感性,进而减少化疗药物的使用量,最终使不良反应的发生率和程度减小。
临床研究表明利妥昔单抗可以减少化疗药物所引起的不良反应,但近年来的研究显示利妥昔单抗也有一些不良反应,特别是利妥昔单抗与化疗药联合后所产生的感染,是该药物产生的较多且较为严重的不良反应,往往会导致部分患者因感染病情恶化,甚至死亡。王全顺等[15]在研究利妥昔单抗联合化疗治疗弥漫性大 B细胞性非霍奇金淋巴瘤时,在治疗后的长期随访中应用利妥昔单抗联合化疗药使免疫球蛋白显著降低。本研究中R-CEOP组中IgG、IgA、IgM降低变化率均与CEOP组存在显著性差别(P<0.05),另外在R-CEOP组有3例患者因联合用药后产生的感染而死亡,而在CEOP组未出现因感染而导致的死亡。这一结果表明高龄DLBCL在使用利妥昔单抗时往往会因为体内免疫球蛋白降低产生的感染。
综上所述,利妥昔单抗联合化疗对高龄DLBCL疗效确切,高龄DLBCL患者对大部分不良反应可以耐受,但利妥昔单抗易使高龄DLBCL患者血清中免疫球蛋白减低而产生感染,临床需谨慎使用。
[1] Morton LM, Wang SS, Devesa SS, et al.Lymphoma inc-idence patterns byWHO subtype inUnited States, 1992-2001[J].Blood, 2006, 107(1): 265-276.
[2] 李小秋,李甘地,高子芬,等.中国淋巴瘤亚型分布国内多中心性病例10002例分析[M].诊断学理论与实践,2012,11(2):111-115.
[3] Jaffe ES, Harris NL, Stein H, et al.World Health Organizationclassification tumours.Pathology and genetics of tumours ofhaematopoietic and lymphoid tissue[C].IARC Press, 2010.
[4] Zinzani PL, Venturini F, Stefoni V, et al.Gemcitabine as single agent inpretreated T-cell lymphoma patients: evaluation of the long-term outcome[J].AnnOncol, 2010, 21(2):860-863.
[5] 陈蕾,刘国静,孟洁,等.弥漫性大B细胞淋巴瘤R-BECHOP方案治疗近期疗效观察[J].中华肿瘤防治杂志,2013,20(21):1668-1671.
[6] 任振波,侯毅锐.3种方案治疗弥漫性大B细胞淋巴瘤疗效观察[J].中华实用诊断与治疗杂志,2010,24(4): 385-386.
[7] 张学青.老年肺肿瘤患者化疗后医院感染的危险因素[J].中华医院感染学杂志,2013,23(14): 3340-3342.
[8] Seki R,Ohshima K,Nagafuji K,et al.Rituximab in combination with CHOP chemotherapy for the treayment of diffuse large B cell lymphoma in Japan:a retrospective analysis of 1,057 cases from Kyushu Lymphoma Study Grouo[J].Int J hematology,2010,91(2):258-266.
[9] 任燕珍,韩艳秋.利妥昔单抗在淋巴瘤中的应用进展[J].中华临床医师杂志(电子版),2013,7(10):4409-4413.
[10] Coiffier B,Thieblemont C,Van Den Neste E,et al.Long-term outcomeof patients in the LNH-98.5 trial, the first randomized study comparingrituximab-CHOP to standard CHOPchemotherapy in DLBCL patients:a study by the Grouped'Etudes des Lymphomes de l’Adulte[J].Blood,2010,116(4):2040-2045.
[11] 沈秋丹,蔡伟波,刘仁涛,等.利妥昔单抗联合化疗治疗回盲部弥漫大B细胞淋巴瘤的临床分析[J],临床药物治疗杂志,2012,10(3):10-13.
[12] Pfreundschuh M,Kuhnt E,Trümper L,et al.CHOP-like chemotherapywith or without rituximab in young patients with good-prognosis diffuselarge-B-cell lymphoma: 6-year results of an open-label randomizedstudy of the MabThera International Trial (MInT) Group[J].LancetOncol,2011,12:1013-1022.
[13] Pfreundschuh M,Truem per L,Gill D,et al.First analysis of the completed Mabthera International (MInT) trial in young patients with low-risk diffuse large B-cell lymphoma (DLBCL):addition of rituximab to a CHOP- like regimen significantly im-proves outcome of all patients with the identification of a very favorable subgroup with IPI= 0 and no bulky disease[J].Blood,2010,104(48a):Abstract 157.
[14] 吴国林,汪晓虹,宋浩,等.吉西他滨、奥沙利铂、地塞米松±利妥昔单抗挽救治疗复发或难治性非霍奇金淋巴瘤的临床观察[J].中华临床医师杂志(电子版),2013,7(22):10333-10336.
[15] 王全顺,赵瑜,王书红,等.弥漫性大B细胞性非霍奇金淋巴瘤利妥昔单克隆抗体联合化疗后免疫球蛋白的变化[J].中国实验血液学杂志,2011,19(3):676-679.
(编校:谭玲)
Efficacy of rituximab combined with chemotherapy in treatment of elderly diffuse large B-cell non-Hodgkin’s lymphoma
WANG Si-li1,HUANG Yun1,SU Rui1,FANG Zhi-hong1,LUO Yi-ming1,XU Wei2
(1.Department of Hematology, The First Affiliated Hospital of Xiamen University, Xiamen 361003, China; 2.Department of Clinical Medicine, Nanjing Medical University, Nanjing 210029, China)
ObjectiveTo explore efficacy of rituximab combined with chemotherapy in treatment of elderly diffuse large B-cell non-Hodgkin’s lymphoma(DLBCL).MethodsFrom January 2005 to August 2009 in our hospital, 34 cases of elderly patients suffering from DLBCL, 10 cases received CEOP program, and 24 cases received R-CEOP program.Short-term efficacy, long-term follow-up of survival, adverse reactions and serum immunoglobulin of two treatment regimens in patients were compared.ResultsShort-term efficacy (66.7%)and long-term follow-up of survival (1,2,3 years was 87.5%,75.0%,54.0%)in patients received R-CEOP treatment programs were significantly higher than patients received CEOP treatment programs(short-term efficacy was 50.0%, 1,2,3 years long-term follow-up of survival was 81.8%,60.0%,40.0% ),which had statistically differences(P<0.05).The incidence and severity of adverse reactions(66.7%) was lower than CEOP group(80.0%).Reduction percentage of serum IgG, IgA, IgM(72.7%,77.3%,72.7%) was higher than CEOP group(20.0%,30.0%,30.0%), which had statistically differences(P<0.05). ConclusionRituximab combined with chemotherapy in treatment of diffuse large B-cell lymphoma is effective and adverse reactions are well tolerable, but rituximab is easy to make serum immunoglobulin reduce in elderly DLBCL and rise infection.
rituximab; R-CEOP; CEOP; elderly diffuse large B-cell non-Hodgkin’s lymphoma
国家自然科学基金(81170488)
王思力,女,博士,副主任医师,研究方向:恶性淋巴瘤的诊治,E-mail:qch1821460025.163.com。
R73
A
1005-1678(2015)02-0110-04
