Hsulf-1在肝癌细胞系中的作用及STAT3信号通路研究
2015-07-07龚星蒋建霞
龚星,蒋建霞
(1.湖北医药学院附属襄阳医院 肿瘤科,湖北 襄阳 441000;2.南京医科大学,江苏 南京 210000)
Hsulf-1在肝癌细胞系中的作用及STAT3信号通路研究
龚星1,蒋建霞2
(1.湖北医药学院附属襄阳医院 肿瘤科,湖北 襄阳 441000;2.南京医科大学,江苏 南京 210000)
目的 基于肝癌细胞中人硫酸酯酶-1(human sulfatase-1,Hsulf-1)基因对STAT3信号通路的影响,探讨Hsulf-1基因在肝癌发生发展中的作用。方法 应用RT-PCR 方法测定Hsulf-1在肝癌细胞中的表达;通过Western blot方法测定Huslf-1在HGF 加入前后对STAT3 磷酸化(p-STAT3)水平及下游蛋白的影响。结果 5-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-dC和曲古抑菌素Actrichostain A,TSA)处理HepG2细胞中Hsulf-1表达增加,且2者具有协同作用;与正常细胞相比,Hsulf-1在肝癌细胞系中(HepG2,Hep3B, Huh-7,SMMC-7221)表达水平下降,在转染pcDNA3.1(+)/Hsulf-1以及pcDNA3.1(+)/STAT3siRNA-Hsulf-1中的HepG2细胞,Hsulf-1的蛋白表达量增加,p-STAT3和c-met的表达水平下降,在未转染组以及转染阴性siRNA的HepG2细胞中,结论则相反。结论 Hsulf-1在肝癌细胞中表达下降; Hsulf-1在肝癌细胞中可抑制由HGF刺激的p-STAT3及下游蛋白的表达水平。
Hsulf-1;肝癌细胞系;STAT3;信号通路
原发性癌是目前最常见的恶性肿瘤之一,尤其是在国内,其发病率仍居高不下,并有逐年上升的趋势。现阶段治疗主要采取手术方式,但治疗效果不是很理想。因此研究开发更为有效的诊断治疗手段尤为迫切,而在此基础上深入研究肝癌的发生发展的分子机制,由此通过分子水平上干预、阻断及逆转其癌变的过程,提高肝癌的预防、诊断和治疗水平在很大程度上已经得到人们的广泛重视,并将成为今后的基础[1-2]。在本研究旨在探讨在肝癌细胞中人硫酸酯酶-1(human sulfatase-1,Hsulf-1)基因是否会对信号传导子及转录激活子3(signal transducer and activator of transcription 3,STAT3)信号通路有调控的作用,肝细胞生长因子(hepatocyte growth factor,HGF)能否介导STAT3信号通路的激活。研究将构建好的Hsulf-1和STAT3 siRNA转染至HepG2细胞中,用Western blot方法检测在不同条件下,其在HepG2细胞中的表达情况。采用的RNA干扰(RNA interference,RNAi)技术,经G418筛选形成了表达STAT3 siRNA的肝癌细胞,其STAT3 mRNA表达及蛋白下降,而且此类细胞增殖活性明显减弱,凋亡会增加,而无关序列的siRNA表达载体在对STAT3表达无影响,而且对于细胞增殖活性以及凋亡也无明显影响。
1 材料与方法
1.1 试剂与仪器 Trizol 试剂 (湖北贝特试剂公司);结晶紫、 MTT 试剂盒、阳离子脂质体(Lipofectin)、DMSO(Sigma,USA);胎牛血清 (Hyclone,USA);硝酸纤维膜(Millipore,USA);DNA marker、 protein marker、RNA 、PCR KIT(AMV)Ver.3.0 试剂盒(TaKaRa 生物公司,日本)BCA 试剂盒(北京百泰克公司);RIPA 强裂解液、ECL 试剂盒(上海碧云天生物技术有限公司),Hsulf-1、p-STAT3、STAT3、PI Sigma、cyclinD1、p-c-met、bcl-2 抗体均(SANTA CRUZ 公司,USA);脱脂奶粉(上海光明乳业);羊抗鼠二抗(KPL公司,USA);Taq 酶(上海生工生物技术服务有限公司),24 孔transwell平板(corning公司,USA);Qiagen Mid Plasmid Purification kit (Qiagen公司,德国);紫外分光光度计(Beckman公司,USA);超纯水机(SG 公司,德国);细胞培养箱 (力康生物医疗科技控股集团);微量加样器 (Eppendorf,Germany)Heraeus CO2细胞培养箱( Thermo FORMA 公司);YXQG01 型高压灭菌锅(山东新华医疗器械厂);FM130 型雪花制冰器(宁波格兰特公司);自动电热压力蒸汽灭菌器(上海申安医疗器械厂);电热恒温鼓风干燥箱(上海精宏实验设备有限公司);紫外可见光分光光度计、台式微量冷冻离心机、流式细胞仪500(Beckman Coulter 公司,USA);PTC-200 Peltier Thermal Cycler (MJ Research 公司,USA);WD-9405B 型水平摇床、DYY-6C 型、7C 型电泳仪、DYCP-31B 型迷你水平电泳槽 (北京市六一仪器厂);电动震荡混合器、CS.24 型摇床(上海医疗设备厂);PCR 扩增仪(480 型)(BIO.RAD 公司,USA);高速多功能冷冻离心机(JOUAN公司,法国);恒温搅拌循环水浴箱(常州国华电器有限公司);Alpha imagerTM1220 型紫外成像分析仪(Alpha innotech 公司,USA)。
1.2 实验方法
1.2.1 细胞培养:肝癌细胞系(HepG2,Hep3B,Huh-7及SMMC-7221)培养于含10%新生牛血清的DMEM中,培养条件为37 ℃、5%CO2。根据细胞的生长情况,及时更换培养液,在细胞贴壁生长达到培养板面积的80%~90%时,可以进行传代,在此期间,根据细胞生长速度选择1:2~1:4传代。用1 mL胰酶消化液在超净工作台上使用,消化大约2 min,当细胞变圆后,再加入2 mL的无血清培养液,继续用弯头吹管将其充分吹打成单细胞的悬液后,再加入1 mL新生牛血清来终止胰酶的作用,最后按照传代的要求加入5 mL带血清培养液,分装到新培养瓶里继续培养,做好传代标记。
1.2.2 5-Aza-dC及TSA处理HepG2细胞:将取对数生长期HepG2细胞,经胰酶消化后调整细胞密度为1×106个/mL以每孔100 μL接种于96孔培养板中,待细胞贴壁后其中3个随机分为5-Aza-dC组,分别加入浓度为5、2.5、1.0、0.5和0 μmol/L 5-Aza-dC;对照组只加培养基、LO2细胞系细胞,每组设6个复孔,另3个随机分为5-Aza-dC、对照组和5-Aza-dC+TSA组分别加入浓度分别为0.5,0.25,0 μmol/L的TSA,和5.0 μmol/L 5-Aza-dC+0.5 μmol/L TSA组,对照组只加培养基、LO2细胞系细胞,每组设6个复孔。
1.2.3 RT-PCR 检测Hsulf-1 mRNA的表达:总RNA提取:按照试剂盒说明书操作步骤提取肝癌细胞系的RNA;(逆转录获得cDNA;引物设计与合成;PCR反应。
1.2.4 pcDNA3.1(+)/Hsulf-1、pcDNA3.1(+)/STAT3siRNA及pcDNA3.1(+)/STAT3siRNA-Hsulf-1真核表达载体的构建 以 pcDNA3.1(+)为模板,以目的基因Hsulf-1引物扩增 Hsulf-1 cDNA,反应条件: 94 ℃ 变性 2 min;94 ℃ 30 s;56 ℃ 30 s;72 ℃ 60 s,35 个循环; 72 ℃延伸5 min。PCR产物行BamHⅠ+SalⅠ双酶切,插入到质粒载体 pcDNA3.1的多克隆位点区,构建pcDNA3.1(+)/Hsulf-1。
1.2.5 SDS-PAGE电泳:收集细胞按1×107个/mL加入RIPA细胞裂解液,BCA法测蛋白浓度。按每孔蛋白上样总量为20 μg制备样品,十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳分离,半干式电转印至PVDF膜上,按Western blot常规操作行Hsulf-1蛋白和p-STAT3蛋白检测,X光片用Mixrotek ScanWizard5扫描软件进行电脑扫描、Quantity one 7.0图像分析软件作灰度分析。
1.2.6 HGF处理HepG2细胞:将取对数生长期HepG2细胞,经胰酶消化后调整细胞密度为1×106个/mL以每孔100 μL接种于96孔培养板中,待细胞贴壁后其中随机分为加入浓度分别为5 ng/mL HGF,对照组只加培养基、细胞,每组设6个复孔,在不同时间段(0,1 h)观察并检测其蛋白表达情况。
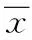
2 结果
2.1 通过5-aza-dC及TSA处理HepG2细胞后Hsulf-1的表达 当研究将不同浓度的5-aza-dC 加入到HepG2细胞后,Hsulf-1随着药物浓度的增加而表达上升,同样的结果出现在加入TSA后,TSA浓度的增加使得Hsulf-1的表达同样上升,将5.0 μmol/L 5-aza-dC以及0.5 μmol/L TSA同时加入到HepG2细胞后,Hsulf-1的表达量较前2者单独的效果更高。见图1。

图1 5-aza-dC及TSA处理HepG2细胞后Hsulf-1的表达Fig.1 The expression of Hsulf-1in HepG2 cells treated by TSA and 5-aza-dC
分别将0、0.5、1.0、2.5、5.0 μmol/L 5-aza-dC加入到HepG2细胞后,Hsulf-1 表达量随药物浓度增加而提高;将0、0.25、0.5 μmol/L TSA加入到HepG2细胞得到同样的结果,而同时加入5.0 μmol/L 5-aza-dC以及0.5 μmol/L TSA后,Hsulf-1表达量分别与前2者单独处理后更高。
2.2 RT-PCR 检测Hsulf-1 基因mRNA的表达结果 应用RT-PCR方法,在所测的4种肝癌细胞系中(HepG2、Hep3B、Huh-7及SMMC-7221),Hsulf-1基因mRNA的表达水平全部下降,且下降明显,以正常肝细胞作为对比。这与前期他人在肝癌细胞系中的研究结果相同[3]。Hsulf-1 mRNA的表达量用所测肝癌细胞系及正常肝细胞LO2细胞系中的mRNA的灰度值与内参照GAPDH的灰度值做比值进行表示。见图2。
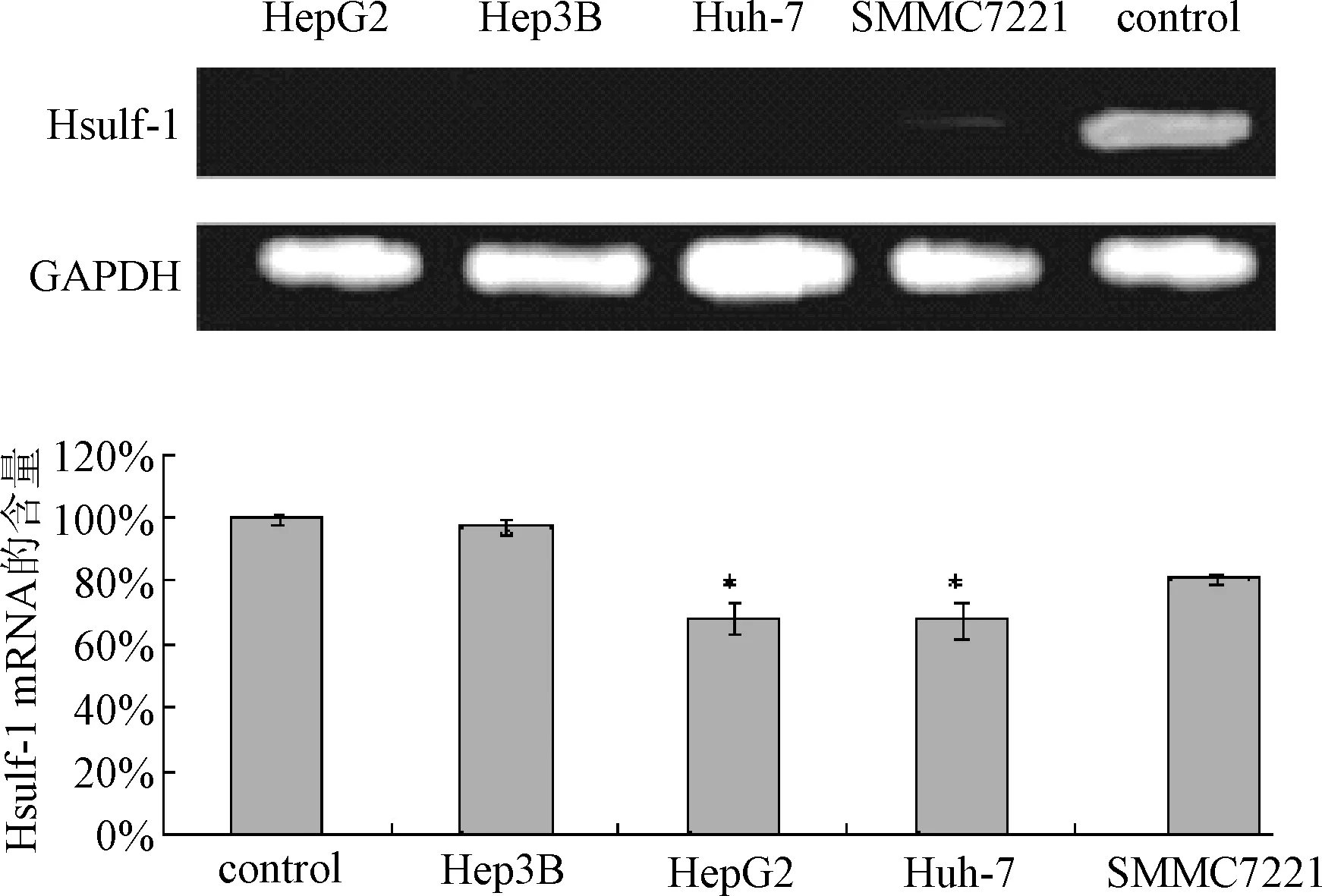
图2 RT-PCR方法检测肝癌细胞系、对照组中Hsulf-1 mRNA的表达情况*P< 0.05,与对照组相比Fig.2 Expression of Hsulf-1mRNA in hepatocellular carcinoma cell line and the control group detected by RJ-pck*P< 0.05,compared with control group
2.3 Western blot检测转染Hsulf-1蛋白以及p-STAT3蛋白 研究成功转染pcDNA3.1(+)/Hsulf-1、pcDNA3.1(+)/STAT3 siRNA及pcDNA3.1(+)/STAT3 siRNA-Hsulf-1,并应用Western blot分析检测。在未转染组以及转染空质粒的HepG2细胞中,Hsulf-1的表达受到抑制,没有呈现高表达状态,而转染pcDNA3.1(+)/Hsulf-1以及pcDNA3.1(+)/STAT3 siRNA-Hsulf-1后的HepG2细胞中,Hsulf-1的蛋白表达量增加,检测STAT3磷酸化表达在转染细胞中的情况,在未转染组以及转染阴性siRNA的HepG2细胞中,STAT3 磷酸化的表达未受影响,呈现高表达,而在pcDNA3.1(+)/STAT3siRNA以及pcDNA3.1(+)/STAT3siRNA-Hsulf-1后的HepG2细胞中,STAT3磷酸化表达下降,结果表明转染成功。见图3。
图3 Western blotting检测 Huslf-1表达质粒及STAT3 siRNA转染情况Fig.3 The method of western blot for detection the expression of Hsulf-1 in and transfection conditions of STAT3 siRNA
2.4 Hsulf-1在HepG2细胞系中抑制STAT3 磷酸化的表达水平 在HepG2细胞系中,Hsulf-1的表达可减少STAT3磷酸的表达水平,与对照组相比,差异有统计学意义(P<0.01),但是却不影响STAT3总量。将HGF 加入到HepG2 非表达Hsulf-1细胞系中,研究发现p-STAT3及c-met的表达水平同时上升,但是如将HGF 加入到在HepG2 表达Hsulf-1细胞系中,则结果完全不同,STAT3及c-met的磷酸化表达水平开始得到抑制。见图4。

图4 Hsulf-1在HepG2细胞系中对STAT3 信号的影响*p<0.05,与对照组相比Fig.4 The effect of Hsulf-1 on STAT3 signal in HepG2 cell line*p<0.05,compared with control group
当成功转染Hsulf-1后,应用Western blotting 检测p-STAT3及总STAT3蛋白的表达情况,并与对照组定量分析p-STAT3蛋白含量,以p-STAT3/β-actin 作为比值进行分析,差异有统计学意义(P<0.01);在HepG2 非表达Hsulf-1细胞系中加入5 ng/mL HGF 1 h后,p-c-met及p-STAT3的表达均随时间增加,而在Hsulf-1-转染细胞系中,2者的含量同时减少。
3 讨论
由研究可知,Hsulf-1在肝癌细胞系中呈现低表达状态,质粒转染后可促进 Hsulf-1蛋白表达升高,Hsulf-1可能通过降低 HSPGs的硫酸化程度,影响酪氨酸激酶活性,进一步抑制了多种信号通路的表达,肿瘤细胞出现增殖减慢、凋亡增加、侵袭性降低等有关,这与前期的研究相符,研究证实,Hsulf-1 参与调控多种细胞因子信号通路的表达。Liu等[12]将携带 Hsulf-1 片段的病毒转染肺癌细胞株 H292,发现 AKT、ERT 信号途径的表达下调,细胞迁移、增殖能力下降。研究证实[3]在肝癌细胞株研究中也发现,Hsulf-1的过表达可以使AKT、ERT的磷酸化水平降低,抑制该通路的表达。而Hsulf-1在多项研究中也表明可以通过水解HSPGS来调控多种信号通路,如MAPK 信号以及PI3K/AKT信号[4-6]等,但是目前尚未见报道Hsulf-1是否对STAT3信号通路有影响,为了进一步研究STAT3信号通路在HepG2细胞中的影响,研究构建了pcDNA3.1(+)/Hsulf-1 、pcDNA3.1(+)/STAT3 siRNA及pcDNA3.1(+)/STAT3 siRNA-Hsulf-1,并将其转入到HepG2细胞中,取名为Hsulf-1转染组,STAT3 siRNA组以及Hsulf-1转染+STAT3 siRNA组,本研究结果证实,Hsulf-1的表达可减少STAT3磷酸的表达水平,HGF可以促进非表达Hsulf-1细胞系中p-STAT3及c-met的表达水平上升,而在表达Hsulf-1细胞系中得到抑制。目前研究发现[7-10]STAT3信号转导通路是一类十分重要的信号通路,可调控细胞增殖、分化及凋亡等等的过程,其被激活的途径目前有两种,其中一种是在由细胞外的各种刺激信号,比较常见的是细胞因子IFN,IL-6等,它们会与细胞表面的相应受体进行结合,接下来进一步在细胞表面进行聚集并激活。但是由于缺乏内源性酪氨酸激酶活性,胞浆内的酪氨酸激酶的家族就会相应的被募集,比如说JAK家族[11-13]。JAK家族包括JAKl,JAK2及JAK3等,它们每个可激活的受体种类不同。在配体与受体结合后,并且受体通过募集其相应的JAK在磷酸化后,受体尾部的酪氨酸磷酸化。然后其与SH2结构域之间产生反应,并且STAT3激活。
而STAT3被募集后,它们会被磷酸化,接着就会形成二聚体,然后迅速进入核内,通过与其靶基因上的DNA进行结合,诱导基因转录。而另外有一个STAT3的激活途径,这种途径与细胞因子受体信号不同,活化生长因子受体也具有内源性的酪氨酸激酶活性,可以将STAT3进行磷酸化。比如有研究证实[14-15]EGFR可以将STAT3蛋白磷酸化[16]。不仅如此,一些其他的酪氨酸激酶如Src,Abl也可以将STAT3蛋白磷酸化。因此,STAT3蛋白可以被多种不同酪氨酸激酶激活。而STAT3可以稳定长期的表达此种效应,从而调控细胞生理功能。
外源性Hsulf-1基因能够抑制肝癌细胞系中呈现低表达状态,向肿瘤细胞中导入Hsulf-1基因会减少STAT3磷酸的表达水平,抑制其下游p-STAT3及c-met的表达水平,可以抑制肿瘤细胞生长和转移,促进肿瘤细胞凋亡。因此采用靶向Hsulf-1基因的治疗策略,能同时抑制肿瘤细胞的增殖与迁移,在一定程度上遏制了肿瘤无限制生长。由此可见,Hsulf-1基因作为一个很有潜力的抗癌基因,为临床上肿瘤的基因治疗提供了新的分子靶标。
[1] Bird A.Perceptions of epigenetics[J].Nature,2007,447(7143):396-398.
[2] Goldberg AD,Allis CD,Bernstein E.Epigenetics:a landscape takes shape[J].Cell,2007,128(4):635-638.
[3] Liu H,Fu X,Ji W,et al.Human sulfatase-1 inhibits the migration and proliferation of SMMC-7721 hepatocellular carcinoma cells by downregulating the growth factorsignaling[J].Hepatol Res,2013,43(15):516-525.
[4] Dhoot GK,Gustafsson MK,Ai X,et al.Regulation of Wnt signaling and embryo patterning by an extracellular sulfatase[J].Science,2001,293(S535):1663-1666.
[5] Morimoto-tomita M,Uchimura K,Werb Z,et al.Cloning and characterization of two extracellular heparin-degrading endosulfatases in mice and humans [J].J Biol Chem,2002,77(51):49175-49185.
[6] Scarpellini A,Germack R,Lortat-Jacob H,et al.Heparan sulfate proteoglycans are receptoes for the cell-surface trafficking and biological activity of transglutaminase-2[J].J Biol Chem,2009,284(27):18411-18423.
[7] Lai JP,Sandhu DS,Shire AM.The tumor suppressor function of human sulfatase 1 in carcinogenesis[J].J gastrointest cancer,2008,39(14):149-158.
[8] Kirkpatrick CA,Selleck SB.Heparan sulfate proteoglycans at a glance[J].J Cell Sci,2007,120(11):1829-1832.
[9] Escobar Galvis ML,Jia J,Zhang X, et al.Transgenic or tumor-induced expression of heparanase upregulates sulfation of heparan sulfate[J].Nat Chem Biol,2007,3(12):773-778.
[10] Lai J,Chien J,Staub J,et al.Loss of Hsulf-1 up-regulates heparin-binding growth factor signaling in cancer[J].J Biol Chem,2003,278(25):23107-23117.
[11] Backen AC,Cole CL,Lau SC,et al.Heparan sulphate synthetic and editing enzymes in ovarian cancer[J].Br J Cancer,2007,96(10):1544-1548.
[12] Liu P,Khurana A,Rattan R,et al.Regulation of Hsulf-1 expression by variant hepatic nuclear factor 1 in ovarian cancer[J].Cancer Res,2009,69(11):4843-4850.
[13] Staub J,Chien J,Pan Y,et al.Epigenetic silencing of Hsulf-1 in ovarian cancer implications in chemoresistance[J].Oncogene,2007,26(34):4969-4978.
[14] Narita K,Chien J,Mullany SA,et al.Loss of Hsulf-1 expression enhances autocrine signaling mediated by amphiregulin in breast cancer[J].J Biol Chem,2007,282(19):14413-14420.
[15] Chen Z,Fan JQ,Li J,et al.Promoter hypermethylation correlates with the Hsulf-1 silencing in human breast and gastric cancer[J].Int J Cancer,2009,124(3):739-744.
[16] Lai JP,Chien J,Moser D,et al.Hsulf-1 Sulfatase promotes apoptosis of hepatocellular cancer cells by decreasing heparin-binding growth factor signaling[J].Gastroenterology,2004,126(1):231-248.
(编校:王冬梅)
Role of Hsulf-1 in hepatocellular carcinoma cell lines and STAT3 signaling pathway research
GONG Xing1,JIANG Jian-xia2
(1.Department of Oncology, Affiliated Xiangyang Hospital of Hubei Medical College, Xiangyang 441000, China; 2.Nanjing Medical University, Nanjing 210000, China)
ObjectiveTo investigate the role of Hsulf-1 gene in the occurrence and development of hepatocellular carcinoma based on effect of Hsulf-1 gene on STAT3 signaling pathway.MethodsRT-PCR method was used for determination of the expression of Hsulf-1 in hepatocellular carcinoma cells; Determination of Huslf-1 in HGF before and after adding on the phosphorylation of STAT3 by Western blot method (p-STAT3) level and the effect of downstream proteins.ResultsExpression of Hsulf-1 was increased by 5-Aza-dC and TSA treatment in HepG2 cells, which had synergistic effect.Compared with normal cells, expression levels of Hsulf-1 in HCC cell lines decreased(HepG2,Hep3B,Huh-7,SMMC-7221),but in the transfected, pcDNA3.1 (+) /Hsulf-1 and pcDNA3.1 (+) /STAT3siRNA-Hsulf-1 in HepG2 cells which was increased in expression of Hsulf-1 protein,the expression level of p-STAT3 and c-Met decreased in untransfected and transfected, siRNA negative HepG2 cells, while the opposite. ConclusionThe expression of Hsulf-1 decreased in HCC cells; Hsulf-1 can inhibit the expression of p-STAT3 and downstream protein level by stimulation of HGF in hepatocellular cancer cells.
human sulfatase-1; hepatocellular carcinoma; STAT3; signaling pathway
国家自然科学基金(81101800)
龚星,男,学士,主治医师,研究方向:肺癌的生物靶向治疗,E-mail:qch1821460052.com。
R735.7
A
1005-1678(2015)02-0048-04
