MCHR1基因shRNA真核表达载体的构建及鉴定
2015-07-07赵志武师磊陈显久王君实马敏燕炯
赵志武,师磊,陈显久,王君实,马敏,燕炯Δ
(1.山西医科大学 公共卫生学院,山西 太原 030001;2.山西医科大学 基础医学院,山西 太原 030001 )
MCHR1基因shRNA真核表达载体的构建及鉴定
赵志武1,师磊1,陈显久2,王君实1,马敏1,燕炯1Δ
(1.山西医科大学 公共卫生学院,山西 太原 030001;2.山西医科大学 基础医学院,山西 太原 030001 )
目的 构建有效针对小鼠黑色素浓集激素受体1(melanin-concentrating hormone receptor 1,MCHR1)的shRNA(small hairpin RNA)真核表达载体。方法 设计合成3条小鼠MCHR1基因的shRNA序列以及1条无同源性的shRNA序列作为阴性对照,与质粒重组构建sh-MCHR1干扰载体,并进行菌液PCR和DNA测序鉴定;脂质体法转染小鼠3T3-L1细胞后观察MCHR1 mRNA和蛋白表达的变化。结果 经菌液PCR及DNA测序鉴定表明各shRNA载体构建成功;转染3T3-L1细胞后,与空载体组相比,阴性对照组MCHR1 mRNA和蛋白的表达均无明显差异,但实验组3种干扰载体均能显著抑制MCHR1 mRNA和蛋白的表达(P<0.05),且3种载体的抑制程度有一定的差异,以sh-MCHR1-1载体沉默效果最佳。结论 sh-MCHR1干扰载体构建成功,为进一步探究MCHR1与肥胖症之间的关系奠定了实验基础。
黑色素浓集激素受体1;RNA干扰;shRNA载体;3T3-L1前脂肪细胞
随着经济的发展,生活水平的提高,肥胖人数逐年增长,并已成为全球性公共卫生问题。研究认为,黑色素浓集激素(melanin-concentrating hormone,MCH)是一种增强食欲的神经肽,参与机体能量代谢调节,与肥胖症的发生相关[1-2]。MCH有2种受体亚型,即MCHR1和MCHR2,为肥胖症药物治疗研究提供了新靶点[3-4]。其中,在啮齿类动物体内,MCH只通过MCHR1发挥作用,并且鼠MCHR1基因序列与人的高度同源,为研究MCH与肥胖之间的关系提供了便利条件。
RNA干扰作为一种基因沉默技术,可通过双链RNA(double-stranded RNA,dsRNA)诱发同源mRNA高效特异地降解[5]。如今,该技术已广泛应用于生物医药领域,成为研究基因功能和制备基因药物的重要方法。本实验旨在通过采用RNA干扰技术制备MCHR1基因shRNA真核表达载体,为进一步探究MCHR1的功能提供实验基础。
1 材料与方法
1.1 主要实验材料
1.1.1 细胞株:小鼠3T3-L1前脂肪细胞由山西医科大学第一附属医院内分泌科惠赠。
1.1.2 主要试剂:T4 DNA连接酶、BamHⅠ和Hind Ⅲ双切酶(美国NEB公司);Lipofectamine LTX&PLUS(美国Invitrogen公司);MCHR1一抗(美国Santa Cruz公司);DMEM/F12培养基、BCA试剂盒、HRP羊抗兔IgG二抗和ECL发光底物(武汉博士德生物工程有限公司);胎牛血清(杭州四季青公司);质粒提取试剂盒(天根生化公司);Premix TaqTM(大连宝生物工程有限公司);引物序列(上海生工公司);GV102质粒及其通用引物由上海吉凯基因化学技术有限公司设计合成。
1.1.3 主要仪器:NAPCO-5410型恒温CO2细胞培养箱(美国Precision Scientific公司);YD-S-15型液氮生物容器(成都金凤液氮容器有限公司);LS-B 35L型立式压力灭菌锅(江阴滨江医疗设备有限公司);Eon微孔板分光光度计(美国BioTek公司);DM3000荧光倒置显微镜(德国Leica公司);DYY-7c型电泳仪、蛋白转膜仪(北京六一仪器厂);TL-18M型台式高速冷冻离心机(上海市离心机械研究所);PX2型PCR仪(美国Thermo公司)。
1.2 实验方法
1.2.1 shRNA目标序列的设计与合成:根据NCBI数据库中小鼠MCHR1 mRNA碱基序列(NM_145132.2)以及shRNA的设计原则,通过RNA干扰设计工具(美国Invitrogen公司)设计特异性插入序列片段。经过比对,选出与小鼠MCHR1基因完全一致,并且与小鼠其它基因同源性最低的3条序列;同时再设计一条与MCHR1基因无同源性的阴性对照序列。各目标序列由上海吉凯基因化学技术有限公司合成(见表1)。

表1 小鼠MCHR1干扰目标序列Tab.1 Target sequences of mouse MCHR1
1.2.2 shRNA载体的构建及鉴定:将合成的shRNA序列退火后与经BamHⅠ和HindⅢ双酶切回收的GV102质粒(hU6-MCS-CMV-GFP-SV40-Neomycin,6.4kb)在T4 DNA连接酶的作用下16 ℃连接过夜。连接后的产物进行转化实验,完成构建。转化子经菌液PCR鉴定(通用引物法)后将阳性克隆产物进行DNA测序。鉴定正确的重组质粒中实验组分别命名为sh-MCHR1-1、sh-MCHR1-2、sh-MCHR1-3;阴性对照为sh-MCHR1-4。
1.2.3 质粒提取及鉴定:37 ℃恒温摇床摇菌14 h后按试剂盒说明在超净台中提取质粒。随后各取2 μL提好的质粒,通过微孔板分光光度计测量其A260/A280值。质粒纯度符合要求后各取5 μL,与1 μL 6×核酸上样缓冲液混合,进行琼脂糖凝胶电泳。待指示条带到胶块3/4处时,凝胶成像系统观察和拍照。
1.2.4 细胞培养和转染:用含10%胎牛血清的DMEM/F12培养基,在37 ℃、5%CO2孵箱中培养3T3-L1前脂肪细胞。转染前一天,以每孔细胞量约1×104个种植于24孔板,次日汇合约80%时进行转染。细胞转染按照Lipofectamine LTX&PLUS说明书操作,转染72h后荧光显微镜观察,Image J软件通过明场和暗场视野比对计算细胞转染效率。
1.2.5 RT-PCR检测MCHR1 mRNA的表达:根据Trizol说明书分别提取转染各干扰载体的细胞总RNA。随后各取总RNA 2 μg,5×PrimeScript Buffer 4 μL,补RNase Free水至20 μL混匀;37 ℃ 15 min,85 ℃ 5 s,反转录得cDNA。各取cDNA 0.5 μg,Premix TaqTM25 μL,上下游引物(见表2)各1 μL,并补RNase Free水至50 μL混匀;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,共循环30次。加8 μL PCR反应产物进行电泳,拍照,并以β-actin为内参。

表2 RT-PCR引物序列Tab.2 Primer sequences for RT-PCR
1.2.6 Western blot检测MCHR1蛋白的表达:转染72 h后按说明书要求收集各组细胞总蛋白。BCA法检测蛋白浓度,随后取50 μg蛋白样品进行SDS-PAGE电泳,并电转移至NC膜上。室温下5%脱脂奶粉摇床上封闭3 h后与1:200稀释的MCHR1一抗4 ℃孵育过夜。PBST洗膜后与1:7000稀释的二抗室温孵育3 h;PBST再次洗膜后加ECL发光液暗室曝光。BIO-RAD软件分析蛋白条带,各蛋白条带灰度值通过内参β-actin校正。
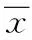
2 结果
2.1 sh-MCHR1干扰载体菌液PCR,质粒鉴定及DNA测序鉴定 0.8%琼脂糖凝胶电泳检测转化子,以sh-MCHR1-1组为例,连入shRNA的阳性克隆PCR片段大小为367 bp(3、4、5、7号泳道),未连入的为322 bp(2、6号泳道)。随后对连入shRNA的阳性克隆产物进行DNA测序鉴定,结果均与设计合成的序列完全一致,表明各sh-MCHR1载体构建成功(见图1A、1C)。
经微量分光光度计测定,各重组质粒A260/A280值均介于1.8左右,纯度符合要求,适用于细胞转染。0.8%琼脂糖凝胶电泳检测发现其目的条带均介于5000~7500 bp之间,与预测结果一致,说明提取的质粒准确(见图1B)。
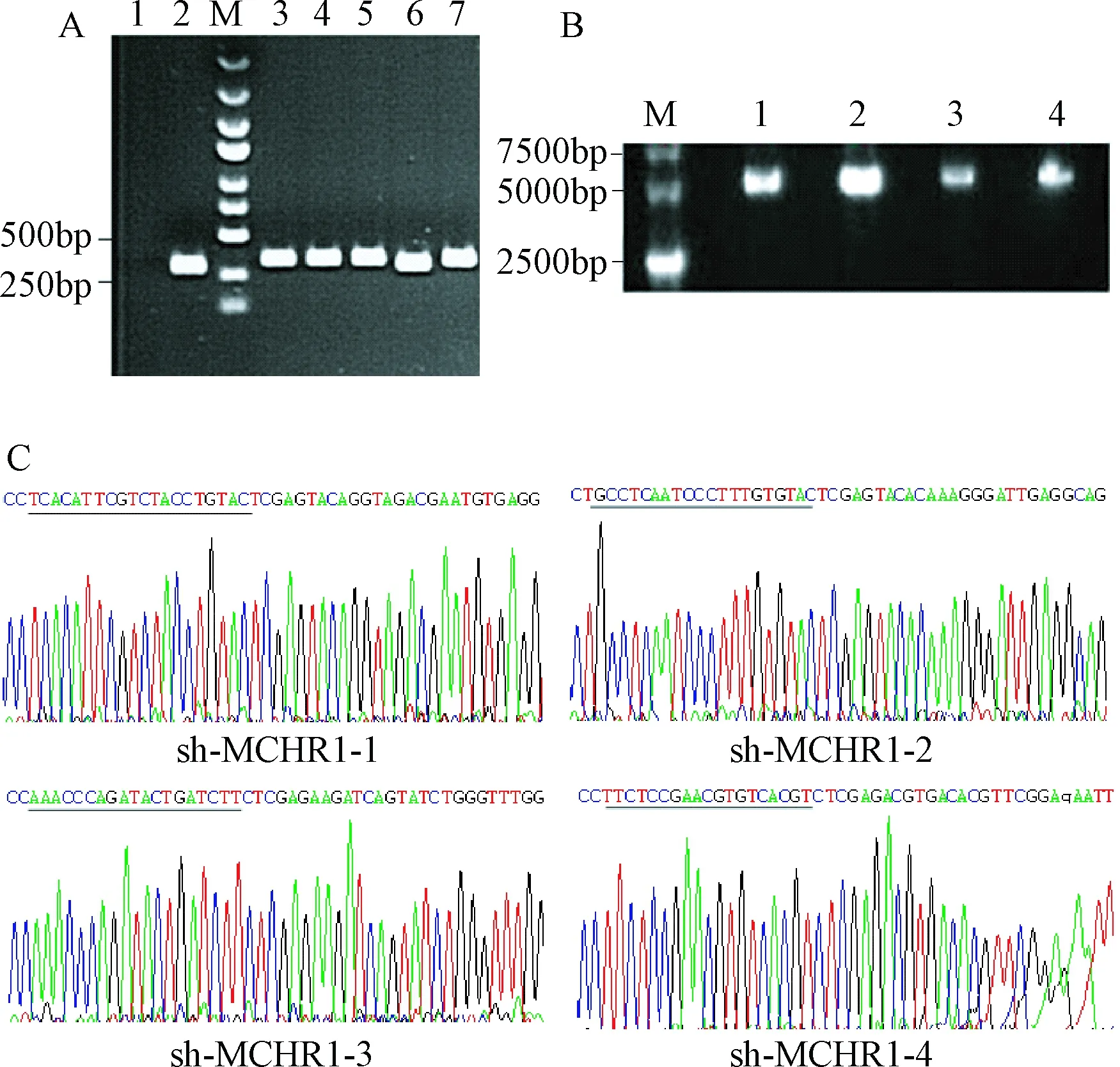
图1 sh-MCHR1干扰载体鉴定A.sh-MCHR1-1组菌液PCR鉴定 1.双蒸水组;2.空载体组;M.Maker;3-7.不同转化子组;B.各重组质粒凝胶电泳 1.sh-MCHR1-1组;2.sh-MCHR1-2组;3.sh-MCHR1-3组 ;4.sh-MCHR1-4组;C:DNA测序Fig.1 Identification of sh-MCHR1 vector A.Bacterium liquid PCR reaction of sh-MCHR1-1 group。1.ddH2O group; 2.Empty vector group; 3-7.Different transformant groups; B. Gel electrophoresis of every recombinant plasmid。1.sh-MCHR1 group; 2.sh-MCHR1-2 group; 3.sh-MCHR1-3 group; 4.sh-MCHR1-4 group; C.DNA sequencing
2.2 转染细胞及计算转染效率 转染72 h后各组荧光强度均达到最佳且基本一致(见图2),Image J软件分析sh-MCHR1-1、sh-MCHR1-2、sh-MCHR1-3、sh-MCHR1-4 4种载体的转染效率分别为(57.37±6.45)%、(58.83±4.39)%、(56.52±11.41)%、(58.15±2.58)%,均适用于基因沉默效果鉴定。

图2 各组sh-MCHR1载体转染72h效果(×200)Fig.2 Transfection efficacy of every sh-MCHR1 group after 72 hours(×200)
2.3 RT-PCR检测结果 与空载体组相比,sh-MCHR1-4组细胞中MCHR1 mRNA相对表达量差异无统计学意义;而sh-MCHR1-1、sh-MCHR1-2、sh-MCHR1-3组细胞中MCHR1 mRNA相对表达量分别为0.13±0.05、0.60±0.13、0.65±0.08,较空载体组表达量均显著下降(P<0.05),说明构建的各实验组载体均有效沉默MCHR1基因(见图3),且sh-MCHR1-1组效果优于另外2组(P<0.01)。
图3 转染后MCHR1 mRNA的表达水平*P<0.05,**P<0.01,与空载体组相比Fig.3 Level of MCHR1 mRNA expression after transfection*P<0.05,**P<0.01,compared with empty vector group
2.4 Western blot检测结果 与空载体组相比,sh-MCHR1-4组细胞中MCHR1蛋白相对表达量差异无统计学意义;而sh-MCHR1-1、sh-MCHR1-2、sh-MCHR1-3组细胞中MCHR1蛋白相对表达量分别为0.15±0.11、0.61±0.07、0.64±0.14,较空载体组表达量均显著下降(P<0.05),进一步证实构建的实验组载体有效(见图4)。

图4 转染后MCHR1蛋白的表达水平*P<0.05,**P<0.01,与空载体组相比Fig.4 Level of MCHR1 protein expression after transfection*P<0.05,**P<0.01,compared with empty vector group
3 讨论
MCH是一种重要的能量平衡调节激素,可通过促进摄食量快速增加而导致肥胖,而缺乏MCH的小鼠相对消瘦[6]。MCHR1是一种G蛋白偶联受体,在大鼠、小鼠和人类中高度保守。另外,MCHR1主要在大脑中表达[7],特别是在海马、嗅区以及内侧伏隔核内,说明了MCHR1参与嗅觉的学习和强化,与摄食调节相关。研究认为,缺乏MCHR1基因的动物体质量和糖含量下降,活动增多,不易被高脂饮食诱导肥胖[8-9]。除了中枢作用,MCHR1也存在于脂肪、小肠和胰腺等外周组织中,在机体代谢过程中发挥重要作用[9]。
近年来,RNA干扰技术已成为研究基因功能的重要工具。该技术可以抑制正常生物体特定基因的表达,具有高特异性、高稳定性、高效性和可传播性等特点, 在机体代谢研究领域中应用广泛[10-12]。为探究MCHR1在外周脂肪组织中的作用,本研究以MCHR1基因为靶点,将体外合成的MCHR1特异性小干扰RNA与含绿色荧光蛋白(GFP)的质粒重组成干扰载体sh-MCHR1。经菌液PCR与DNA测序鉴定,设计的4组载体均构建成功。脂质体法转染小鼠3T3-L1前脂肪细胞后,通过RT-PCR和Western blot检测发现实验组3种载体均可显著降低MCHR1 mRNA与蛋白的表达,其中以sh-MCHR1-1最为显著,有效沉默了MCHR1基因的表达。本研究为进一步利用最佳干扰载体探究脂肪细胞分化信号通路以及动物转染提供了实验依据,并为制备预防和治疗肥胖症的基因药物提供了新思路。
除上述应用外,MCHR1还与甲状腺功能、抑郁症、体温调节、睡眠等密切相关[13-15],若采用sh-MCHR1干扰载体转染相关细胞或动物,对于完善MCHR1基因功能以及探究其生理或病理机制将发挥积极作用。
[1] Macneil DJ.The role of melanin-concentrating hormone and its receptors in energy homeostasis[J].Front Endocrinol (Lausanne), 2013(4):49.
[2] Parker JA,Bloom SR.Hypothalamic neuropeptides and the regulation of appetite[J].Neuropharmacology,2012,63 (1):18-30.
[3] Johansson A,Löfberg C.Novel MCH1 receptor antagonists:a patent review[J].Expert Opin Ther Pat,2015,25(2):193-207.
[4] Chen X,Mihalic J,Fan P,et al.Discovery and characterization of a potent and selective antagonist of melanin-concentrating hormone receptor 2[J].Bioorg Med Chem Lett,2012,22(1):363-366.
[5] Wilson RC,Doudna JA.Molecular mechanisms of RNA interference[J].Annu Rev Biophys, 2013,42:217-239.
[6] Wang Y,Ziogas DC,Biddinger S,et al.You deserve what you eat:lessons learned from the study of the melanin-concentrating hormone (MCH)-deficient mice[J].Gut, 2010,59 (12):1625-1634.
[7] Parks GS,Wang L,Wang Z,et al.Identification of neuropeptide receptors expressed by melanin-concentrating hormone neurons[J].J Comp Neurol, 2014,522(17):3817-3833.
[8] Takase K,Kikuchi K,Tsuneoka Y,et al.Meta-analysis of melanin-concentrating hormone signaling-deficient mice on behavioral and metabolic phenotypes[J].PLoS One, 2014,9(6):e99961.
[9] Li N,Nattie E,Li A.The role of melanin concentrating hormone (MCH) in the central chemoreflex:a knockdown study by siRNA in the lateral hypothalamus in rats[J].PLoS One, 2014,9(8):e103585.
[10] Sioud M.RNA interference:mechanisms,technical challenges,and therapeutic opportunities[J].Methods Mol Biol, 2015,1218:1-15.
[11] Saito Y,Nagasaki H.The melanin-concentrating hormone system and its physiological function[J].Results Probl Cell Differ,2008,46:159-179.
[12] Czech MP,Aouadi M,Tesz GJ.RNAi-based therapeutic strategies for metabolic disease[J].Nat Rev Endocrinol,2011,7(8):473-484.
[13] Chung S,Liao XH,Di Cosmo C,et al.Disruption of the melanin-concentrating hormone receptor 1 (MCH1R) affects thyroid function[J].Endocrinology,2012,153(12):6145-6154.
[14] García-Fuster MJ,Parks GS,Clinton SM,et al.The melanin-concentrating hormone (MCH) system in an animal model of depression-like behavior[J].Eur Neuropsychopharmacol,2012,22(8):607-613.
[15] Ahnaou A,Dautzenberg FM,Huysmans H,et al.Contribution of melanin-concentrating hormone (MCH1) receptor to thermoregulation and sleep stabilization:evidence from MCH1 (-/-) mice[J].Behav Brain Re,2011,218(1):42-50.
(编校:吴茜)
Construction and identification of shRNA recombinant plasmids targeting MCHR1 gene
ZHAO Zhi-wu1,SHI Lei1,CHEN Xian-jiu2,WHANG Jun-shi1,MA Min1,YAN Jiong1Δ
(1.School of Public Health, Shanxi Medical University, Taiyuan 030001, China; 2.School of Basic Medical Sciences, Shanxi Medical University, Taiyuan 030001, China)
ObjectiveTo construct effective small hairpin RNA(shRNA) recombinant plasmids targeting mouse melanin-concentrating hormone receptor 1(MCHR1) gene.Methods Three shRNA sequences targeting mouse MCHR1 gene and one negative control were designed, synthesized and then recombined with plasmid.The shRNA recombinant vectors were detected by bacterium liquid PCR reaction and DNA sequencing.These vectors were also transfected into 3T3-L1 preadipocytes with lipofectamine, and RT-PCR and Western blot analysis were performed to evaluate their silencing effects.ResultsEvery shRNA recombinant vector was constructed and transfected into 3T3-L1 preadipocytes successfully.Compared with empty vector group, three vectors can significantly inhibit the expression of mRNA and protein of MCHR1(P<0.05), and negative control vector had no obvious change.In addition, the effects of the three vectors were different, and the sh-MCHR1-1 produced the best. ConclusionThe shRNA recombinant vectors targeting mouse MCHR1 gene were established successfully, and it will contribute to further study on the relationship between MCHR1 and obesity.
melanin-concentrating hormone receptor 1;RNA interference;shRNA vector;3T3-L1 preadipocytes
赵志武,男,硕士在读,研究方向:公共卫生,E-mail:842294911@qq.com ;燕炯,通信作者,男,副教授,硕士生导师,研究方向:营养相关疾病分子学,E-mail:yanjiong@126.com。
R153
A
1005-1678(2015)02-0014-04
