脐带间充质干细胞对博来霉素诱导实验性小鼠肺纤维化模型影响的研究
2015-07-07冯丽君张颖超
冯丽君,张颖超
(天津医科大学 宝坻临床学院 呼吸科,天津 301800)
脐带间充质干细胞对博来霉素诱导实验性小鼠肺纤维化模型影响的研究
冯丽君Δ,张颖超
(天津医科大学 宝坻临床学院 呼吸科,天津 301800)
目的 探讨脐带间充质干细胞(umbilical cord-mesenchymal stem cells,UC-MSC)对博来霉素诱导的实验性小鼠肺纤维化中羟基脯氨酸(hydroxyprine,HYP)、活性氧(superoxyde dismutase,SOD)及丙二醛(malonaldehyde,MDA)的含量的影响。方法 采用小鼠气管内注人博来霉素诱导实验性小鼠肺纤维化,取第四代UC-MSC细胞通过尾静脉注射干预,给药21 d后,处死小鼠获取肺组织,对其进行病理学切片观察以及检测组织中HYP、SOD及MDA的含量来评价UC-MSC对小鼠肺纤维化的影响。结果 病理学染色结果表明,治疗组(给予博来霉素+UC-MSC)较模型组(仅给予博来霉素)相比,治疗组不仅可降低炎症细胞的浸润以及胶原沉积等病理特征,还可降低由博来霉素诱导实验性小鼠肺纤维化模型中HYP(P<0.01)和MDA(P<0.05)的含量以及增高SOD的含量(P<0.01)。结论 UC-MSC可对由博来霉素诱导的实验性小鼠肺纤维化具有一定的保护作用。
脐带间充质干细胞;博来霉素;肺纤维化
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)一类以弥漫性肺泡炎和肺泡结构紊乱最终导致肺间质纤维化为特征的疾病[1]。目前临床上尚无确切的治疗手段并且其发病机制尚不清晰,因此,寻找治疗IPF的治疗措施成为研究热点。间充质干细胞(mesenchymal stem cells,MSC)是一种存在于多种组织中的具有具有自我复制能力和多向分化潜能的干细胞[2]。MSC也是一种理想的种子细胞现已在诸多领域得到广泛应用诸如组织工程等,其中MSC也可在用于治疗与修复肺纤维化等相关疾病[3]。人脐带来源的间充质干细胞(umbilical cord-mesenchymal stem cells,UC-MSC)是MSC一条重要的来源渠道,可作为细胞治疗中一种非常有希望的干细胞替代来源[4]。本研究拟通过博来霉素诱导实验性小鼠肺纤维化模型并给予UC-MSC干预后,通过检测肺组织羟基脯氨酸(hydroxyprine,HPY)、活性氧(superoxyde dismutase,SOD)及丙二醛(malonaldehyde,MDA)的含量、组织病理学观察来评价UC-MSC对肺纤维化的影响,为开发治疗IPF新措施提供数据支持。
1 材料与方法
1.1 主要实验试剂与仪器 新鲜脐带由天津市宝坻区人民医院提供(4 ℃保存备用),本试验脐带的获取以及动物实验[昆明种雌性小鼠150只,体质量(23±3)g,许可证号:TJBDRMH201510]的处置措施经院伦理委员会批准遵循《实验动物保护条例》。博来霉素购自天津太河制药有限公司;羟基脯氨酸(HYP)、活性氧(SOD)及丙二醛(MDA)试剂盒购自南京建成生物工程研究所;DMEM/F-12培养基、胎牛血清(fetal calf serum, FBS);胰蛋白酶购自美国Gibco公司;无菌操作台购自苏州净化有限公司,CO2培养箱购自长沙长锦科技公司。其余国产试剂均为分析纯。
1.2 方法
1.2.1 UC-MSC的培养与传代:参照文献[4],将取得的脐带经处理后,用眼科剪剪碎成粘稠状,取适量放人25 cm3的培养瓶中,覆盖70%~80%培养瓶的底面积即可。然后加入完全培养基(10%胎牛血清的DMEM),吹打混匀。放人无菌培养箱中培养。待培养基变成微黄时更换新鲜培养基,再继续培养一周可见具有梭形状的细胞围绕组织块边缘生长;待细胞长满培养瓶一半时丢弃掉组织块。每3天更换1次培养液,待细胞长慢瓶底时可进行传代,按1︰2~1︰3的比例进行传代,传至第4代时收集细胞,并制成密度为5×106/mL细胞悬液备用。
1.2.2 实验分组与处置:参照文献[5],将实验动物随机分为4组每组30只(对照组、UC-MSC组、博来霉素组和博来霉素+UC-MSC组)。第1天,所有小鼠经腹腔内注射戊巴比妥钠(30 mg/kg)对小鼠进行麻醉后,碘伏消毒,在无菌条件下,于颈部正中纵向剪开皮肤,逐层分离肌肉,暴露气管。按体重2.5 mg/kg向博来霉素组及博来霉素+UC-MSC组小鼠气管内一次性注人博来霉素,向对照组和UC-MSC组小鼠气管内注入相同体积的PBS,最后缝合皮肤,碘伏消毒,注射抗生素,正常饲养,每天记录小鼠的生长状况。术后3 d向对照组和博来霉素组通过尾静脉注入0.9%NaCl,UC-MSC组及博来霉素+UC-MSC组通过尾静脉注射UC-MSC 0.2 mL(含细胞数1×106个)。治疗结束(第21 d)后麻醉小鼠,12只小鼠取肺组织先经10% 福安马林中保存后制备、脱水、制备石蜡切片进行HE染色和Masson 染色。18只小鼠处死后对肺组织中HYP、SOD及MDA的含量进行检测。
1.2.3 UC-MSC形态学观察:参照文献[4],将UC-MSC传代至第4代,待细胞长满培养瓶底部时,弃掉培养基,PBS清洗3遍后更换新鲜的完全培养基。盖紧瓶盖,倒置显微镜下拍照观察第4代UC-MSC形态。
1.2.4 小鼠肺组织的病理学变化:参照文献[5],制备石蜡切片进行HE染色。肺组织经10% 福安马林固定后,蒸馏水冲洗,经脱水(30%、50%、70%、80%、95%、100%乙醇),二甲苯透明,透腊后进行石蜡包埋,待石蜡完全凝固后取出蜡块,在切片机上进行切片(厚度5 μm),烘片后经二甲苯脱蜡,梯度酒精水化(100%、95%、85%、75%乙醇),苏木素染色,酒精分化,伊红染色,中性树胶封片。 Masson 染色具体过程如下:石蜡切片按上述脱蜡至水,铬化处理或去汞盐沉淀,依次自来水和蒸馏水洗,苏木素液染核5~10 min。充分水洗,后用Masson 丽春红酸性复红液5~10 min,以2%冰醋酸水溶液浸洗片刻,1%磷钼酸水溶液分化3~5 min,不经水洗,直接用苯胺蓝染5 min,以0.2%冰醋酸水溶液浸洗片刻最后95%酒精、无水酒精、二甲苯透明、中性树胶封片。
1.2.5 肺组织HPY、SOD及MDA含量检测:参照文献[5],用组织碱水解法及分光光度法测定各个样本中HYP的含量,SOD及MDA含量检测按照试剂盒操作步骤检测。

2 结果
2.1 UC-MSC形态学观察 倒置相差显微镜下,第4代UC-MSC形态均一,呈梭形的细胞,传代6~7 d左右细胞长满瓶底,铺满瓶底,可见“铺路石”样,细胞质回缩,分裂相少见。见图1。
2.2 小鼠肺组织的病理学变化 HE结果表明,对照组(见图2A)与UC-MSC组(见图2B)小鼠肺组织结构基本正常,未见明显炎症细胞浸润,肺间质未见胶原沉积。博来霉素组小鼠在滴注博来霉素后表现为明显的急性炎症反应,肺泡壁水肿,肺间质内可见炎症细胞浸润,肺泡间隔增厚,可见大量炎症细胞浸润(见图2C),但是在博来霉素+UC-MSC组的小鼠肺脏炎症细胞浸润较博来霉素组减少(见图2D)。Masson 染色显示,对照组(见图3A)与UC-MSC组(见图3B)小鼠肺组织结构基本正常未见胶原蛋白沉积;博来霉素组小鼠在滴注博来霉素后可见肺泡间隔不同程度的,甚至出现肺实质大片融合性病变,病变区域及轻度病变区域与正常肺组织的混杂分布(见图3C),但是在博来霉素+UC-MSC组的严重程度(见图3D)较博来霉素组相比严重程度有所缓解。上述结果表明UC-MSC可保护博来霉素诱导的诱导实验性小鼠肺纤维化。

图2 各组小鼠肺组织 HE 染色 (×200) Fig.2 Histologic evaluation of different groups mouse lung tissues(×200)
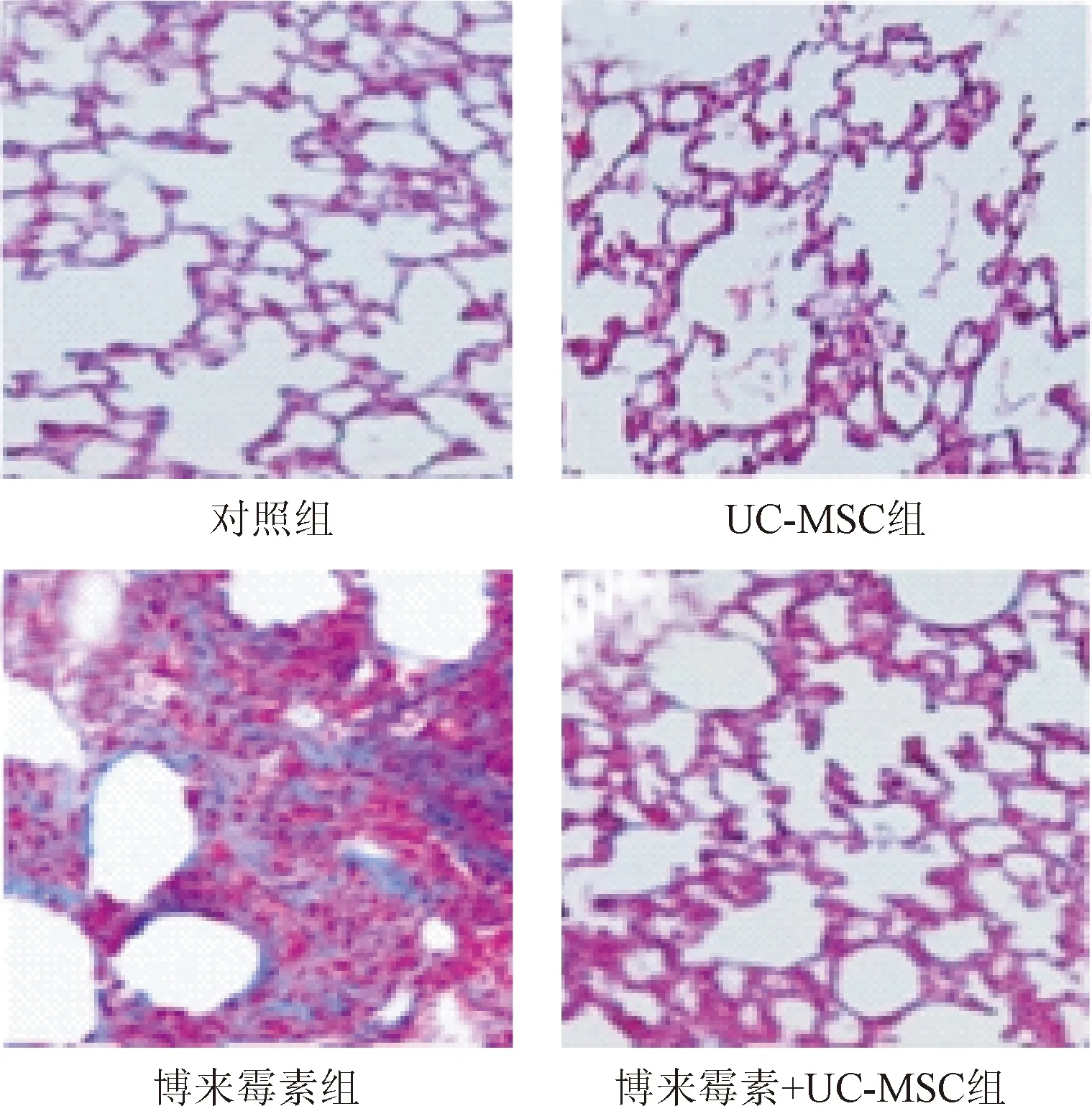
图3 各组小鼠肺组织 Masson 染色(×200)Fig.3 Massontrichrome staining of different groups mouse lung tissues(×200)
2.3 肺组织HYP、SOD和MDA含量 肺组织HYP、SOD和MDA含量检测结果见表1。对照组和UC-MSC组的HYP、SOD和MDA的含量相比较差异无统计学意义,表明单纯注射UC-MSC不会对小鼠体内HYP、SOD和MDA含量产生影响。
HYP含量检测中,博来霉素组中的含量明显高于对照组(P<0.01),而给予UC-MSC治疗的博来霉素+UC-MSC组中其HYP的含量与博来霉素组相比显著降低(P<0.01),结果表明UC-MSC可降低由博来霉素引发的HYP含量增高。
SOD含量检测中,博来霉素组中的含量明显低于对照组(P<0.01),而给予UC-MSC治疗的博来霉素+UC-MSC组中其SOD的含量与博来霉素组相比显著提高(P<0.01),结果表明UC-MSC可提高由博来霉素引发的SOD含量降低。
MDA含量检测中,同样,博来霉素组中的含量明显高于对照组(P<0.01),而给予UC-MSC治疗的博来霉素+UC-MSC组中其MDA的含量与博来霉素组相比较低(P<0.05),结果表明UC-MSC可降低由博来霉素引发的MDA含量增高。
综上所述,UC-MSC可降低由博来霉素诱导实验性小鼠肺纤维化模型中HYP和MDA的含量以及增高SOD的含量。UC-MSC对博来霉素诱导实验性小鼠肺纤维化具有一定的保护作用。

表1 各组小鼠肺组织HYP、SOD和MDA含量比较Tab.1 The content of HYP,SOD and MDA in different groups(±s,n=18)
*P<0.05,**P<0.01,与对照相比,compared with control group;#P<0.05,##P<0.01,与博来霉素组相比,compared with bleomycin group group
3 讨论
目前,成体骨髓来源的间充质干细胞作为一种理想的种子细胞在组织工程和再生医学中广泛应用[6]。但研究表明[7],成入骨髓间充质干细胞存在来源限制、细胞的活力受限于成人的年龄等诸多问题,因此寻找一种新的更具优势的替代细胞具有重要意义。
脐带间充质干细胞作为间充质干细胞一重要来源具有以下优点:首先,利用胎儿分娩后的废弃物来源易得;其次,其增殖能力较强,可不短传代培养,细胞长量较大;再次,连续多次传代后仍然维持干细胞特性[8]。脐带间充质干细胞作为成体骨髓来源的间充质干细胞的替代来源,具有很好的应用市场。故本研究以脐带间充质干细胞为研究对象,探讨其对小鼠肺纤维化的影响。
肺纤维化具体发病机制尚不清晰。研究表明[9],博来霉素致肺纤维化是通过介导自由基损伤等机制,其中活性氧是肺纤维化进程中的重要因子,当氧化与抗氧化系统紊乱时,组织便会发生损伤。因此,阻断过氧化反应,不仅可以促进肺损伤的修复,而且也可防止肺纤维化的发生和发展[10]。SOD是体内重要的清除氧自由基的酶,肺组织中SOD含量可以间接反映肺清除氧自由基的能力[5,11,12];本研究对肺组织SOD的含量进行了检测,结果显示,博来霉素组中的含量为(85.32±6.89)U/mg明显低于对照组(170.36±4.68)U/mg(P<0.01),而给予UC-MSC治疗的博来霉素+UC-MSC组中SOD的含量为(124.57±9.68)U/mg与博来霉素组相比显著提高(P<0.01)。MDA是肺组织内一种脂质过氧化物,是氧自由基产生连锁反应的一种重要成分,从而增强活性氧对肺组织的损伤,故对其含量进行检测可了解组织受氧自由基损伤的状况[13]。本研究对各组MDA的含量进行了检测,结果显示博来霉素组中的含量为(8.91±2.14)nmol/mg明显高于对照组的(6.74±1.23)nmol/mg(P<0.01),而给予UC-MSC治疗的博来霉素+UC-MSC组中其MDA的含量为(7.14±1.67)nmol/mg与博来霉素组相比较低(P<0.05)。HYP是肺组织胶原蛋白的重要成分,约占胶原蛋白氨基酸总量的13%,对HYP含量进行可评估肺纤维化的严重程度[14]。本研究对 HYP的含量进行了检测,结果显示博来霉素组中的含量为(697.15±65.36)μg/mg明显高于对照组(310.54±32.23)μg/mg(P<0.01),而给予UC-MSC治疗的博来霉素+UC-MSC组中其HYP的含量为(561.34±45.12)μg/mg与博来霉素组相比显著降低(P<0.01)。
本研究通过体外培养脐带间充质干细胞,采用第四代细胞经尾静脉注射干预由博来霉素诱导实验性小鼠肺纤维化模型,通过HE、Masson染色以及检测肺组织中,HPY、SOD和MDA的含量来评价UC-MSC对肺纤维化的影响。结果初步显示UC-MSC可减轻炎症细胞浸润以及肺间质胶原沉积,降低由博来霉素诱导实验性小鼠肺纤维化模型中HYP(P<0.01)和MDA(P<0.05)的含量以及增高SOD的含量(P<0.01)。 脐带间充质干细胞可保护博来霉素诱导的诱导实验性小鼠肺纤维化。
[1] American Thoracic Society. Idiopathic pulmonary fibrosis:diagnosis and treatment. International consensus statement.American Thoracic Society(ATS), and the European Respiratory Society(ERS). Am J Respir Crit Care Med. 2000;161(2 Pt 1):646-664.
[2 ] Parekkadan B, van Poll D, Suganuma K, et al. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure[J]. PLoS One, 2007,2(1): 941.
[3] 黄坤,吴晓梅,王欣燕,等.骨髓间充质干细胞移植对大鼠肺纤维化的影响[J].中华结核和呼吸杂志,2012(35):659-664.
[4] Lu LL, Liu YJ, Yang SG,et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(2): l0l7-1026.
[5] 郑金旭,卢坤琴,夏德刚,等. 柴胡皂甙d对博来霉素诱导肺纤维化小鼠的治疗作用及机制研究[J]. 中华医学杂志,2010,90(12):808-812.
[6] 吴军,张燕燕. 骨髓间充质干细胞生物学特性及临床应用进展[J]. 中国组织工程研究与临床康复,2007(50):10134-10137.
[7] 王丁. CD14单核细胞增强人脐带间充质干细胞的免疫抑制作用[D]. 北京:北京协和医学院,2010.
[8] 戎丽娟. IFN-γ对人脐带间充质干细胞生物学功能的影响[D]. 北京:北京协和医学院,2012.
[9] 庄谊,张德平. 肺纤维化与Th1/Th2失衡[J]. 国际呼吸杂志,2005(5):349-351.
[10] 李婷. Ang(1-7)和AngⅡ通过氧化应激对肺成纤维细胞迁移和肺纤维化的影响及其机制[D]. 广州:南方医科大学,2014.
[11] 胡凡艳. 七氟醚预处理对肺叶切除术患者单肺通气诱导的氧化应激损伤的影响[D]. 济南:山东大学,2012.
[12] 梁永祺. 黄芪多糖对EAhy.926细胞的抗氧化及抗炎作用[D]. 广州:南方医科大学,2013.
[13] 迟梅英,潘晓军,赵勇,等. 异丙酚对高氧肺损伤大鼠氧自由基、IL[J]. 齐鲁医学杂志,2007.
[14] 魏艳静,武惠珍,韦再华,等. 肝硬化腹水中羟脯氨酸含量的观察[J]. 河北医科大学学报,2000,(2):109.
(编校:谭玲)
Study on effect of UC-MSC in IPF experimental model induced by bleomycin in mice
FENG Li-junΔ, ZHANG Ying-chao
(Department of Respiration, Baodi College of Clinical Medicine, Tianjin Medical University, Tianjin 301800, China)
ObjectiveTo investigate protective of umbilical cord-mesenchymal stem cells(UC-MSC) on idiopathic pulmonary fibrosis(IPF) experimental mode was induced by bleomycin in mice.MethodsIPF experimental mode induced by bleomycin with intratracheal injection, and then the fourth generation UC-MSC was injected in caudal vein. The lung tissues were obtained to evaluate the influence of UC-MSC on IPF by the observation of histological evaluation(HE) and Masson staining, the detection content of hydroxyprine(HYP), superoxyde dismutase(SOD) and malonaldehyde(MDA).ResultsThe HE and Masson staining showed that bleomycin+UC-MSC group could alleviate inflammatory cell infiltration and pulmonary interstitial collagen deposition. bleomycin+UC-MSC group could decline the content of HYP(P<0.01), MDA(P<0.05) and improve the content of SOD(P<0.01)compared with bleomycin group.ConclusionUC-MSC exhibits an protective effect on IPF experimental mode induced by bleomycin in mice.
umbilical cord-derivedumbilical cord-derived cell; bleomycin; idiopathic pulmonary fibrosis
冯丽君,通信作者,女,大专,主任医师,研究方向:慢性阻塞性肺疾病,支气管哮喘间质性肺疾病等,E-mail:tianjinfenglijun@sina.com。
R285.5
A
1005-1678(2015)11-0019-04
