例谈四大平衡常数
2015-07-06张友伟
张友伟


新课标实施以来一项较大的变化就是化学由定性描述走向定量研究,其中体现之一就是四大平衡常数的引入给化学反应原理增加了有力的分析依据。“用数据来说话”让化学变得富有活力,同时也带来了一系列思维的发展与能力的考查,所以从一定意义上讲,掌握了四大平衡常数,就握住了一把解决化学问题的金钥匙。
一、四大平衡常数的比较
二、化学平衡常数
常考题型:
1.求解平衡常数。
2.由平衡常数算初始(或平衡)浓度。
3.计算转化率(或产率)。
4.应用平衡常数K判断平衡移动方向(或放热、吸热等情况)。
对策:
从基础的地方人手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力。
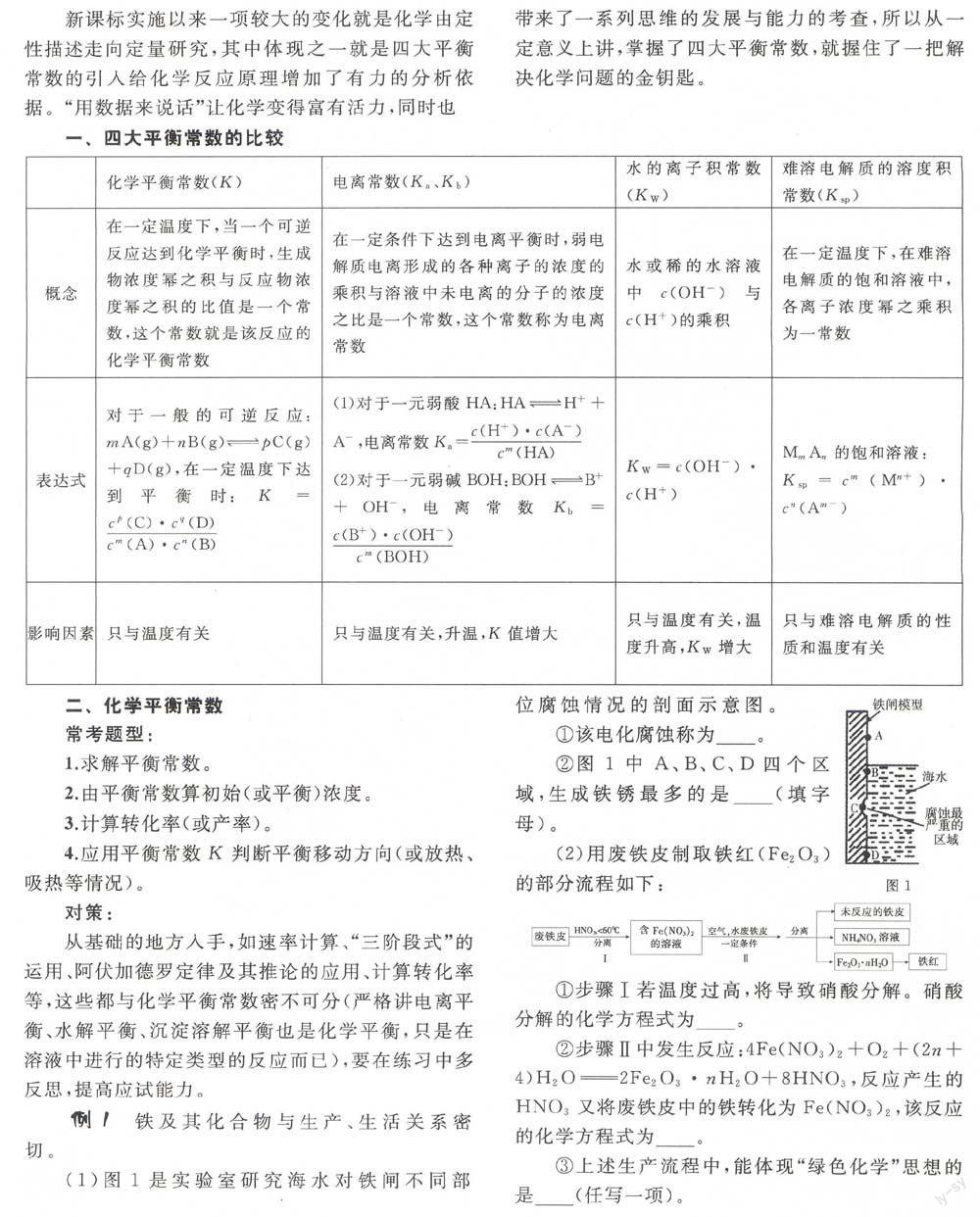
例1 铁及其化合物与生产、生活关系密切。
(l)图1是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为______。
②图1中A、B、C、D四个区域,生成铁锈最多的是_____(填字母)。
(2)用废铁皮制取铁红(Fe203)的部分流程如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为_______。
②步骤Ⅱ中发生反应:,反应产生的HN03又将废铁皮中的铁转化为Fe(N03)2,该反应的化学方程式为_____。
③上述生产流程中,能体现“绿色化学”思想的是_____(任写一项)。
(3)已知t℃时,反应的平衡常数K=0.25。
①t℃时,反应达到平衡时
②若在1 L密闭容器中加入0.02mol FeO(s),并通人x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=_____。
答案:(l)①吸氧腐蚀②B
(2)②
③氮氧化物排放少(或其他合理答案)
(3)①4:1 ②0.05
解析:(l)由图1可以看出,在海水中,该电化腐蚀属于吸氧腐蚀,在A、B、C、D四个区域中,生成铁锈最多的是B区,能接触到氧气。
(2)浓硝酸分解的化学方程式为硝酸氧化废铁皮中铁的化学方程式为,生产过程中体现绿色思想的是整个过程中氮氧化物排放减少。
(3)根据反应,平衡常数K为0.25,因为固体的浓度为1,则反应达到平衡时n(CO):n(CO2)=4:1,若在1L密闭容器中加入0.02 mol FeO(s),并通人x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%。
根据平衡常数K=0.25得:解得x=0.05。
三、电离常数
常考题型:
1.直接求电离平衡常数。
2.由电离平衡常数求弱酸(或弱碱)的浓度。
3.由Ka或Kb,求pH。试题一般难度不大,是在化学平衡基础上派生出来的。
对策:
注意平衡体系中同种离子的浓度是同一个浓度,当两个量相加或相减时,若相差100倍以上,要舍弃小的作为近似处理。
例2
已知某温度下CH3COOH和NH3·H20的电离常数相等,现向1O mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中()。
A.水的电离程度始终增大
B.先增大再减小
C.C(CH3COOH)与c(CH3COO)之和始终保持不变
D.当加入氨水的体积为1O mL时,c(NH+4)=C(CH3COO-)
解析:醋酸的电离方程式为,一水合氨的电离方程式为的电离方程式为所以开始滴加氨水时,水的电离程度增大(中和了醋酸电离出的H-),当两者恰好完全反应后,再滴加氨水,会抑制水的电离,使其电离程度减小,A错误。NH3·H2O的电离平衡常数,所以。温度不变,Kb不变,但随着氨水的不断滴加,逐渐增大,所以减小,B错误。随着氨水的不断滴加,溶液的体积增大,之和逐渐减小,C错误。当加入氨水的体积为10mL时,CH3COOH和NH3·H20恰好完全反应。因为两者的电离常数相等,所以CH3COONH4呈中性,,根据电荷守恒可知,D正确。答案为D。
四、水的离子积常数
常考题型:
1.计算温度高于室温时的Kw。
2.通过Kw的大小比较相应温度的高低。
3.溶液中c(H+)与c(OH-)相互换算。
4.酸、碱、能水解的盐溶液中水电离出的c(H+)或c(OH-)的计算。
对策:
Kw只与温度有关,升高温度,Kw增大;在稀溶液中,其中c(H+)、c(OH-)是溶液中的H-、OH-浓度;水电离出的H+數目与OH-数目相等。
例3 下列关于0.10 mol·L-1NaHCO3溶液的说法正确的是()。
A.溶质的电离方程式为
B.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:
D.温度升高,C(HCO-3)增大
解析:NaHC03的正确电离方程式为NaHC03,A项错误。根据可得,温度一定时,则Kw不变,B项正确。C项电荷不守恒,错误。温度升高,HC03的水解和電离程度都增大,则C(HC0-3)减小,D项错误。答案为B。
例4 图2表示水中c(H+)和c(OH+)的关系,下列判断错误的是()。
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有
C.图中TlD.XZ线上任意点均有pH=7
解析:水的离子积常数表达式为,适用于水及稀的水溶液,A项正确。观察题中图示,XZ线表示溶液呈中性,,M区域溶液呈碱性,,B项正确。图中Z点的大于X点的所以,C项正确。XZ线上任意点表示溶液呈中性,由于各点温度不同,但pH不一定为7,D项错误。答案为D。
五、难溶电解质的溶度积常数
常考题型:
1.溶解度与Ksp的相关转化与比较。
2.沉淀先后的计算与判断。
3.沉淀转化相关计算。
4.金属沉淀完全后的溶液pH及沉淀分离的相关计算。
5.与其他平衡(如氧化还原平衡、配位平衡)综合的计算。
6.数形结合的相关计算等。
对策:
应用Ksp数值大小比较物质的溶解度大小时,一定是在组成上属于同一类型的难溶电解质才能进行比较,否则,不能比较;在判断沉淀的生成或转化时,把离子浓度数值代入Ksp表达式,若数值大于Ksp,沉淀可生成或转化为相应难溶物质;利用Ksp可计算某些沉淀转化反应的化学平衡常数。
例5 溴酸银(AgBr03)溶解度随温度变化的曲线如图3所示,下列说法错误的是()。
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速率加快
C.60℃时溴酸银的Ksp约等于6×l0-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
解析:由图3可知随着温度的升高,AgBr03的溶解度逐渐增大,即AgBr03的溶解是吸热过程,A项错误。温度升高,其溶解速率加快,B项正确。60℃时,其,C项正确。AgBr03的溶解度较小,若KN03中混有AgBr03,可采用降温重结晶的方法提纯,D项正确。答案为A。
例6 下列有关电解质溶液中粒子浓度关系正确的是()。
A.pH=1的NaHS04溶液:
B.含有AgCI和Agl固体的悬浊液:
C.CO,的水溶液:
D.含等物质的量的和的溶液:
解析:由溶液中的电荷守恒得:,又因NaHSO4溶液中,所以,A项正确。因,所以含有AgCI和Agl固体的悬浊液中,B项错误。C02的水溶液中存在电离平衡:因第一步电离的程度远大于第二步电离的程度,故溶液中远大于,C项错误。根据物料守恒得:,故D项错误。答案为A。
