硝基羟乙唑与溶菌酶反应机制的荧光光谱研究
2015-07-02刘保生李志云李彤彤李改霞
刘保生,韩 荣,李志云,李彤彤,李改霞
(河北大学化学与环境科学学院河北省分析科学技术重点实验室,河北保定 071002)
硝基羟乙唑与溶菌酶反应机制的荧光光谱研究
刘保生*,韩 荣,李志云,李彤彤,李改霞
(河北大学化学与环境科学学院河北省分析科学技术重点实验室,河北保定 071002)
分别在298,310,318 K温度下,利用荧光光谱法研究了pH=7.40生理条件下硝基羟乙唑(TRI)与溶菌酶(LYSO)的相互作用机理。结果表明,TRI与LYSO间通过静态猝灭方式相互作用。测定了LYSO与TRI反应的结合常数、结合位点数。利用反应过程的热力学参数,确定了LYSO-TRI体系的作用力类型;由Hill系数得出了LYSO或TRI的协同性;根据非辐射能量转移理论,确定了TRI到LYSO的结合距离,同时采用同步光谱法考察了TRI对LYSO构象的影响。
荧光光谱法;同步光谱法;溶菌酶;硝基羟乙唑;反应机理
1 引 言
溶菌酶(lysozyme,LYSO)[1]是一种广泛存在于生物体内唾液、眼泪、血液、淋巴组织等部位的免疫球蛋白,单体分子的多肽链由129个氨基酸残基组成,包括6个色氨酸残基(Trp 28、Trp 62、Trp 63、Trp 108、Trp 111和Trp 123)、3个酪氨酸(Tyr)残基和4对二硫键来维持构型。另外,LYSO一个重要的功能就是可以运载小分子物质[2],通过与药物小分子的结合作用达到治愈疾病的效果。
硝基羟乙唑(TRI)[3]是现今结构简单并且应用广泛的抗厌氧菌的药物,主要用于治疗拟杆菌、弯曲杆菌、俊状芽孢杆菌等厌氧菌感染的治疗。目前关于LYSO的研究较多,但没有报道过与TRI作用机制的研究。本文通过荧光光谱法、同步光谱法来研究TRI和LYSO的相互作用信息及TRI对LYSO构象的影响,为更好地了解药物在体内的输送和作用机制提供了重要信息。
2 实 验
2.1 仪器与试剂
实验仪器:日本SHIMADZU制作所的RF-5301PC荧光分光光度计和UV-265紫外可见分光光度计;上海雷磁仪器厂的pHS-3C型精密酸度计;南京桑力电子设备厂的SYC-15B型超级恒温水浴。
试剂:溶菌酶(LYSO,美国Sigma公司,纯度≥99%)配成浓度为2.0×10-5mol/L的储蓄液;硝基羟乙唑(TRI)标准品(美国Sigma公司,纯度≥99%)配成1.0×10-3mol/L的储蓄液,用时依次稀释;Tris-HCl缓冲溶液(内含0.15 mol/L NaCl,pH=7.40)。实验用水为二次蒸馏水,溶液于4℃冰箱保存。TRI的结构式如图1所示。
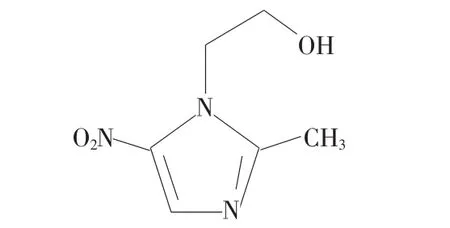
图1 硝基羟乙唑的结构式Fig.1 Chemical structure of TRI
用“内滤光效应”公式[4]对实验所测荧光强度进行校正:

校正后和观察到的LYSO-TRI体系荧光强度用Fcor和Fobs表示,TRI在激发和发射波长处的吸光度值用Aex和Aem表示。
2.2 实验步骤
在298,310,318 K下,在一系列10 mL比色管中依次加入1.0 mL的Tris-HCl缓冲溶液、0.2 mL浓度为2.0×10-5mol/L的LYSO溶液及不同浓度的TRI溶液,定容、摇匀,水浴静置20 min。激发波长λex=280 nm或295 nm,狭缝宽度5 nm,扫描LYSO-TRI体系的荧光光谱。同时固定波长差Δλ=15 nm以及Δλ=60 nm,记录LYSOTRI体系的同步荧光光谱。
3 结果与讨论
3.1 LYSO-TRI体系的荧光猝灭光谱
TRI对LYSO的荧光猝灭见图2(λex=295 nm时的谱图与其类似)。由图2可知,TRI能够猝灭LYSO的荧光且LYSO发射峰红移20 nm,表明TRI与LYSO作用生成复合物[5]。

图2 LYSO-TRI体系的荧光发射光谱(T=298 K, λex=280 nm)Fig.2 Fluorescence emission spectra of LYSO-TRI system (T=298 K,λex=280 nm)
将实验数据用Stern-Volmer方程[6]处理:
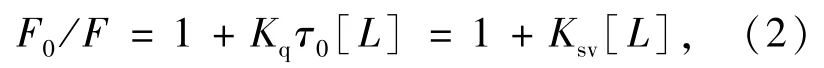
式中F0、F分别为无、有TRI时的荧光强度;τ0为分子荧光平均寿命,约为10-8s;Ksv为Stern-Volmer猝灭常数;[L]为TRI的浓度;Kq为猝灭速率常数。所得数据列于表1。LYSO-TRI体系的Stern-Volmer曲线见图3,可以看出,LYSO的相对荧光强度F0/F和猝灭剂TRI浓度呈现良好的线性关系,线性相关系数达到了0.99以上。曲线斜率即Ksv值列于表1。由表1可知,Ksv随着温度的升高而减小及Kq值均大于2.0×1010L·mol-1· s-1[7],都表明TRI对LYSO的猝灭过程是由反应生成复合物而引起的静态猝灭过程[8]。对该过程,用公式(3)[9]处理实验所得数据:


表1 不同温度下TRI与LYSO的猝灭反应参数Table 1 Quenching reactive parameters of TRIand LYSO at different temperatures

图3 不同温度时的TRI对LYSO的荧光猝灭Stern-Volmer曲线Fig.3 Stern-Volmer plots for the quenching of LYSO by TRI at different temperatures

式中[Dt]、[Bt]分别为TRI和LYSO的总浓度。由曲线截距、斜率,可得到结合常数Ka及位点数n值,结果列于表1。由表1可知,LYSO-TRI体系结合位点数n约为1,即TRI与LYSO形成1∶1的复合物;体系的结合常数Ka随温度的升高而降低,进一步表明TRI与LYSO相互作用方式为静态猝灭[10]。
3.2 LYSO-TRI体系作用力类型
LYSO-TRI体系的作用力类型可以由LYSO与TRI反应的热力学参数进行推断,热力学参数由公式(4)、(5)[11]得出:
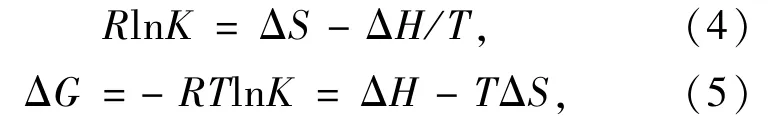
温度范围变化较小时,反应的焓变ΔH可以看作定值[12],ΔH可以由R ln K对T-1作图得到。为了增加ΔH的准确度,我们又测定了293 K和303 K两个温度的结合常数(实验步骤同2.2节),计算结果见表2。由表2可知,反应过程中的ΔG<0,表明LYSO与TRI的结合反应是自发的;ΔH<0,ΔS>0,表明LYSO与TRI的结合以静电作用力为主[13]。

表2 不同温度下LYSO-TRI体系的热力学参数(λex=280 nm)Table 2 Thermodynamic parameters of LYSO-TRIat different temperatures(λex=280 nm)
3.3 药物协同性
蛋白质与配体结合的协同性定量分析一般用Hill系数nH表现出来[14]:

其中,K为结合常数,Y为结合饱和分数,nH为Hill系数。

在荧光实验中:

式中,1/Qm为以1/Q对1/[L]作图的截距。计算结果列于表3。由表3可知:温度分别在298, 310,318 K时,nH值都略大于1,表明TRI与LYSO反应后,促进了后继配体与LYSO的作用,但这种效应很微弱,即存在较弱的正协同作用;并且随温度的升高,这种正协同效应依次减弱,说明后继配体随着温度的升高较难与LYSO结合,结合常数也就随着减小[15]。
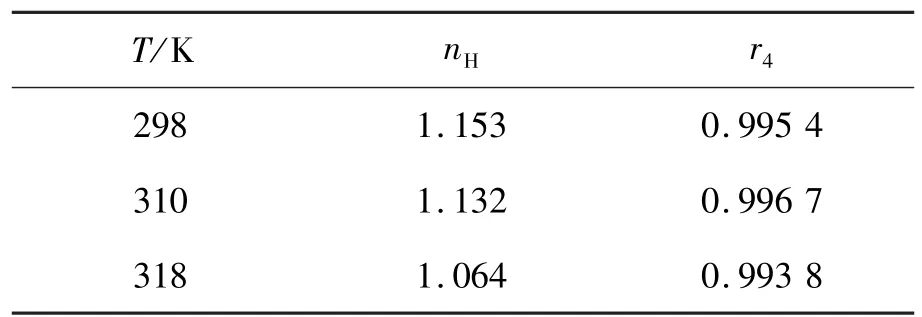
表3 不同温度下LYSO-TRI体系的Hill系数nH(λex= 280 nm)Table 3 Hill coefficient of LYSO-TRI systems at different temperatures(λex=280 nm)
3.4 LYSO-TRI体系的结合距离
根据Förster非辐射能量转移理论,能量供体LYSO与能量受体TRI间距离r、能量转移效率E和E是50%时的临界能量转移距离R0之间的关系[16]:

式中,F0为LYSO的荧光强度;F为LYSO和TRI浓度为1∶1的荧光强度;K2是取向因子,取LYSO和TRI各向随机分布的平均值2/3;N为溶剂水的折射率,取有机物和水的平均值为1.336;Φ为没有TRI存在时LYSO的荧光量子产率,取LYSO中Trp的量子产率0.15;LYSO的荧光发射光谱和TRI的紫外吸收光谱见图4,阴影部分即重叠积分J;F(λ)、ε(λ)分别为在波长λ处LYSO的荧光强度和TRI的摩尔吸光系数。由公式计算得到的E、J、R0、r列于表4。从表4可知r<7 nm,说明LYSO与TRI间存在非辐射能量转移,使LYSO与TRI更容易发生能量的传递[17];随着体系温度的升高,能量转移效率E减小且结合距离r增大,使得体系生成的LYSO-TRI复合物的稳定性降低,结合常数减小。这进一步说明TRI与LYSO之间通过静态猝灭方式相互作用[18]。

图4 LYSO的荧光发射光谱(λex=280 nm)(1)和TRI的紫外吸收光谱(2),T=298 K,CTRI=CLYSO=8.0× 10-7mol/L。Fig.4 Overlap of the fluorescence emission spectrum of LYSO(λex=280 nm)(1)and the absorption spectrum of TRI(2).T=298 K,CTRI=CLYSO=8.0×10-7mol/L.

表4 不同温度下LYSO与TRI之间的结合参数Table 4 Binding parameters between LYSO and TRI at different temperatures
3.5 LYSO-TRI体系的同步荧光光谱
一般来说,同步荧光光谱可以提供蛋白质荧光团的微环境信息,图5反映的就是LYSO-TRI体系的同步荧光光谱。对于LYSO而言,Δλ=60 nm仅反映LYSO中Trp残基的光谱信息,即包括残基的荧光强度和极性的改变,而Δλ=15 nm反映的是LYSO中Tyr残基的光谱信息[19]。当Δλ=60 nm时,LYSO-TRI体系的Trp残基的荧光强度随TRI浓度的升高而减少,进一步表明TRI猝灭了LYSO的荧光;但当Δλ=15 nm时,体系的Tyr荧光强度基本不变,这说明TRI作用于LYSO时,Trp残基几乎不参与体系的反应。另外,由图5可知发射峰位置未发生位移,说明TRI对LYSO的作用并没有改变Trp、Tyr残基所处的微环境的极性,也就是说LYSO的构象并没有发生改变[20]。
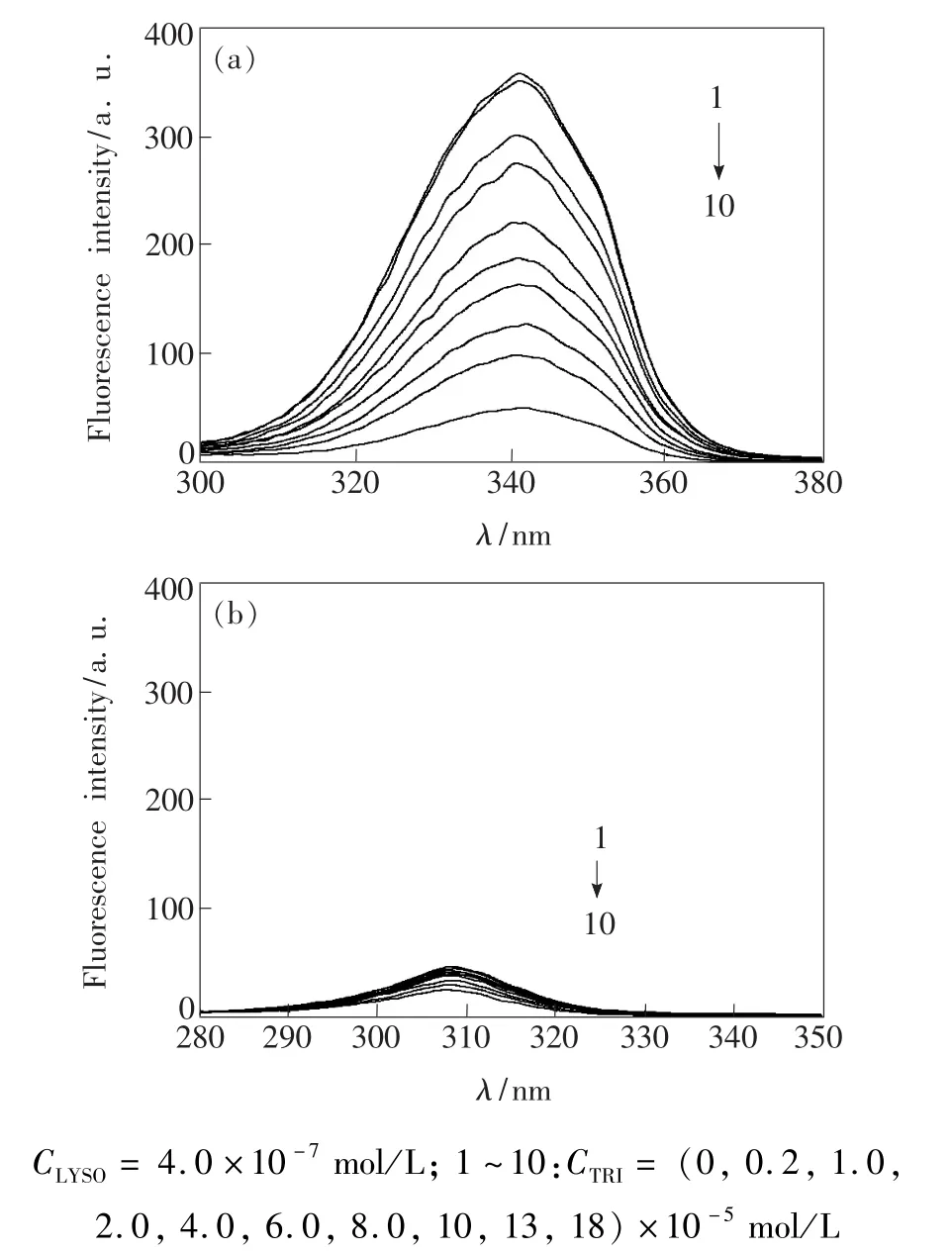
图5 LYSO-TRI体系的同步荧光光谱。(a)Δλ=60 nm; (b)Δλ=15 nm。Fig.5 Synchronous fluorescence spectra of LYSO-TRI system.(a)Δλ=60 nm.(b)Δλ=15 nm.
4 结 论
TRI以静态猝灭方式与LYSO作用并伴有非辐射能量转移,TRI与LYSO反应的结合常数均为104数量级,结合位点数约为1,表明它们相互作用形成1∶1复合物。TRI与LYSO间以静电作用力相互结合,并且结合过程中TRI对后继配体有较弱的正协同效应。该机制研究有助于了解溶菌酶作为一种模型蛋白与药物小分子的作用机理,有助于了解药物在体内的运输和代谢过程,为药物的动力学和临床医学研究提供了重要信息。
[1]Krishnamoorthy S,Shanmugam A,Malaichamy I.Probing the binding interaction of thionine with lysozyme:A spectroscopic and molecular docking investigation[J].Dyes Pigments,2015,112:210-219.
[2]Wang Z,Li D J,Jin J.Study on the interaction of puerarin with lysozyme by spectroscopic methods[J].Spectrochim. Acta A,2008,70(4):866-870.
[3]Li X Y.Interaction ofmetronidazolewith bovine serum albumin by using fluorescence and resonance light scattering spectra[J].Acta Phys.Chim.Sinica(物理化学学报),2007,23(2):262-267(in Chinese).
[4]Wang Q,He JW,Yan J,et al.Spectroscopy and docking simulations of the interaction between lochnericine and bovine serum albumin[J].Luminescence,2015,30(2):240-246.
[5]Teng Y,Ji F Y,Li C,et al.Interaction mechanism between 4-aminoantipyrine and the enzyme lysozyme[J].J.Lumin., 2011,131(12):2661-2667.
[6]Wang W P,Min W N,Chen JR,et al.Binding study of diprophylline with lysozyme by spectroscopicmethods[J].J. Lumin.,2011,131(4):820-824.
[7]Paramaguru G,Kathiravan A,Selvaraj S,et al.Interaction of anthraquinone dyes with lysozyme:Evidences from spectroscopic and docking studies[J].J.Hazard.Mater.,2010,175(1-3):985-991.
[8]Zhu JF,Li D G,Wu LM,et al.Binding analysis of farrerol to lysozyme by spectroscopic methods[J].Spectrochim. Acta A,2007,68(2):354-359.
[9]Ding F,Zhao G Y,Huang JL,et al.Fluorescence spectroscopic investigation of the interaction between chloramphenicol and lysozyme[J].Eur.J.Med.Chem.,2009,44(10):4083-4089.
[10]Wang Y Q,Chen T T,Zhang H M.Investigation of the interactions of lysozyme and trypsin with biphenol A using spectroscopic methods[J].Spectrochim.Acta A,2010,75(3):1130-1137.
[11]Wang Y Q,Zhang H M,Zhang G C,et al.Interaction of the flavonoid hesperidin with bovine serum albumin:A fluorescence quenching study[J].J.Lumin.,2007,126(1):211-218.
[12]Zhang GW,Chen X X,Guo JB,et al.Study on the interaction of hesperidin or icariin with lysozyme by fluorescence spectroscopy[J].Spectrosc.Spect.Anal.(光谱学与光谱分析),2009,29(1):184-187(in Chinese).
[13]Xu Q,Deng D D,Cao Z J,et al.Interaction between serum albumin and four flavones by fluorescence spectroscopy and molecular docking[J].Chin.J.Anal.Chem.(分析化学),2010,38(4):483-487(in Chinese).
[14]Liang H,Bian H D,Tu CQ,et al.Binding equilibrium study between La(Ⅲ)and HSA or BSA[J].Chem.J.Chin. Univ.(高等学校化学学报),2001,22(1):21-25(in Chinese).
[15]Liu B S,Yang C,Wang J,et al.Luminescencemechanism study of the conjugation reaction between cefpirome sulfate and bovine serum albumin[J].Chin.J.Lumin.(发光学报),2011,32(3):293-299(in Chinese).
[16]Zhao X C,Liu R T,Teng Y,etal.The interaction between Ag+and bovine serum albumin:A spectroscopic investigation [J].Sci.Total.Environ.,2011,409(5):892-897.
[17]Wang N,Ye L,Yan F F,et al.Spectroscopic studies on the interaction of azelnidipine with bovine serum albumin[J]. Int.J.Pharm.,2008,351(1-2):55-60.
[18]Li D J,Cao X X,Ji BM.Spectrophotometric studies on the interaction betweenmyricetin and lysozyme in the absence or presence of Cu2+or Fe3+[J].J.Lumin.,2010,130(10):1893-1900.
[19]Zhang GW,Chen X X,Guo JB,et al.Spectroscopic investigation of the interaction between chrysin and bovine serum albumin[J].J.Mol.Struct.,2009,921(1-3):346-351.
[20]Hu Y Y,Xu SQ,Zhu X S,et al.Study on the interaction between methyl violet and bovine serum albumin by spectral analyses[J].Spectrochim.Acta A,2009,74(2):526-531.
Investigation of The Interaction M echanism Between Lysozyme and Trichazol Using Fluorescence Spectroscopic M ethod
LIU Bao-sheng*,HAN Rong,LIZhi-yun,LITong-tong,LIGai-xia
(Key Laboratory ofAnalytical Science and Technology ofHebei Province,College ofChemistry&Environmental Science, Hebei University,Baoding 071002,China)
*Corresponding Author,E-mail:lbs@hbu.edu.cn
The interaction mechanism of trichazol(TRI)to lysozyme(LYSO)at different temperatures(298,310,318 K)was investigated using fluorescence spectroscopy under simulative physiological conditions.The results clearly demonstrated that TRI caused strong quenching of the fluorescence of LYSO by a static quenchingmechanism.The binding constantswere order ofmagnitude of 104and the number of binding site in the interaction was closed to 1.The thermodynamic parameters of LYSO-TRIsystem were determined as follows:negativeΔH and positiveΔS,which indicated that electrostatic interaction played amajor role in the binding reaction.The effectof cooperative binding of TRIwas quantified by Hill's coefficient(nH)and the values of nHwere slightlymore than 1 in the systems,which indicated weakly positive cooperativeness in the interaction of TRIwith LYSO.The binding distance(r)between TRIand LYSO was obtained based on the Förster nonradioactive resonance energy transfer and r was less than 7 nm.Furthermore,the effect of TRIon the conformation of LYSO was analyzed by using the synchronous fluorescence spectroscopy.
fluorescence spectroscopy;synchronous fluorescence spectroscopy;lysozyme;trichazol;interaction mechanism

刘保生(1963-),男,河北保定人,研究员,1992年于河北大学获得硕士学位,主要从事分子发光学理论与应用的研究。E-mail:lbs@hbu.edu.cn
O657.3
A
10.3788/fgxb20153612.1458
1000-7032(2015)12-1458-06
2015-06-21;
2015-10-27
国家自然科学基金(21375032);河北大学2014-2015学年实验室开放项目(2014037)资助
