秦川牛ADIG基因重组腺病毒过表达载体的构建与病毒包装
2015-07-02姜碧杰昝林森
张 琼,姜碧杰,成 功,刘 扬,昝林森,2
(1 西北农林科技大学 动物科技学院,陕西 杨凌 712100;2 国家肉牛改良中心,陕西 杨凌 712100)
秦川牛ADIG基因重组腺病毒过表达载体的构建与病毒包装
张 琼1,姜碧杰1,成 功1,刘 扬1,昝林森1,2
(1 西北农林科技大学 动物科技学院,陕西 杨凌 712100;2 国家肉牛改良中心,陕西 杨凌 712100)
【目的】 构建秦川牛ADIG基因的重组腺病毒载体,包装并扩繁病毒,为下一步研究该基因在脂肪细胞分化过程中的分子作用机制和相关信号通路奠定基础。【方法】 根据NCBI收录的家牛ADIG基因(NM_001113720.1)mRNA序列设计引物,以秦川牛组织样提取的总RNA反转录而成的cDNA为模板,通过RT-PCR和PCR扩增获得目的基因,将其连接到pMD®19-T Simple载体并测序。质粒提取纯化后通过BglⅡ与SalⅠ双酶切,然后胶回收酶切产物,将其连接到穿梭载体pAdTrack/CMV上,构建重组穿梭质粒pAdTrack/CMV-ADIG。将pAdTrack/CMV-ADIG质粒用PmeⅠ酶切线性化,转化含有腺病毒骨架载体pAdEasy-1的大肠杆菌 BJ5183感受态细胞中进行同源重组,构建重组腺病毒质粒pAD-ADIG,并用PacⅠ酶切鉴定,提取质粒后转化大肠杆菌Top10进行扩繁。用PacⅠ酶切线性化pAD-ADIG载体并回收质粒大片段,转染293A细胞进行病毒包装,然后完成病毒扩繁和病毒滴度的测定。【结果】 PCR扩增获得了399 bpADIG基因CDS区;成功构建了重组穿梭质粒pAdTrack/CMV-ADIG和重组腺病毒质粒pAD-ADIG。经检测,ADIG重组腺病毒包装成功,扩繁后得到了高滴度的腺病毒(1×108PFU/mL)。【结论】 成功构建了秦川牛ADIG基因的重组腺病毒表达载体pAD-ADIG,完成了病毒包装和扩繁。
ADIG;腺病毒;同源重组;秦川牛
Kim等[1]在小鼠脂肪组织基因芯片筛选中,发现了一个异于其他蛋白质家族的潜在肥胖基因SMAF1,被称为小脂肪细胞因子1(Small adipocyte factor 1)。该基因有0.7 kb转录本,编码一个新的由80个氨基酸组成的10 ku跨膜蛋白,同源性检测暗示该基因可能只在哺乳动物中存在。该基因编码蛋白的N端富含亮氨酸,C末端富含酸性氨基酸,它的调控和表达暗示了这个新蛋白在脂肪细胞转录组中占据了独特的地位,并且在脂肪组织的生理学和病理学方面起作用。SMAF1基因仅在脂肪细胞中特异性表达,在牛上被命名为ADIG。有研究表明[1],在分离来自大鼠和小鼠上的原代脂肪前体细胞中该基因表达缺失;SMAF1基因表达与脂肪细胞基因表型呈现密切相关;不仅如此,SMAF1基因在脂肪细胞中的mRNA水平与脂肪细胞成熟分化程度呈正相关,但目前对SMAF1基因在脂肪细胞分化过程中所起的作用尚不清楚。本研究对秦川牛ADIG基因进行克隆,利用AdEasy系统构建该基因的重组腺病毒表达载体,并对其进行了病毒包装和扩繁,旨在为下一步研究该基因在秦川牛脂肪细胞分化中的作用奠定基础。
1 材料与方法
1.1 材 料
腺病毒穿梭载体 pAdTrack/CMV、腺病毒骨架载体 pAdEasy-1均由西北农林科技大学动物科技学院罗军教授惠赠,质粒小提试剂盒购自OMEGA公司,大肠杆菌 Topl0、大量琼脂糖凝胶 DNA 回收试剂盒、LATaqDNA 聚合酶、KOD-Plus-Ver 2.0高保真酶、pMD®19-T Simple载体、T4 DNA ligase及限制性内切酶BglⅡ、SalⅠ购自大连宝生物公司,反转录试剂盒、超纯琼脂糖购自美国 Invitrogen 公司,限制性内切酶PmeⅠ购自英国NEB公司,PCR引物由美国Invitrogen公司合成。
1.2 样品采集
以国家肉牛改良中心饲养的秦川牛(2~3岁)为研究对象,屠宰后采集附睾脂肪组织,用DEPC水洗净样品表面残留的血液及杂质,迅速投入到液氮中保存,用于总RNA的提取。
1.3 总RNA的提取及cDNA模板的合成
利用Trizol法提取脂肪组织的总RNA,凝胶电泳检测证实RNA的完整性较好,按照试剂盒说明将其反转录生成 cDNA第一链。
1.4 秦川牛ADIG基因的克隆与测序鉴定
1.4.1 引物的设计与合成 根据NCBI收录的牛ADIG基因(GenBank登录号:NM_001113720.1)的mRNA序列,运用Primer 5.0设计引物,上游引物添加BglⅡ酶切位点(下划线),下游引物添加SalⅠ酶切位点(下划线),并在两端加上保护碱基,引物由南京金斯瑞公司合成。上游引物:5′-GGAAGATCTTAGCCACACACGCACCAT-3′,下游引物:5′-ACGCGTCGACCCAAAGTCCTCT-CCCCTC-3′。
1.4.2 完整编码区(CDS)的克隆 以秦川牛组织样提取的总RNA反转录而成的cDNA为模板,采用逆转录-聚合酶链式反应(Reverse transcription-PCR,RT-PCR)技术,利用KOD-Plus-Ver 2.0高保真酶扩增目的基因的完整CDS区,反应体系为:DNA 模板50 ng,1 U/μL KOD-Plus-Ver 2.0高保真酶0.4~0.6 μL,10×PCR Buffer 2 μL,2 mmol/L dNTP 2 μL,25 mol/L MgSO40.9~1.2 μL,上、下游引物各0.8 μL,补加ddH2O至总体积为20 μL。PCR反应条件为:95 ℃预变性 10 min;98 ℃变性 12 s,60~53 ℃退火30 s(此处设置梯度退火目的是寻找最佳扩增效果的退火温度),68 ℃延伸 35 s,30个循环;68 ℃后延伸10 min,4 ℃冷却10 min。将PCR产物进行1%琼脂糖凝胶电泳检测,确认片段大小是否与预期相符。
取扩增得到的PCR产物5 μL加入1 μL普通TaqDNA聚合酶,72 ℃加“A”反应10 min。加“A”产物使用DNA凝胶回收试剂盒进行片段纯化。
1.4.3 目的基因的亚克隆 将1.4.2节的PCR产物与pMD®19-T Simple载体于16 ℃反应30 min后得到连接产物pMD-T-ADIG,连接体系为:pMD®19-T Simple 载体1 μL,PCR 回收产物1 μL,Solution Ⅰ 5 μL,加 ddH2O 至10 μL。将连接产物转化入TSS法制备的大肠杆菌Top10感受态细胞中,挑取经菌落PCR初步鉴定呈阳性的单克隆进行摇菌,扩繁后参照Omega质粒提取说明书提取质粒,用BglⅡ和SalⅠ双酶切鉴定正确后送西安Takara公司测序。
1.5 pAdTrack/CMV-ADIG质粒的构建
用BglⅡ和SalⅠ限制性内切酶对pMD-T-ADIG重组质粒和腺病毒穿梭质粒pAdTrack/CMV分别进行双酶切,琼脂糖凝胶(0.8%)电泳检测并进行胶回收。将酶切后的重组质粒和腺病毒穿梭质粒于16 ℃连接30 min,得到连接产物pAdTrack/CMV-ADIG,然后将其转入大肠杆菌Top10感受态细胞中。将菌液均匀涂抹在含50 g/L卡那霉素的LB固体培养基上培养14~20 h,挑取单克隆扩繁后做菌液PCR鉴定,并提取阳性菌液质粒,BglⅡ和SalⅠ双酶切鉴定正确后送西安Takara公司测序。
1.6 重组腺病毒质粒pAD-ADIG的构建及测序鉴定
用限制性内切酶PmeⅠ将pAdTrack/CMV-ADIG质粒线性化,转入含有腺病毒骨架载体pAdEasy-1的大肠杆菌BJ5183感受态细胞中,将菌液均匀涂抹在含50 g/L卡那霉素的LB固体培养基上培养20~30 h,挑取较小的菌落进行扩繁后提取质粒,并利用PacⅠ内切酶进行初步鉴定之后进行电泳检测。由于BJ5183菌株属于低拷贝菌种,因此将初步鉴定正确的质粒转入大肠杆菌Top10感受态细胞中进行扩繁,菌液送西安Takara公司测序。测序正确的菌液进一步扩繁后,使用无内毒素质粒提取试剂盒提取质粒,PacⅠ酶切线性化后用异丙醇沉淀法沉淀DNA片段,酶标仪测定DNA浓度备用。
1.7 重组腺病毒质粒pAD-ADIG的包装与扩繁
用无内毒素质粒小量提取试剂盒抽提重组质粒pAD-ADIG,测定质粒浓度并取5 μg重组质粒用PacⅠ酶切,然后胶回收大片段,用TurboFectTMinvitroTransfection Rengent 以每孔(6孔板)2 μg的量转染汇合度为80%左右的293A细胞包装病毒。转染后每天在荧光显微镜下观察绿色荧光数量与分布情况并拍照,了解腺病毒包装进程。用第1代病毒悬液侵染融合度为100%的293A细胞,按前述方法收集上清液,即为第2代病毒悬液。再用第2代病毒悬液侵染293A细胞,重复“侵染-冻融-收集”。收集高滴度病毒悬液,用绿色荧光蛋白(GEP)标记法测定病毒滴度,具体步骤参考Lybarger等[2]及Hett等[3]的方法。
2 结果与分析
2.1 ADIG基因CDS区的克隆结果鉴定
用KOD-Plus-Ver 2.0高保真酶选用梯度退火温度的方法扩增ADIG基因CDS区,获得了399 bp长度的目的片段;当退火温度为60 ℃时,目的基因扩增效果特异性好,杂带明显减少,同时目的基因条带清晰明亮(图1)。

图1 秦川牛ADIG基因CDS区扩增结果的琼脂糖凝胶电泳检测1~8.退火温度依次为60,59,58,57,56,55,54,53 ℃下ADIG基因的扩增结果;9.DNA MarkerFig.1 Detection of CDS part of ADIG gene using agarose gel electrophoresis1-8.PCR products of ADIG gene under different annealing degrees (60,59,58,57,56,55,54,and 53 ℃);9.DNA Marker
2.2 pMD-T-ADIG质粒的鉴定
用BglⅡ和SalⅠ限制性内切酶对pMD-T-ADIG载体双酶切,获得了约400 bp的目的片段。测序结果比对后发现其具有完整的CDS区,且无任何突变位点,进一步确定目的片段序列完好,可用于下一步穿梭载体的构建。
2.3 pAdTrack/CMV-ADIG穿梭质粒的鉴定
用BglⅡ和SalⅠ限制性内切酶对pAdTrack/CMV-ADIG载体双酶切,琼脂糖凝胶电泳分别得到长度约为400和9 000 bp 2条带(图2),与预期结果相一致,证明pAdTrack/CMV-ADIG穿梭载体构建成功。
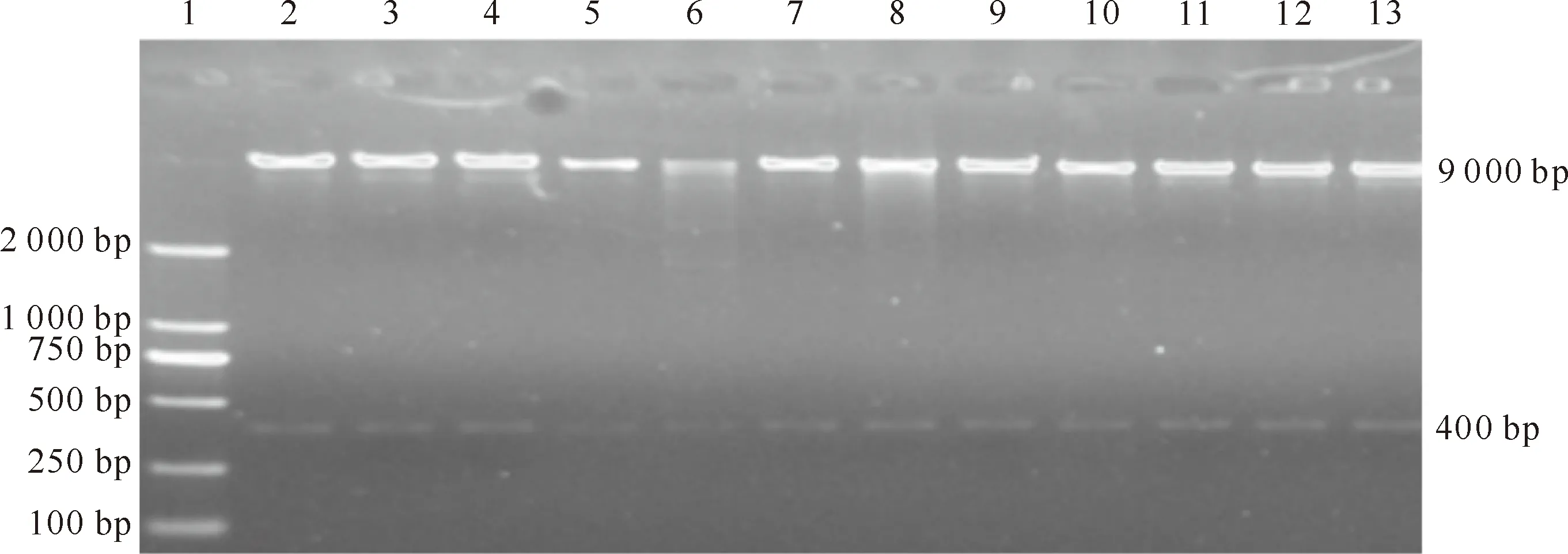
图2 pAdTrack/CMV-ADIG穿梭质粒的双酶切鉴定1.DNA Marker;2~12.pAdTrack/CMV-ADIG载体BglⅡ和SalⅠ双酶切结果 Fig.2 Dual enzyme digestion of pAdTrack/CMV-ADIG1.DNA Marker;2-12.Results of pAdTrack/CMV-ADIG digested by BglⅡ and SalⅠ
2.4 pAD-ADIG重组质粒的鉴定
提取pAD-ADIG质粒经进行PacⅠ酶切鉴定,结果在4.5 kb处出现了目的条带(图3),表明腺病毒重组成功。

图3 pAD-ADIG重组腺病毒质粒的PacⅠ酶切鉴定1~6.pAD-ADIG质粒经PacⅠ酶切结果;7.DNA MarkerFig.3 PacⅠdigestion of pAD-ADIG1-6. Results of pAD-ADIG digested with PacⅠ; 7.DNA Marker
2.5 重组腺病毒质粒pAD-ADIG的包装与扩繁
用PacⅠ酶切线性化pAD-ADIG重组腺病毒载体,回收DNA大片段并转染293A细胞。转染30 h,荧光倒置显微镜观察,仅有少量的绿色荧光亮点(图4-A);转染7 d,绿色荧光细胞明显增多,视野变亮并在局部出现彗星状荧光聚集,荧光分布最密集区域有些细胞开始变圆脱落(图4-B);转染10 d,绿色荧光铺满整个视野,大量细胞病变脱落,出现明显的空斑(图4-C),待约50%细胞脱落,收集细胞与培养液,得到第1代病毒悬液。重复“侵染-冻融-收集”扩繁得到高滴度病毒,用高滴度病毒侵染293A细胞(图4-D)约30 h后有50%细胞病变变圆脱壁,收集病毒并测定病毒滴度。绿色荧光蛋白(GEP)标记法的测定结果显示,病毒滴度为1×108PFU/mL。
3 讨 论
腺病毒载体是目前用于基因转移最广泛的载体之一,重组腺病毒感染谱广、安全性高、容量大、体外可操作性好。目前常用的腺病毒载体系统主要包括ViraPowerTMAdenoviral Expression System及AdEasyTMAdenoviral Vector System等[4-5]。本试验采用的是ViraPowerTM腺病毒系统,其特点是重组系统由2种质粒组成,一种是包含有全部(或右侧大部分)腺病毒基因组DNA的大质粒(骨架质粒);另一种是小的穿梭质粒,其带有目的基因表达盒以及在表达盒两侧的与大质粒上目的基因拟插入部位同源的序列[4-5]。
pAdEasy-1系统是首先将目的基因插入到穿梭载体(pAdTrack-CMV)中,然后用PmeⅠ酶切使之线性化,线性化产物转染到含有骨架载体pAdEasy-1的大肠杆菌BJ5183感受态细胞中。穿梭质粒与骨架载体的重组方式有2种,也正因为重组方式的不同,重组腺病毒质粒PacⅠ酶切鉴定也显示2种不同的结果,因此其条带出现在4.5 kb处或是3.0 kb处都可认为其重组成功[6]。本试验构建过程中,检测到的重组方式只有1种,酶切结果只显示一种4.5 kb 的短片段(图3),没有出现3.0 kb的短片段,也说明前一种重组方式更容易实现重组。在细菌中实现腺病毒载体的重组,然后提取重组腺病毒载体,用PacⅠ酶切线性化,回收质粒大片段转染293A细胞,包装扩繁得到高滴度病毒[7]。

图4 重组腺病毒质粒pAD-ADIG的包装与扩繁A.重组腺病毒载体转染30 h 的293A细胞,整个视野下仅有数个绿色荧光点(40×);B.转染7 d的293A细胞,绿色荧光细胞(GEP)明显增多,局部出现彗星状聚集(40×);C.转染10 d的293A细胞,绿色荧光细胞铺满整个视野,大量细胞病变变圆脱壁(40×);D.高滴度腺病毒侵染30 h后的 293A细胞 (100×)Fig.4 Packaging and amplification of adenovirus A.Fluorescence microscopic image of 293A cells transfected after 30 h (40×);B.After 7 d,GEP positive 293A cells increased and showed a grapes-like gathering (40×);C.After 10 d,GEP positive 293A cells covered the entire field of vision, and most cells rounded off the wall (40×);D.30 h after infection of high titers adenovirus (100×)
由于ADIG(SMAF1)基因只能在成熟脂肪细胞中表达,这种组织特异性激起了国内外众多学者的研究兴趣。韩威等[8]研究发现,SMAF1基因在3T3-L1细胞中的异位表达能有效抑制3T3-L1细胞的增殖,而对细胞分化和凋亡未见有明显的抑制作用。同时大量研究表明,脂肪细胞分化受多基因调控[9-20],SMAF1基因在脂肪细胞中的mRNA水平与脂肪细胞成熟分化程度呈正相关。用TNF处理过的成熟脂肪细胞去分化后,引起了SMAF1表达的急剧下降,12 h后下降幅度更明显。这种状况是在PPARγ的表达水平下降后出现的,说明TNF介导的SMAF1的下降可能是通过PPARγ的作用实现的[21]。PPARγ在前体脂肪细胞中的异位表达能对脂肪细胞分化有明显的促进作用[22]。日本学者研究表明,饲喂高脂肪日粮的小鼠,SMAF1的mRNA水平明显提高[23],这与提高PPARγ的表达后取得的效果相同,但是SMAF1基因也被发现能够被视黄酸下调,同时发现该基因只在细胞膜上表达[23],胞质中没有表达。另外,在日本和牛上所做的ADIG基因几种不同脂肪组织的表达谱分析表明,含有脂肪多的组织ADIG基因表达量更高[24]。
本研究应用腺病毒载体与目的基因进行体外连接,成功构建了秦川牛ADIG基因的重组腺病毒过表达载体,并在293A细胞中包装后进一步扩繁得到高滴度腺病毒,为下一步继续研究该基因在脂肪细胞分化过程中的功能提供了理想的生物载体表达系统。
[1] Kim J Y,Tillison K,Smas C M.Cloning,expression,and differentiation-dependent regulation ofSMAF1 in adipogenesis [J].Biochem Biophys Res Commun,2005,326(1):36-44.
[2] Lybarger L,Dempsey D,Franek K J,et al.Rapid generation and flow cytometric analysis of stable GEP-expressing cells [J].Cytometry,1996,25(3):211-220.
[3] Hett D C,Booth J L,Dandapani V,et al.A flow cytometric protocol for tittering recombinant adenoviral vectors containing the green fluorescent protein [J].Mol Biotechnol,2000,14(3):197-203.
[4] He T C,Zhou S,Dacosta L T,et al.A simplified system for generating recombinant adenoviruses [J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(5):2509-2514.
[5] Lodde B M,Delporte C,Goldsmith C M,et al.A recombinant adenoviral vector encoding functional vasoactive intestinal peptide [J].Biochem Bioph Res Co,2004,319:189-192.
[6] Negrete A,Ling T C,Lyddiatt A.Production of adenoviral vectors and its recovery [J].Process Biochemistry,2007,42:1107-1113.
[7] Luo J,Deng Z L,Luo X,et al.A protocol forrapid generation of recombinant adenoviruses using the AdEasy system [J].Nat Protoc,2007,2(5):1236-1247.
[8] 韩 威,段佳慧,吴民泸,等.SMAF1基因的异位过表达对脂肪细胞3T3-L1增殖和凋亡的影响 [J].成都医学院学报,2009,4(3):198-201.
Han W,Duan J H,Wu M L,et al.effect of ectopic expression ofSMAF1 on perliferation and apoptosis of preadipocyte 3T3-L1 [J].Journal of Chendu Medical College,2009,4(3):198-201.(in Chinese)
[9] 朱江江,罗 军,王紫骞,等.西农萨能羊乙酰/丙二酸单酰基转移基因重组腺病毒载体的构建 [J].畜牧兽医学报,2012,43(3):489-495.
Zhu J J,Luo J,Wang Z Q,et al.Construction of the recombinant adenovirus of malonyl transferase of Xinong Sanen Goat [J].Acta Veterinaria et Zootechnica Sinica,2012,43(3):489-495.(in Chinese)
[10] Ho I C,Kim J H,Rooney J W,et al.A potential role for the nuclear factor of activated T cells family of transcriptional regulatory proteins in adipogenesis [J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(26):15537-15541.
[11] Yang X Y,Wang L H,Chen T,et al.PPARgamma co-association with transcription factor NFAT [J].J Biol Chem,2000,275(7):4541-4544.
[12] Musaro A,Mccullagh K J,Naya F J,et al.IGF-1 induces skeletal myocyte hypertrophy through calcinerrin in association with GATA-2 and NF-ATc1 [J].Nature,1999,400(6744):581-585.
[13] Reusch J E,Colton L A,Klemm D J.CREB activation induces adipogenesis in 3T3-L1 cells [J].Mol Cell Biol,2000,20(3):1008-1020.
[14] Morrison R F,Farmer S R.Role of PPARgamma in regulating a cascade expression of cyclin-dependent kinase inhibitors,p18(INK4c) and p21(Waf1/Cip1), during adipogenesis [J].J Biol Chem,1999,274(24):17088-17098.
[15] Chen P L,Riley D J,Chen Y,et al.Retinoblastoma protein positively regulates terminal adipocyte differentiation through direct interaction with CEBPs [J].Genes Dev,1996,10(21):2794-2804.
[16] Tong Q,Dalgin G,Xu H,et al.Function of GATA transcription factors in preadipocyte-adipocyte tuansition [J].Science,2000,290(5489):134-138.
[17] Moldes M,Lasnier F,Feve B,et al.Id3 prevents differentiation of preadipose cells [J].Mol Cell Biol,1997,17(4):1796-1804.
[18] Ross S E,Hemati N,Longo K A,et al.Inhibition of adipogenesis by Wnt signaling [J].Science,2000,289(5481):950-953.
[19] Smas C M,Sul H S.Pref-1,a protein containing EGF-like repeats,inhibits adipocyte differentiation [J].Cell,1993,73(4):725-734.
[20] Steppan C M,Bailey S T,Bhat S,et al.The hormone resestin links obesity to diabetes [J].Nature,2001,409(6818):307-312.
[21] Mueller E,Drori S,Aiyer A,et al.Genetic analysis of adipogenesis through peroxisome proliferators activated receptor gamma isoforms [J].Journal of Biological Chemistry,2002,277:41925-41930.
[22] Rosen E D,Sarraf P,Spiegelman B M,et al.PPAR Gamma is required for the differentiation of adipocyte tissueinvivoandinvitro[J].Mol Cell,1999,4(4):611-617.
[23] Hong Y H,Miyahara H,Hishikawa D,et al.Molecular cloning and expression analysis of cDNA encoding bovine adipogenin [J].Animal Science Journal,2006,77:613-619.
[24] Hong Y H,Hishikawa D,Miyahara H,et al.Up-regulation of adipogenin,an adipocyte plasma transmembrane protein,during adipogenesis [J].Mol Cell Biochem,2005,276(1/2):133-141.
Construction of recombinant adenovirus vector and viral packaging ofADIGgene in Qinchuan cattle
ZHANG Qiong1,JIANG Bi-jie1,CHENG Gong1,LIU Yang1,ZAN Lin-sen1,2
(1CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2NationalBeefCattleImprovementCenterinChina,Yangling,Shaanxi712100,China)
【Objective】 The aim of this project was to construct recombinant adenovirus vector ofADIGgene,then package and amplify the corresponding recombinant adenovirus,which would improve further study on its molecular mechanism and related signaling pathway on adipocyte differentiation.【Method】 TheADIGgene was obtained by reverse transcription-polymerase chain reaction (RT-PCR) and polymerase chain reaction (PCR),and the template was mixed cDNA from different tissues of Qinchuan cattle.Then PCR product was inserted to pMD®19-T Simple vector and confirmed by sequencing.The plasmids were prepared and then digested withBglⅡ andSalⅠ before gel extraction.The product was then inserted into the adenoviral shuttle plasmid pAdTrack/CMV to obtain pAdTrack/CMV-ADIG.The linearized plasmid pAdTrack/CMV-ADIG was co-transformed into competent cells BJ5183 containing adenoviral backbone plasmid pAdEasy-1 to obtain recombinant adenovirus vector pAD-ADIG.The recombinant adenovirus vector pAD-ADIG was verified by enzyme cleavage withPacⅠ.The confirmed recombinant adenovirus plasmid pAD-ADIG was transformed intoE.coliTop10 competent cells for further amplification.Plasmid of pAD-ADIG was then prepared and digested withPacⅠ to be totally linearized before being transfected into 293A cell line for packaging and amplification of the recombinant adenovirus. 【Result】 PCR product with length of 399 bp was obtained and the shuttle vector pAdTrack/CMV-ADIG together with the recombinant adenovirus vector pAD-ADIG were obtained and verified by sequencing.ADIGrecombinant adenovirus was packaged successfully and high concentration (1×108PFU/mL)ofADIGadenovirus was obtained.【Conclusion】 A recombinant adenovirus vector containingADIGgene was successfully constructed to package and amplify the recombinant adenovirus.
ADIG;adenovirus vector;homologous recombination;Qinchuan cattle
2014-01-17
国家转基因重大专项(2013ZX08007-002);“十二五”国家“863”计划项目(2013AA102505);国家现代农业(肉牛牦牛)产业体系专项(CARS-38);国家自然科学基金项目(31272411);陕西省科技统筹创新工程计划项目(2014KTZB02-02)
张 琼(1990-),女,陕西延长人,硕士,主要从事动物健康养殖研究。E-mail:zhangqiong232@163.com
昝林森(1963-),男,陕西扶风人,教授,博士,博士生导师,主要从事动物遗传育种与繁殖研究。 E-mail:zanlinsen@163.com
时间:2015-06-30 13:47
10.13207/j.cnki.jnwafu.2015.08.025
Q78;S823.8+1
A
1671-9387(2015)08-0033-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150630.1347.025.html
