葡萄原生质体分离及瞬时转化体系的建立
2015-06-28舒小娟温腾建邢佳毅胡建芳
舒小娟,温腾建,邢佳毅,卢 龙,胡建芳
(中国农业大学农学与生物技术学院,北京100193)
葡萄原生质体分离及瞬时转化体系的建立
舒小娟,温腾建,邢佳毅,卢 龙,胡建芳*
(中国农业大学农学与生物技术学院,北京100193)
为了建立葡萄原生质体进行遗传转化的技术,该研究以葡萄品种‘黑香蕉’的叶片和愈伤组织为材料,分析纤维素酶和离析酶的浓度与配比、渗透压和酶解时间等主要因素对葡萄原生质体分离的影响,探讨建立稳定、高效的葡萄原生质体分离与瞬时转化体系,为鉴定目标基因的功能奠定基础。结果表明:(1)葡萄叶片原生质体的分离以3.0%纤维素酶和0.75%离析酶的酶组合,在0.6mol/L甘露醇溶液中,酶解14h为宜,每克游离产量为4.09× 106个原生质体,活力为83.12%。(2)葡萄愈伤组织原生质体的分离以2.0%纤维素酶和0.5%离析酶的酶组合,在0.5mol/L甘露醇溶液中,酶解14h为宜,每克游离产量为6.05×106个原生质体,活力为84.13%。(3)利用该方法得到的葡萄原生质体为受体,采用40%PEG-4000介导转化质粒载体pEZS-NL,目标基因瞬时表达产物检测表明,GFP蛋白表达稳定、清晰。该研究建立的葡萄原生质体制备和转化体系,可以用较少量的质粒DNA获得外源基因在原生质体内的表达,为葡萄功能基因的研究提供技术支持。
葡萄;原生质体;叶片;愈伤组织;遗传转化;瞬时表达
植物原生质体是能够通过质壁分离与细胞壁分开的具有生理活性和全能性的细胞系统。其瞬时表达实验可实现子基因在植物中的快速和高通量表达分析[1-2],因而被广泛用于基因功能验证。拟南芥(Arabidopsis thaliana)[3]、玉米(Zea mays L.)叶片[4]、烟草(Nicotiana tobacumL.)愈伤组织[5],烟草表皮细胞[6],洋葱(Allium cepaL.)表皮细胞[7]等原生质体被广泛用于基因瞬时表达、蛋白质的亚细胞定位、蛋白质互作和蛋白质活性等研究。并已初步建立多种基因瞬时表达系统,如PEG介导的原生质体转染[8],基因枪轰击[9]和农杆菌介导的瞬时转化[10]。但是,现阶段原生质体的遗传转化研究主要集中在模式植物,在果树上的相关研究较少。
葡萄在中国栽培历史悠久,营养丰富,是果蔬栽培中经济效益最高的品种之一。但是葡萄生长周期长、遗传背景较为复杂、基因数量多且多为杂合状态[11],所以通过传统育种方法和转基因方法进行品种改良均有一定困难,品种改良工作受到一定制约,葡萄分子机制研究也由于转基因困难这一技术壁垒而寸步难行。而原生质体分离和遗传转化则为克服这一障碍开辟了一条可能的新途径[12]。作为单细胞系统,原生质体是研究植物细胞超微结构、生理生化过程和遗传学的良好的实验模型,也是遗传转化的理想受体。目前,葡萄原生质体研究进展缓慢,大多处在分离阶段[13-16],如吕长平等[13]利用刺葡萄叶片、根尖和愈伤组织分离获得原生质体。俞超等[14]也利用‘鄞红’葡萄茎段愈伤组织进行原生质体的分离。Natacha等[15]从葡萄果肉中分离得到了完整而脆弱的原生质体。袁彬等[16]以毛葡萄愈伤组织、悬浮培养细胞、无菌苗幼叶为材料,研究了毛葡萄原生质体的分离纯化方法及影响因素。但是有关原生质体再生和目标基因瞬时表达体系的研究相对较少,这可能与葡萄遗传背景不清,遗传转化的假阳性较高有关[17]。因此开展葡萄原生质体转化体系的研究迫在眉睫。为此,本研究针对酶的浓度与配比、渗透压、酶解时间等对葡萄原生质体分离影响较大的因素进行了试验研究,旨在获得高效和高质量的原生质体,并进行了遗传转化实验,为葡萄相关分子机制的研究、体细胞融合育种、植株再生以及品种改良奠定基础。
1 材料和方法
1.1 材 料
本试验选用葡萄品种‘黑香蕉’(Vitis vinifera L.cv.‘Heixiangjiao’)的无菌苗叶片和无菌苗叶片诱导的胚性愈伤组织为材料,进行原生质体的分离。从温泉苗圃采集葡萄新梢,进行初代培养和继代培养。选较幼嫩的叶片作为分离原生质体的酶解材料;剪取组培苗叶片,切成5mm×5mm的方形,接种到愈伤组织诱导培养基上,选取质密、淡黄色状的胚性愈伤组织作为分离原生质体的酶解材料。
1.2 方 法
1.2.1 原生质体的分离和纯化 从田间取葡萄一年生枝条,经过外植体消毒,放入初代培养基(MS+1.0mg/L 6-BA+0.5mg/L NAA)诱导生芽,随后进行生根培养(1/2MS+0.2mg/L IBA+1mg/L KT+1g/L活性炭),获得无菌苗。剪取30~40d叶龄的组培苗叶片,切成5mm×5mm的方形,接种到愈伤组织诱导培养基(MS+2.0mg/L TDZ+1.0mg/L 2,4-D+0.2mg/L IBA)上进行培养,培养温度为(25±2)℃,光周期为16h/8h,光照强度2 000lx,进行20d的暗培养后转入光下培养,经继代后获得结构致密、淡黄色的胚性愈伤组织。
选取1g左右叶龄20~30d的幼嫩叶片作为分离原生质体的酶解材料,切成1~2mm宽的细丝;另选取1g左右愈伤组织作为分离材料,切碎。分别置于盛有10mL cellulose onozuka R-10(纤维素酶,Yakult)和macerozyme R-10(离析酶,Yakult)混合酶液的培养皿中,静置在28℃黑暗的环境酶解。酶解后的材料用200目孔径的尼龙网筛过滤,除去没有酶解完全的组织和杂质(本试验采用离心法去杂质,滤液在(600~800)r/min转速下离心10 min,去掉上清收集原生质体)。用含有甘露醇的原生质体清洗液(CPW液:Cell Protoplast Wash Medium,27.2mg/L KH2PO4、101.0mg/L KNO3、1 480.0mg/L CaCl2·2H2O、246.0mg/L MgSO4· 7H2O、0.16mg/L KI、0.025mg/L CuSO4· 5H2O)进行重悬清洗,再离心洗去杂质,重复操作2次。最后用原生质体培养液W5培养基(4mmol/L MES、154mmol/L NaCl、125mmol/L CaCl2、5mmol/L KCl,pH 5.8)洗涤2次,获取纯化原生质体[18]。
试验所用的酶解液的处理设置见表1。首先在渗透压稳定剂甘露醇浓度为0.6mol/L和酶解时间为14h条件下,对酶解液组合进行筛选,测定原生质体产量和活力,确定最佳的酶解液组合。然后,根据确定的最佳酶解液组合,在酶解时间14h条件下,渗透压稳定剂甘露醇的浓度设置4个处理(0.4、0.5、0.6和0.7mol/L),测定原生质体产量和活力,确定最佳的渗透压稳定剂浓度。最后,根据筛选得到的最佳酶解液组合和最佳渗透压稳定剂甘露醇的浓度,酶解时间设置4个处理(12、14、16和18h),测定原生质体产量和活力,从中确定最佳酶解时间。各实验重复3次。
1.2.2 原生质体产量与活力的测定 利用血球计数板测定原生质体产量:将纯化后的原生质体重悬至一定体积,吸取少量滴入血球计数板中,在显微镜下观察形态并计数,重复3次。同时利用伊文思蓝染色法测定原生质体活力(Direct Blue 53):吸取1滴原生质体悬浮液置于载玻片上,用0.25%伊文思蓝进行染色,静置5min,在显微镜下观察,检测原生质体活性[19]。随机选取3个视野统计有活力原生质体的百分比。按如下公式计算[20]:
每克材料中原生质体总产量=25个大方格中原生质体总数×104×悬浮液总体积÷材料质量
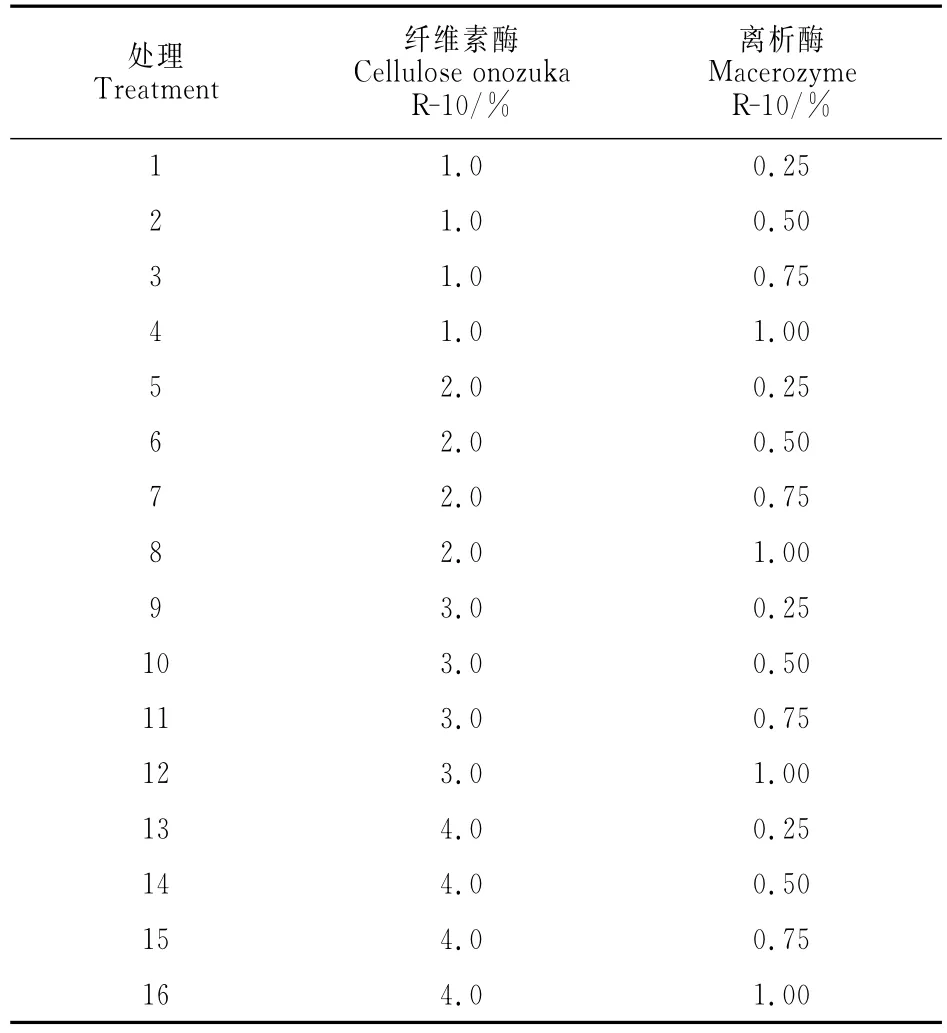
表1 酶解液组合Table 1 Composition of enzyme solution for protoplast isolation
原生质体活力=(视野内未被染色的原生质体数÷视野内原生质体总数)×100%
每克材料中有活力的原生质体产量=原生质体总产量×原生质体活力
由于原生质体分离一般是为了下一步进行遗传转化或者原生质体融合,需要的都是具有活力的原生质体,所以,本试验统计具有活力的原生质体数,并以此作为评价指标。
1.2.3 原生质体的转化试验 pEZS-NL质粒载体是含有绿色荧光蛋白基因(GFP)的植物表达载体(http://deepgreen.stanford.edu),表达框由花椰菜花叶病毒(CaMV)35S启动子、绿色荧光蛋白(GFP)基因构成,可以在真核细胞中高水平表达绿色荧光蛋白GFP。用中科瑞泰(北京)普通质粒小提试剂盒提取质粒,-20℃保存备用。
将收集的葡萄叶片和愈伤组织原生质体重分别悬浮于MMG溶液中(0.5mol/L甘露醇、15mmol/L MgCl2、4mmol/L MES,pH 5.8),浓度稀释至每毫升溶液内含2.0×105个。取15~20μg质粒DNA加入2mL离心管,与200μL原生质体MMG悬浊液混合,轻弹管底以混匀,室温放置8~10 min。加入220μL 40%PEG-Ca2+(40%PEG-4000、0.2mol/L甘露醇、100mmol/L CaCl2),轻弹管底以混匀,室温放置15min。随后加入880μL W5溶液(154mmol/L NaCl、125mmol/L CaCl2、5 mmol/L KCl、4mmol/L MES,pH 5.8)重新悬浮,轻弹管底以混匀,终止转化。然后,100g离心2 min,弃上清液,收集转化后的原生质体。加入WI(0.5mol/L甘露醇、4mmol/L MES、20mmol/L KCl,pH 5.8)1mL重悬浮,并转移至经BSA预冲洗过的培养皿中,室温、暗培养过夜,用荧光显微镜(NIKON,Eclipse 90I,Japan)观察记录转化效果和转化率。
1.2.4 数据分析 应用Excel软件进行单因素方差分析;用SPSS 16.0统计软件对结果多重比较。
2 结果与分析
2.1 酶解液组合对原生质体产量和活力的影响
叶片中分离原生质体产量和活力的酶解浓度处理结果(图1)显示,处理11(3.0%纤维素酶+0.75%离析酶)的每克叶片中分离的原生质体产量3.09×106个,具有活力的原生质体产量2.45×106个,活力可达79.29%,是所有叶片酶解处理中最高的,与其他处理的具有活力的原生质体产量多呈显著性差异(P<0.05,下同)。
愈伤组织分离原生质体产量和活力的酶解组合结果(图2)显示,处理6(2.0%纤维素酶+0.50%离析酶)的每克愈伤组织中分离的原生质体产量5.86 ×106个,具有活力的原生质体产量4.73×106个,活力80.71%,是愈伤组织的所有酶解处理中最高的,与其他处理的具有活力的原生质体产量多呈显著性差异(图2)。
根据以上不同酶解液处理效果,最终得出适宜‘黑香蕉’葡萄叶片原生质体分离的酶组合是3.0%纤维素酶+0.75%离析酶;适宜愈伤组织原生质体分离的酶组合是2.0%纤维素酶+0.50%离析酶。
2.2 不同渗透压对葡萄叶片和愈伤组织分离的原生质体产量及活力的影响
采用上述所得到的最佳酶解液组合(即酶液组合11处理葡萄叶片和用酶液组合6处理葡萄愈伤组织),酶解14h,分析不同浓度甘露醇(0.4、0.5、0.6、0.7mol/L)对叶片和愈伤组织中分离的原生质体产量和活力的影响。结果(图3)显示,原生质体只有在渗透压最适宜的时候,产量和活力才较高,否则无论渗透压高低,产量和活力都会下降。其中,当甘露醇浓度为0.6mol/L时,每克叶片原生质体产量达到最高(3.09×106个),具有活力的原生质体产量2.45×106个,活力79.29%,与其他处理具有活力的原生质体产量多有显著差异(图3,A);当甘露醇浓度为0.5mol/L时,每克愈伤组织产量和活力达到最佳,产量为5.94×106个,具有活力的原生质体产量4.82×106个,活力81.14%,与其他处理具有活力的原生质体产量有显著差异(图3,B)。

图1 不同酶组合对‘黑香蕉’葡萄叶片原生质体产量和活力的影响不同小写字母表示各处理间0.05水平差异显著性;下同Fig.1 Effects of enzyme composition on yield and viability of‘Heixiangjiao’leaf protoplast Bars with different letters are significantly different at the 0.05level under different treatments;The same as below
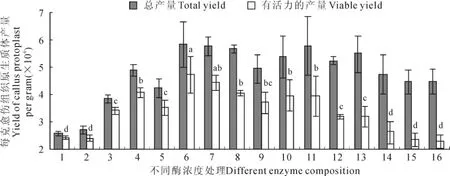
图2 不同酶组合对‘黑香蕉’葡萄愈伤组织原生质体产量和活力的影响Fig.2 Effects of enzyme composition on yield and viability of‘Heixiangjiao’callus protoplast
2.3 不同酶解时间对葡萄叶片和愈伤组织原生质体产量及活力的影响
采用上述所得到的最佳酶解液组合和最佳甘露醇浓度,进行连续取样观察,分析不同酶解时间对葡萄叶片和愈伤组织中原生质体分离效果的影响。结果(图4)显示,叶片和愈伤组织的最佳酶解时间均为14h。此时每克叶片原生质体产量4.09×106个,具有活力的原生质体产量3.40×106个,活力83.12%,是叶片所有处理中最高的,与其他处理具有活力的原生质体产量均有显著差异(图4,A);每克愈伤组织原生质体产量6.05×106个,具有活力的原生质体产量5.09×106个,活力84.13%,是愈伤组织所有处理中最高的,与其他处理均有显著差异(图4,B)。原生质体在酶解时间最适宜的时候其产量和活力才能达到最高。随着酶解时间的增长,原生质体活力和产量先增后降,因此,有效的原生质体产量会在一定时间段内达到最高;若酶解时间过短,原生质体之间会出现较多的粘连片段和较大细胞团,而若酶解时间过长,原生质体的活力会大大降低。因此,为确保得到活力较高的原生质体,葡萄叶片和愈伤组织的酶解时间尽量控制在14h左右。2.4 葡萄叶片和愈伤组织原生质体的转化
由于叶肉细胞中含有叶绿体,其自发荧光会干扰GFP的观测效果,所以日常实验中常用愈伤组织或黄化子叶进行原生质体的转化实验。由于葡萄愈伤组织无论是原生质体产量还是活力都大于叶片,并且没有叶绿体的自发荧光信号干扰,因此利用葡萄愈伤组织分离的原生质体是一种理想材料。而本试验利用葡萄叶片和愈伤组织分离的原生质体进行了遗传转化体系的比较和研究。
将制备好的葡萄叶片和愈伤组织的原生质体用pEZS-NL载体转化,在24℃条件下黑暗培养12~16h,用荧光显微镜观察。结果(图5)显示:未进行质粒转化的叶片原生质体只有红色的叶绿体自发荧光(图5,A)。利用叶片原生质体进行质粒转化后,由于自身具有叶绿体应发红光,但与绿色荧光信号(GFP)叠加后则呈现黄色荧光(图5,B)。利用愈伤组织分离的原生质体进行质粒转化后,由于体内没有叶绿体自发荧光,因此清晰地观察到有稳定表达的绿色荧光信号,与明场叠加发现绿色荧光信号与原生质体位置吻合(图5,C)。说明带有GFP的质粒DNA可高通量进入葡萄叶片和愈伤组织原生质体中并稳定表达。
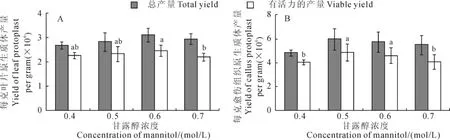
图3 不同浓度甘露醇对‘黑香蕉’葡萄原生质体产量和活力的影响A.叶片;B.愈伤组织;图4同Fig.3 Effects of mannitol concentration in enzyme solution on yield and viability of‘Heixiangjiao’protoplast A.Leaf;B.Callus;The same as Fig.4

图4 不同酶解时间对‘黑香蕉’葡萄原生质体产量和活力的影响Fig.4 Effects of hours of duration dissolve on yield and viability on‘Heixiangjiao’protoplast
3 讨 论
在其他物种原生质体的分离过程中,研究人员用纤维素酶、离析酶、果胶酶、半纤维素酶、崩溃酶等多种酶类做过酶解效率的探索,其中纤维素酶、离析酶的使用较为广泛[8]。孙鹤等[21]用纤维素酶和离析酶从玉米、小麦、水稻中游离出较高质量的原生质体;廖嘉明等[22]在拟南芥中使用这2种酶,每克叶肉组织中游离出原生质体2.91×106个,活力为84.03%。景艳春等[23]在每克新疆杨叶肉中游离出原生质体达1.57×106个,活力为79.41%。李玉珠等[24]以4个适宜西北内陆黄土高原地区栽培的苜蓿愈伤组织为材料,探索了各影响因素对原生质体分离和培养的影响,每克组织游离出的原生质体1×106~2×106个,活力最高可达80%~90%。在本研究中发现,用浓度为2%纤维素酶和0.5%离析酶消化葡萄愈伤组织;用浓度为3%纤维素酶和0.75%离析酶消化葡萄叶片已经可以分离出足够量的原生质体,效率较高。
此外,其他研究人员在试验中发现,酶解时间、溶液渗透压、分离的离心速度和离心时间对原生质体分离的产量和活力也有较大影响[2],但是不同物种间最佳酶解时间和溶液渗透压差别较大,最适的离心速度和离心时间几乎没有差别。常用的渗透压稳定剂主要有甘露醇、蔗糖、山梨醇等,其中甘露醇在原生质体分离中的应用最为广泛[4,8,15],本研究使用的渗透压稳定剂就是甘露醇。发现葡萄叶片原生质体分离的最适酶解时间为14h,最适甘露醇浓度为0.6mol·L-1,与袁彬等[16]取得的结果相似。同时发现愈伤组织原生质体的渗透压小于叶片原生质体,可以推断在葡萄中叶片胞质较浓,愈伤组织胞内的渗透压小于叶片。
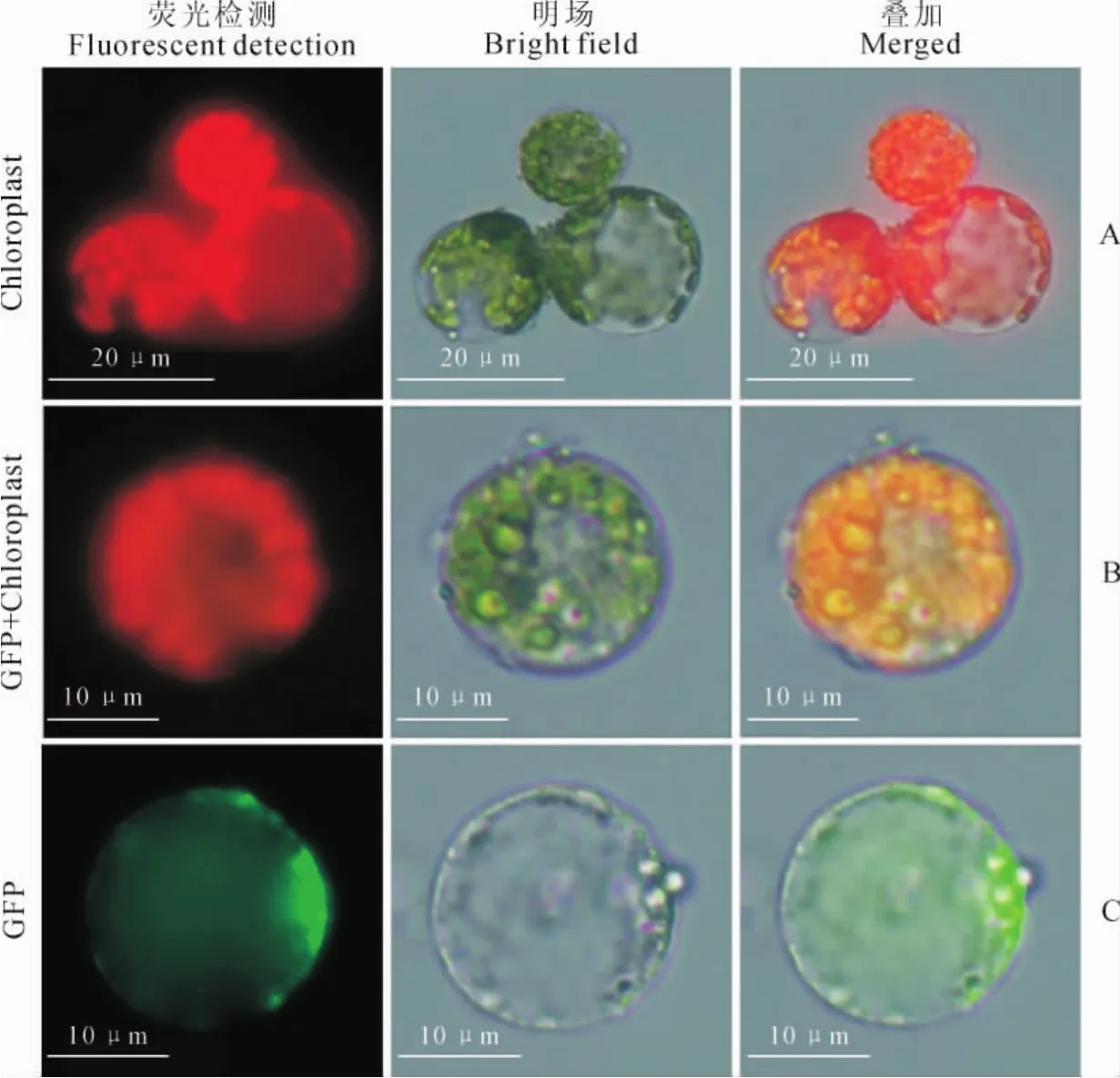
图5 pEZS-NL-GFP载体转化葡萄原生质体A.未经转化的叶片原生质体;B.转入pEZS-NL-GFP的叶片原生质体;C.转入pEZS-NL-GFP的愈伤组织原生质体Fig.5 ‘Heixiangjiao’protoplast transformed by using pEZS-NL-GFP vector A.Leaf protoplast without transformation;B.Leaf protoplast with pEZS-NL-GFP;C.Callus protoplast with pEZS-NL-GFP
对不同物种的研究表明,植物不同组织最佳体系分离得到的原生质体产量一般为7×105~2×107个,活力一般为70%~90%。本研究中,应用最佳体系,每克叶片游离得到的原生质体产量为4.09× 106个,活力为83.12%;每克愈伤组织原生质体产量为6.05×106个,活力为84.13%。使用愈伤组织来制备原生质体无论是产量还是活力都要优于使用叶片,所以如果不是探究叶绿体相关的生理生化和分子特性,推荐使用葡萄愈伤组织进行原生质体的分离。
目前虽然已经有关于葡萄的原生质体分离体系的报道,但是关于葡萄原生质体遗传转化的试验还鲜有报道。采用GFP(绿色荧光蛋白)、CFP(青色荧光蛋白)、YFP(黄色荧光蛋白)等荧光标记、通过荧光显微镜或者激光共聚焦显微镜检测,可以简单方便地确定目标蛋白在细胞中的定位。通过本试验可观察到,葡萄原生质体中的叶绿体会产生自发荧光,影响绿色荧光蛋白的观测,而暗培养的愈伤组织没有成熟的叶绿体,所以愈伤组织分离的原生质体可以作为瞬时转化的理想材料。本研究利用葡萄叶片和愈伤组织原生质体原生质体,采用PEG介导法顺利将pEZS-NL-GFP载体导入原生质体并成功表达,为相关分子机制研究奠定基础。此外,分离出高质量的叶片原生质体,也可为分子育种和杂交育种提供材料依据。
[1] DE SUTTER V,VANDERHAEGHEN R,TILLEMAN S,et al.Exploration of jasmonate signalling via automated and standardized transient expression assays in tobacco cells[J].Plant Journal,2005,44(6):1 065-1 076.
[2] MARION J,BACH L,BELLEC Y,et al.Systematic analysis of protein subcellular localization and interaction using high-throughput transient transformation of Arabidopsis seedlings[J].Plant Journal,2008,56(1):169-179.
[3] ZHAO L J(赵兰杰),ZHU SH H(朱守鸿),ZHANG X Y(张新宇),et al.Subcelluar localization and ligase activity of AtPUB18and its expression pattern in Arabidopsis thaliana[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2014,34(5):873-877(in Chinese).
[4] SHEEN J.Signal transduction in maize and Arabidopsis mesophyll protoplasts[J].Plant Physiol.,2001,127(4):1 466-1 475.
[5] FISCHER R,HAIN R.Tobacco protoplast transformation and use for functional analysis of newly isolated genes and gene constructs[J].Methods in Cell Biology,1995,50(1):401-410.
[6] ZANG A,XU X,NEILL S,et al.Overexpression of OsRAN2in rice and Arabidopsis renders transgenic plants hypersensitive to salinity and osmotic stress[J].Journal of Experimental Botany,2010,61(3):777-789.
[7] KITAJIMA A,ASATSUMA S,OKADA H,et al.The riceα-amylase glycoprotein is targeted from the golgi apparatus through the secretory pathway to the plastids[J].Plant Cell,2009,21(9):2 844-2 858.
[8] YOO SD,CHO YH,SHEEN J.Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis[J].Nature Protocols,2007,2(7):1 565-1 572.
[9] UEKI S,LACROIX B,KRICHEVSKY A,et al.Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment[J].Nature Protocols,2009,4(1):71-77.
[10] MANAVELLA PA,CHAN RL.Transient transformation of sunflower leaf discs via an Agrobacterium-mediated method:applications for gene expression and silencing studies[J].Nature Protocols,2009,4(11):1 699-1 707.
[11] LI H E(李慧娥),GUO Q Q(郭其强).Progress on molecular breeding for grape disease resistance[J].Acta Horticulturae Sinica(园艺学报),2012,39(1):182-190(in Chinese).
[12] LIAO F(廖 芬),TANG W ZH(唐文忠),HUANG M K(黄茂康),et al.Isolation of protoplasts from pollens of wine grape variety Guipu 1[J].Journal of Southern Agriculture(南方农业学报),2011,42(10):1 181-1 184(in Chinese).
[13] LÜCH P(吕长平),SHI X H(石雪晖),XU Y(徐 艳),et al.Protoplast isolation of Vitis davidii Foëx[J].Journal of Hunan Agricultural University(湖南农业大学学报),2005,31(4):393-395(in Chinese).
[14] YU CH(俞 超),YANG X(杨 潇),WANG ZH H(王忠华),et al.Research on preparation method of protoplasts from callus of grape[J].Journal of Fruit Science(果树学报),2013,30(3):433-436(in Chinese).
[15] NATACHA F,RUI S,CELINE V,et al.Purification and functional characterization of protoplasts and intact vacuoles from grape cells[J].BMC Research Notes,2010,3:19.
[16] YUAN B(袁 彬),PAN X J(潘学军).Protoplast isolation and purification of Vitis quinquangularis Rehd[J].Journal of Southwest U-niversity(西南大学学报),2010,32(12):97-101(in Chinese).
[17] KALLIOPI A.Grapevine Molecular Physiology and Biotechnology[M].New York:Springer,2009:458-490.
[18] YANG ZH,JIANBIN S,SHAN D,et al.A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes[J].Plant Methods,2011,30(3):30.
[19] LANINE E,DAVID A.Somatic embryogenesis in immature embryos and protoplast of Pinus caribaea[J].Plant Science,1990,69(90):215-224.
[20] 朱志清.植物细胞工程[M].北京:化学工业出版社,2003:25-153.
[21] SUN H(孙 鹤),LANG ZH H(郎志宏),ZHU L(朱 莉),et al.Optimized condition for protoplast isolation from maize,wheat and rice leaves[J].Chinese Journal of Biotechnology(生物工程学报),2013,29(2):224-234(in Chinese).
[22] LIAO J M(廖嘉明),WANG B CH(王伯初),WANG Y CH(王益川),et al.Optimization conditions of Arabidopsis mesophyll protoplast isolation[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2010,30(6):1 271-1 276(in Chinese).
[23] JING Y CH(景艳春),KANG X Y(康向阳),WANG J(王 君),et al.Isolation and purification of mesophyll protoplasts of Populus alba L.var.pyramidalis[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2007,27(3):509-514(in Chinese).
[24] LI Y ZH(李玉珠),SHI SH L(师尚礼).Selection for protoplast isolation and culture condition of Alfalfa[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2014,34(1):184-192(in Chinese).
(编辑:宋亚珍)
Isolation of Protoplast and Establishment of Transient Expression System in Grapevine(Vitis vinifera L.)
SHU Xiaojuan,WEN Tengjian,XING Jiayi,LU Long,HU Jianfang*
(College of Agriculture and Biotechnology,China Agricultural University,Beijing 100193,China)
In order to establish an efficient transient expression system based on grapevine protoplasts,we used the mesophyll and callus of grape‘Heixiangjiao’to analyze the key factors related to isolating effectively protoplasts,such as cellulose and macerozyme enzyme composition,concentration of mannitol in enzyme solution,duration of enzyme dissolve,and so on.The protoplast was used as a vehicle to explore the establishment of a stable,efficient grape protoplast isolation and transient transformation system,and lay the foundation for building a transient expression system.The results showed that:(1)the optimal enzyme solution for leaf protoplast isolation was 3.0%cellulase onozuka R-10+0.75%macerozyme R-10+0.6 mol/L mannitol.The digestion was conducted in the dark under 28℃for 14h,and the protoplasts yield was 4.09×106per gram,the vitality was 83.12%.(2)The optimal enzyme solution for callus protoplast isolation was 2.0%cellulase onozuka R-10+0.5%macerozyme R-10+0.5mol/L mannitol.The digestion was conducted in the dark under 28℃for 14h,and the protoplasts yield was 6.05×106per gram,the vitality was 84.13%.(3)The transient expression vector pEZS-NL with reported gene coding green fluorescent protein(GFP)was transferred into protoplasts by 40%PEG-4000method.The GFP protein expressed stably and clearly in all over the protoplast.We establish grape protoplast isolation and transformation sys-tem in this paper.The gene can be expressed efficiently in grape protoplasts with a small amount of plasmid DNA,which provides technical support for grape functional genomics studies.
grapevine;protoplast;leaf;callus;genetic transformation;transient expression
Q781
A
10.7606/j.issn.1000-4025.2015.06.1262
1000-4025(2015)06-1262-07
2015-02-04;修改稿收到日期:2015-04-13
国家自然科学基金(31471842)
舒小娟(1990-),女,在读硕士研究生,主要从事果树栽培与分子生物学研究。E-mail:1175609284@qq.com
*通信作者:胡建芳,教授,主要从事果树生理与分子生物学研究。E-mail:hujf@cau.edu.cn
