白菜型油菜CBF基因克隆及功能分析
2015-06-28张腾国聂亭亭陈琼琼毛玉珊
张腾国,聂亭亭,陈琼琼,毛玉珊
(西北师范大学生命科学学院,兰州730070)
白菜型油菜CBF基因克隆及功能分析
张腾国,聂亭亭,陈琼琼,毛玉珊
(西北师范大学生命科学学院,兰州730070)
利用RACE技术从‘陇油6号'油菜中克隆得到1个新的CBF(C-repeat binding factor)基因(GenBank登录号为KP974691),全长1 000 bp,其中包括5'-UTR 114 bp,3'-UTR 241 bp,开放阅读框645 bp,编码215个氨基酸,推测的蛋白质分子量23.8 kD,理论等电点为4.86。在氨基酸序列水平上,该基因与多种植物具有较高的一致性,其中与萝卜、紫茎泽兰、卷果涩荠和拟南芥的一致性分别为93.5%、83.7%、81.0%、79.0%。实时荧光定量PCR分析表明,CBF基因在油菜的茎、叶和下胚轴中均有表达,没有组织特异性;该基因表达受低温、ABA、H2O2诱导,MAPKK抑制剂U0126预处理12 h再经低温、ABA、H2O2诱导,与单独处理结果相比,CBF基因表达明显降低,表明该基因在油菜适应低温、ABA、H2O2胁迫过程中发挥作用。
油菜;CBF基因;分子克隆;表达分析
植物为了维持正常的生长和发育,需要不断地感知和适应外界环境的变化。低温是主要的环境胁迫因素之一,当受到低温胁迫时,绝大多数植物需要经过一段低温驯化过程以获得对低温的耐受能力。在植物响应低温胁迫的驯化过程中,可引起自身生理生化和分子水平上的变化[1],包括细胞和组织结构的改变、新陈代谢过程以及基因表达水平的变化等[2],其中以低温激活或抑制基因的转录最为重要。拟南芥中受低温调节的基因占基因组的4%~20%[3],其中有一类低温胁迫响应基因COR(cold responsive),其启动子区有干旱反应元件DRE/ CRT,拥有共同的核心基序(CCGAC)。Stockinger等[4]从拟南芥中分离得到了能够结合干旱反应元件DRE/CRT的转录因子DREB1/CBF。CBF是一类AP2/EREBP(Apetala2/ethylene-responsive element binding protein)类DNA结合蛋白,其一级结构含有AP2/EREBP的DNA结合域,可以和COR基因启动子中顺式作用元件CRT/DRE(C-repeat/ Dehydration Responsive Element)相互识别并特异性结合。CBF基因家族的3个成员可以被低温胁迫短暂而迅速地诱导[5-6],诱导的CBF转录因子可以结合到COR基因启动子顺式作用元件上,激活COR基因的表达。异位表达CBF1/3可以激活含有DRE/CRT启动子元件的基因在常温下表达,导致组成型低温耐受[7-8]。
Chinnusamy等[9]从拟南芥中分离得到一个组成型表达的转录因子ICE1(inducer of CBF expression 1),ICE1基因编码类似MYC的b HLH转录因子,在低温胁迫响应途径中,ICE1作为CBFs的上游因子,可特异地结合到CBF3启动子的MYC作用元件,激活CBF3的表达并诱导CBF/DREB1下游基因的转录表达。组成型过量表达ICE1可增强低温驯化过程中CBF3、CBF2以及COR基因的表达,提高转基因植株的低温耐受能力。ice1突变体可以减弱低温对CBF3及受CBFs转录因子控制的COR基因的诱导表达。在ice1突变体中,大约40%受低温调节的基因和46%受低温调节的转录因子的表达受到了抑制[3]。以上研究表明,由ICE1→CBF→COR组成的低温响应转录网络在植物低温驯化过程中发挥着重要的作用。ICE1转录因子在植物体内是组成型表达,并定位于细胞核中,但只有在低温胁迫过程中,ICE1才能诱导CBFs的表达,说明ICE1要激活下游基因的表达,其本身的活性还受到低温胁迫诱导的转录后调控[9]。有研究表明,低温胁迫可以诱导ICE1的磷酸化[10]。然而能使ICE1磷酸化激活的上游激酶是什么,目前并没有明确的研究结果。和ICE1→CBF→COR低温响应转录网络一样,植物体内存在的MAP激酶级联途径在响应逆境胁迫过程中同样发挥着重要的作用[11]。拟南芥中的研究表明,转录因子WRKY53在体外可以被MKK1激活[12]。MPK3/6通过磷酸化转录因子EIN3(ethylene-insensitive3)实现对乙烯信号的调解[13]。Popescu等[14]用拟南芥中被特定MKKs激活的10种MPK激酶作为探针,与包含有2 158种蛋白的微阵列芯片杂交,共鉴定出570种MPK磷酸化底物,包括MYB、b ZIPs、AP2/ EREBP、WRKY转录因子家族在内的大部分转录因子均受到MPK激酶的磷酸化调节。水稻MAP激酶BWMK1通过磷酸化激活转录因子Os-EREBP1,从而增强OsEREBP1与PR基因启动子GCC元件的结合活性[15]。BWMK1还可以通过磷酸化激活转录因子OsWRKY33,增强OsWRKY33与PR基因启动子W-box元件的结合活性[16]。组成型表达的ICE1转录因子是否受MAP激酶的磷酸化激活,进而调控CBF、COR的表达,目前还没有相关报道。
油菜是重要的油料作物,白菜型冬油菜新品种‘陇油6号'是一种超强抗寒性品种,适应于极端低温为—20℃~—30℃的中国北方旱区、寒区种植,是目前唯一能在甘肃省中北部与河西地区安全越冬的冬油菜品种。本研究以‘陇油6号'为研究材料,克隆CBF基因,在低温、ABA、H2O2单独处理,以及结合MAPKK专一性抑制剂U0126预处理情况下,对该基因的表达进行分析,以期对CBF基因在植物抗逆胁迫中的作用机制提供一定参考依据。
1 材料与方法
1.1 实验材料
油菜‘陇油6号'和‘天油2号'种子由甘肃农业大学提供。选取饱满均匀的‘陇油6号'和‘天油2号'油菜种子,用水浸泡15 min后,种于含有混合营养土的小塑料盆内,每盆约6~8粒种子,培养条件为25℃/18℃(昼/夜)、光周期为10 h/14 h(光/暗)、光照强度为130μmol·m—2·s—1。培养4周左右后挑选长势相同的幼苗用于后续实验。
1.2 方 法
1.2.1 油菜CBF基因的克隆 选取生长良好的‘陇油6号'油菜幼嫩叶片,按照Trizol试剂说明书进行总RNA提取,提取的RNA用TAKARA公司PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒进行反转录得到相应的c DNA,放置于—20℃冰箱保存备用。
从GenBank下载已克隆的植物CBF基因序列,用DNAstar软件Editseq模块对其编码区进行序列编辑,Meg Align模块进行序列比对,根据比对结果,设计简并性引物CBF-U(5'-ATGAMCTCATTTTCWRCYTTYTC-3')和CBF-D(5'-CTARTAACTCCAWAGSGAYAC-3',W=T+A,R=A+G,Y=C+T,S=G+C)。以反转录所得的‘陇油6号'油菜c DNA为模板,按照Premix Ex TaqDNA Polymerase操作说明书(宝生物工程公司)进行PCR扩增。PCR反应体系为:预混酶12.5μL,CBF-U 1μL,CBF-D 1μL,模板1μL,加灭菌去离子水至总体积25μL。扩增条件为:94℃预变性3 min;94℃变性1 min,61℃退火1 min,72℃延伸2 min,35个循环;72℃延伸10 min。扩增产物按照Easy Pure Quick Gel Extraction Kit回收试剂盒(离心柱型,购自全式金公司)回收,连入p TG19-T载体。反应体系与反应条件为:缓冲液0.5μL、p TG19-T载体0.5μL、T4DNA连接酶0.5μL、回收产物3.5μL。4℃过夜连接。连接产物转化大肠杆菌Trans 5α感受态细胞,37℃过夜培养,蓝白斑筛选后挑取白斑,经菌液PCR检测后,挑选阳性克隆,送华大基因公司测序。
将Trizol法提取的‘陇油6号'油菜总RNA按MARTerTMRACE cDNA Amplification Kit方法修饰后用试剂盒内特异性引物反转录,再分别进行3'-RACE和5'-RACE扩增。根据扩增到的油菜CBF基因中间片段序列,设计3'-RACE上游特异性引物CBF3'U1(5'-CGCCATAGCCCTCCGTGGCAAATC-3'),试剂盒中自带的short primer作为匹配的下游引物,以反转录得到的cDNA为模板,进行PCR扩增,得到预期大小的片段,切胶回收,连接p TG19-T载体,转化大肠杆菌Trans 5α,蓝白斑筛选阳性克隆、测序。根据扩增到的油菜CBF基因中间片段序列,设计5'-RACE下游特异性引物CBF5'D1(5'-AACAAGGTCGGCATCCCGAACATGGAC-3'),试剂盒自带的short primer作为匹配的上游引物,以反转录得到的cDNA为模板,进行PCR扩增,得到预期大小的片段切胶回收,连接p TG19-T载体,转化大肠杆菌Trans 5α感受态细胞,过夜培养,蓝白斑筛选阳性克隆、测序。根据3'-RACE和5'-RACE测序结果,设计1对引物扩增CBF全长基因。PCR产物纯化回收后,连接p TG19-T载体,转化大肠杆菌Trans 5α,37℃过夜培养。蓝白斑鉴定筛选阳性克隆测序。
1.2.2 油菜CBF预测蛋白的生物信息学分析 应用DNAstar软件Protean模块进行氨基酸组成成分、蛋白基本特征分析,Clustal方法进行以氨基酸序列为基础的序列比对。用在线工具SOPMA预测蛋白质的二级结构;根据生物信息学软件Top-Pred(http://services.cbib.U-bordeaux2.fr/pise/ Toppred.htm1)在线分析蛋白的亲水/疏水性。
1.2.3 油菜CBF基因实时荧光定量PCR 用 Ta KaRa公司的SYBR Premix Ex TaqTM定量分析不同组织和不同处理条件下CBF基因表达水平的变化。从‘陇油6号'油菜的茎、叶、下胚轴提取总RNA,反转录后用实时荧光定量PCR检测CBF基因组织特异表达。
低温处理:选取培养4周,长势良好的‘陇油6号'和‘天油2号'油菜幼苗,4℃低温诱导,分别在处理0、12、36和48 h后提取幼嫩叶片总RNA。ABA处理:培养4周的油菜幼苗喷洒100μmol/L ABA溶液于植株叶面,喷到叶片滴水为止,分别在处理0、1、8和12 h后提取幼嫩叶片总RNA。H2O2处理:用Hoagland营养液配制的不同浓度H2O2溶液(0、5、10和15 mmol/L),浸泡培养4周的油菜幼苗24 h,剪取幼嫩叶片直接用于RNA提取。MAPKK抑制剂U0126预处理后再逆境处理:将培养4周的油菜幼苗用蒸馏水清洗,放入水中2 h以抵消损伤胁迫,然后放入10μmol/L MAPKK专一抑制剂U0126溶液中预处理12 h,再转入上述各种逆境处理,提取不同处理条件下幼嫩叶片总RNA。以上不同处理后提取的总RNA,经反转录得到cDNA作为实时荧光定量PCR模板。分别以Actin F(5'-TGTGCCAATCTACGAGGGTTT-3')和ActinR(5'-TTTCCCGCTCTGCTGTTGT-3')为管家基因引物,CBFDL-U1(5'-TAAGTGGGTGTGTGAGGTGAGG-3')和CBFDL-D1(5'-TGAGGCAGGCGGATTTG-3')为CBF引物,进行荧光定量PCR扩增,每个样品做3个重复。扩增体系为:SYBR Premix Ex TaqTM12.5μL,上、下游引物(10μmol/L)各0.5μL,cDNA 2μL,dd H2O 9.5 μL。扩增程序为:95℃预变性30 s;95℃变性5 s,60℃退火20 s,40个循环;55~95℃每30 s渐进升高0.5℃,81个循环。采用2—ΔΔCt方法分析数据,确定基因相对表达量。
2 结果与分析
2.1 油菜CBF基因的克隆
根据GenBank上已知的植物CBF基因序列,设计简并引物,以‘陇油6号'油菜中提取的总RNA反转录产物为模板,扩增得到约650 bp大小的单一条带(图1),此条带和预期大小相符,将其测序结果与其他植物的CBF基因进行序列比对分析,发现与拟南芥AtCBF1基因具有较高的一致性,为84.0%。因此,初步判断扩增产物为油菜CBF基因片段。
3'-RACE扩增产物大小在500~750 bp之间(图2,A),与预期扩增片段大小相符。测序结果与前面扩增得到的油菜CBF基因片段进行序列比对分析,发现重叠部分核苷酸序列完全相同,说明3'-RACE得到片段与克隆得到的CBF基因片段属于同一条基因。5'-RACE扩增产物大小在500~750 bp之间(图2,B),与预期扩增片段大小相符,测序结果经序列比对,与前面扩增得到的基因片段中重叠部分核苷酸序列完全相同,说明5'-RACE获得的片段与前面克隆得到的中间片段属于同一条基因。
将简并引物扩增得到的中间片段序列和RACE扩增得到的5'和3'端序列进行拼接,得到一条1 000 bp基因序列,包含1个645 bp开放阅读框(ORF),起始密码子ATG前5'-UTR 114 bp,终止密码子TAG后3'-UTR 241 bp,包含30 bp的poly A。该基因编码215个氨基酸(图3),分子量为23.8 k D,等电点为4.86。为了进一步确认油菜CBF基因拼接序列,根据3'-RACE和5'-RACE扩增序列设计引物进行PCR扩增,获得的片段与拼接序列的核苷酸组成完全相同。
2.2 油菜CBF推导氨基酸序列与其他植物氨基酸序列比对分析
从GenBank中下载已知植物CBF基因序列,利用DNAStar软件,将所有基因的CDS区导入Megalign模块,用Clustal W方法进行氨基酸序列的比对(图4)。结果表明,油菜CBF预测蛋白符合CBF家族蛋白的特征,含有CBF家族蛋白特征序列‘PKK/RPAGR×KF×ETRHP'和‘DSAWR'(图4)。与多种植物的CBF蛋白有较高的一致性,其中与萝卜RsCBF1(GQ866977)、紫茎泽兰AaCBF3(KF804148)、卷果涩荠MsCBF3(JQ687138)和拟南芥AtCBF1(ATU77378)的一致性分别为93.5%、83.7%、81.0%和79.0%。

图1 油菜CBF基因片段RT-PCR扩增M.DL2000;1.CBFFig.1 RT-PCR amplification of CBF fragment in B.campestris
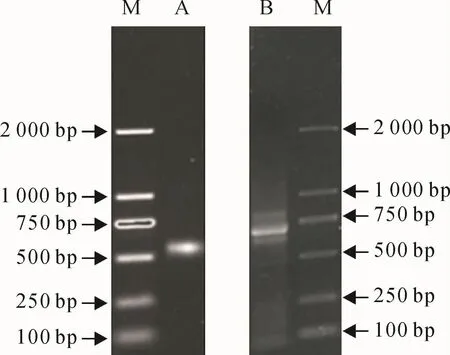
图2 CBF基因3'-RACE和5'-RACE PCR扩增结果M.DL2000;A.3'-RACE;B.5'-RACEFig.2 3'-RACE and 5'-RACE PCR product of CBF

图3 CBF基因cDNA序列及预测氨基酸序列Fig.3 The cDNA sequence and deduced amino acid sequence of B.campestris CBF gene

图4 油菜CBF与部分植物CBF氨基酸序列比对下划线序列为CBF家族蛋白特征序列CBF.油菜;AaCBF3(KF804148).紫茎泽兰;HrCBF(EF502044).沙棘;AtCBF1(ATU77378)、AtCBF2(AF074601)、AtCBF3(AF062925).拟南芥;OpCBF1(FJ491244).无苞芥;CsCBF1(DQ776899).黄瓜;CbCBF(AY994127).高山离子芥;LpCBF3(KF283992).抱茎独行菜;MsCBF3(JQ687138).卷果涩荠;RsCBF1(GQ866977).萝卜Fig.4 Alignment of the B.campestris CBF with CBF from other plant species The underlined sequences are CBF family protein character sequences CBF.Brassica campestris;AaCBF3(KF804148).Ageratina adenophora;HrCBF(EF502044).Hippophae rhamnoides;AtCBF1(ATU77378),AtCBF2(AF074601),AtCBF3(AF062925).Arabidopsis thaliana;OpCBF1(FJ491244).Olimarabidopsis pumila;CsCBF1(DQ776899).Cucumis sativus;CbCBF(AY994127).Chorispora bungeana;LpCBF3(KF283992).Lepidium perfoliatum;MsCBF3(JQ687138).Malcolmia scorpioides;RsCBF1(GQ866977).Raphanus sativus
油菜CBF预测蛋白的疏水性在线分析表明,CBF为亲水性蛋白。油菜CBF蛋白二级结构在线预测结果显示,油菜CBF蛋白包含30.84%α-螺旋、10.75%延伸链、3.27%β-转角和55.14%不规则卷曲。由预测结果知油菜CBF蛋白主要以不规则卷曲和α-螺旋为主,这种均衡的α-螺旋和无规则卷曲二级结构的存在是AP2类转录因子的基本特征。
2.3 油菜CBF基因表达分析
提取‘陇油6号'油菜茎、叶和下胚轴m RNA反转录得到的cDNA为模板,进行实时荧光定量PCR,分析CBF基因在油菜不同组织的表达。结果表明,CBF基因在油菜茎、叶和下胚轴中均有表达,没有组织特异性。在下胚轴中相对表达量最为丰富,其次是茎,叶中最弱(图5)。
4℃低温处理结果表明,2种油菜中CBF基因表达受4℃低温胁迫诱导,随着处理时间的增加,CBF基因表达整体上呈先升高后降低趋势。在‘陇油6号'中,其增长幅度比‘天油2号'更明显,表明CBF基因在‘陇油6号'中受低温胁迫诱导程度更强,与‘陇油6号'比‘天油2号'抗寒性更强的生理特性一致。MAPKK抑制剂U0126预处理12 h后再4℃低温处理,结果显示,与各自单独4℃低温处理相比,2种油菜中CBF基因转录水平整体变化趋势一致,但表达量均有不同程度下降(图6,A)。说明MAPKK抑制剂U0126预处理抑制了4℃低温胁迫对油菜CBF基因的诱导,造成其转录水平降低。
外源ABA处理结果表明,‘陇油6号'中,喷洒100μmol/L ABA溶液处理1 h和8 h时,与0 h相比,CBF基因表达没有明显变化,处理12 h时,表达量为对照的9倍。‘天油2号'中,CBF基因表达各处理与0 h没有明显变化(图6,B)。MAPKK抑制剂U0126预处理12 h后ABA处理结果显示,与各自单独ABA处理结果相比,2种油菜中CBF基因转录水平整体变化趋势一致,但表达量均有不同程度下降。
H2O2处理结果表明,2种油菜同时在不同浓度H2O2溶液(0、5、10和15 mmol/L)处理24 h,‘陇油6号'CBF基因表达呈先升高后下降趋势,相对于0 mmol/L,整体呈现上升趋势,在5 mmol/L处理条件下达到最大。‘天油2号'中,CBF基因表达也较0 mmol/L有不同程度增强,呈先升高后降低趋势,在10 mmol/L达到最大。MAPKK抑制剂U0126预处理12 h后H2O2处理结果显示,与各自单独H2O2处理结果相比,2种油菜中CBF基因整体变化趋势基本一致,但表达量均有不同程度下降(图6,C)。说明MAPKK抑制剂U0126预处理抑制了H2O2对油菜CBF基因转录的诱导,造成其转录水平的降低。

图5 CBF基因不同组织中的表达Fig.5 The expression of CBF gene in different tissues

图6 不同处理下2种油菜中CBF基因的表达Fig.6 The expression of CBF gene of B.campestris under different treatments
3 讨 论
本研究从‘陇油6号'油菜中克隆得到了含完整编码序列的CBF基因,序列分析表明油菜CBF基因和其他植物中已克隆得到的CBF基因同源性很高。CBF是植物所特有的转录因子,由低温、干旱及高盐等逆境胁迫诱导表达后,可激活依赖DRE/ CRT顺式作元件的抗逆功能基因的表达,从而增强植物对干旱、低温及高盐等逆境的抗性。拟南芥中CBF1、CBF2、CBF3基因的表达受到低温胁迫短暂而强烈的诱导[17]。大豆中Gm DREB3/CBF3基因的表达受低温胁迫的诱导,过表达Gm DREB3/ CBF3可以提高转基因植物对低温、干旱和高盐胁迫的耐受性[18]。本研究表明,CBF基因在油菜茎、叶和下胚轴中均有表达,但没有组织特异性。另外,CBF的表达受低温胁迫的诱导,‘陇油6号'中CBF基因受低温诱导程度比‘天油2号'强,这与‘陇油6号'比‘天油2号'更具抗寒性的生理特性相符。CBF基因的表达除了受到低温、干旱、高盐胁迫的诱导,ABA对CBF转录水平也有一定影响。如拟南芥CBF4的表达受干旱和ABA处理的诱导,但不受低温胁迫的影响[19]。大豆中Gm DREBc的表达受ABA、干旱和高盐胁迫的诱导[20]。葡萄Vv CBF 1、Vv CBF 2[21],大麦Hv CBF3的表达也可受到ABA的诱导[22]。本研究表明,‘陇油6号'在ABA处理12 h后CBF基因表达量有明显的升高,而‘天油2号'油菜中ABA处理下CBF基因表达量与0 h相比没有明显变化。Maruta等[23]的研究结果表明,植物叶绿体中清除H2O2的关键酶APX活性被抑制后,CBF1基因的转录水平会受到抑制,而外源H2O2处理对CBF表达的影响目前还没有相关报道。本研究结果表明,外源H2O2处理下,油菜CBF基因的转录水平与对照相比有不同程度的提高,其调控机理还需要进一步研究。ICE1是CBF基因的正调控因子,能直接作用于CBF基因的启动子上,ICE1转录因子在植物体内是组成型表达,在低温胁迫诱导下ICE1被磷酸化激活后才能诱导CBFs的表达[9],本研究用MAPKK抑制剂U0126预处理后再进行低温、ABA、H2O2胁迫时,发现油菜CBF基因的转录水平与单独胁迫处理相比明显降低,说明MAPKK抑制剂U0126预处理抑制了逆境胁迫对油菜CBF基因转录的表达,表明由MAPKKK、MAPKK、MAPK构成的MAP激酶信号传导途径与CBF的表达有相关性。推测MAPK有可能是ICE1转录因子的上游磷酸化激酶。关于MAP激酶信号传导途径与ICE1、CBF、COR构成的低温响应转录网络是否关联,需要进一步的研究。
[1] THOMASHOW M F.Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J].Annual Review Plant Physiology and Plant Molecular Biology,1999,50:571—599.
[2] VISWANATHAN C,ZHU J K.Molecular genetic analysis of cold-regulated gene transcription[J].Philsophical Transactions of the Royal Society of London,Series B,2002,357(1 423):877—886.
[3] LEE B,HENDERSON D,ZHU,J.The Arabidopsis cold-responsive transcriptome and its regulation by ICE1[J].Plant Cell,2005,17(11):3 155—3 175.
[4] STOCKINGER E J,GILMOUR S J,THOMASHOW M F.Arabidopsis thaliana CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J].Proceedings of the National Academy of Science of USA,1997,94(3):1 035—1 040.
[5] GILMOUR SJ,ZARKA D G,STOCKINGER E J,et al.Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J].Plant Journal,1998,16(4):433—442.
[6] MEDINA J,BARGUES M,et al.The Arabidopsis CBF gene family is composed of three genes encoding AP2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J].Plant Physiology,1999,119(2):463—469.
[7] JAGLO-OTTOSEN K R,GILMOUR SJ,ZARKA D G,et al.Arabidopsis CBF 1 overe xpression induces COR genes and enhances freezing tolerance[J].Science,1998,280(5 360):104—106.
[8] SHINWARI Z K,NAKASHIMA K,MIURA S,et al.An Arabidopsis gene family encoding DRE/CRT binding proteins involved in low-
temperature-responsive gene expression[J].Biochemical and Biophysical Research Communications,1998,250(1):161—170.
[9] CHINNUSAMY V,OHTA M,KANRAR S,et al.ICE1:a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J].Genes&Development,2003,17(8):1 043—1 054.
[10] CHINNUSAMY V,ZHU J,ZHU J.Cold stress regulation of gene expression in plants[J].Trendsin Plant Science,2007,12(10):444—451.
[11] ZHANG T,LIU Y,et al.Diverse signals converge at MAPK cascades in plant[J].Plant Physiology and Biochemistry,2006,44(5—6):274—283.
[12] MIAO Y,ZENTGRAF U.The antagonist function of Arabidopsis WRKY53 and ESR/ESP in leaf senescence is modulated by the jasmonic and salicylic acid equilibrium[J].Plant Cell,2007,19(3):819—830.
[13] YOO S D,CHO Y H,et al.Dual control of nuclear EIN3 by bifurcate MAPK cascades in C2H4signalling[J].Nature,2008,451(7 180):789—795.
[14] POPESCU S C,POPESCU G V,BACHAN S.MAPK target networks in Arabidopsis thaliana revealed using functional protein microarrays[J].Genes&Development,2009,23(1):80—92.
[15] CHEong Y H,MooN B C,KIM J K,et al.BWMK1,a rice mitogen-activated protein kinase,locates in the nucleus and mediates pathogenesis-related gene expression by activation of a transcription factor[J].Plant Physiology,2003,132(4):1 961—1 972.
[16] KOO S C,MOON B M,KIM J K,et al.OsBWMK1 mediates SA-dependent defense responses by activating the transcription factor Os-WRKY33[J].Biochemical and Biophysical Research Communications,2009,387(2):365—370.
[17] FOWLER S,THOMASHOW M F.Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway[J].The Plant Cell,2002,14(8):1 675—1 690.
[18] CHEN M,XU Z,XIA L,et al.Cold-induced modulation and functional analyses of the DRE-binding transcription factor gene,Gm-DREB3,in soybean(Glycine max L.)[J].Journal of Experimental Botany,2009,60(1):121—135.
[19] HAAKE V,COOK D,RIECH MANN J L,et al.Transcription factor CBF4 is a regulator of drought adaptation in Arabidopsis[J].Plant Physiology,2002,130(2):639—648.
[20] LI X P,TIAN A G,LUO G Z,et al.Soybean DRE-binding transcription factors that are responsive to abiotic stresses[J].Theoretical and Applied Genetics,2005,110(8):1 355—1 362.
[21] XIAO H,SIDDIQUA M,BRAYBROOK S.Three grape CBF/DREB1 genes respond to low temperature,drought and abscisic acid[J]. Plant and Cell Environment,2006,29(7):1 410—1 421.
[22] CHOI D W,RODRIGUEZ E M,Close T J.Barley CBF3 gene identification,expression pattern,and map location[J].Plant Physiology,2002,129(4):1 781—1 787.
[23] MARUTA T,NOSHI M,TANOUCHI A,et al.H2O2-triggered retrograde signaling from chloroplasts to nucleus plays specific role in
response to stress[J].J.Journal of Biological Chemistry,2012,287(15):11 717—11 729.
(编辑:宋亚珍)
Isolation and Characterization of a CBF Gene from Brassica campestris
ZHANG Tengguo,NIE Tingting,CHEN Qiongqiong,MAO Yushan
(School of Life Sciences,Northwest Normal University,Lanzhou 730070,China)
A novel CBF gene was isolated from Brassica campestris L.Longyou 6 by RACE.The full-length c DNA of CBF(GenBank No.KP974691)was 1 000 bp,contained a 5'-UTR of 114 bp,a 3'-UTR of 241 bp,and a 645 bp opening reading frame.The deduced protein was 215 amino acids with molecular weight 23.8 k Da and isoelectric point 4.86.On the amino acid sequence level,this gene showed high identities with Raphanus sativus,Ageratina adenophora,Malcolmia scorpioides and Arabidopsis thaliana(93.5%,83. 7%,81.0%and 79.0%).RT-PCR analysis revealed that CBF were expressed in the stems,leaves,and hypocotyls with almost no tissue specificity.The transcript level of CBF was increased in response to cold,ABA and H2O2stress.However,MAPKK inhibitor U0126 pretreatment 12 h before cold,ABA and H2O2stress,the expression level of CBF was significantly decreased compared with the single stress.The results suggested that CBF played an important role during cold,ABA and H2O2stress in B.campestris.
Brassica campestris;CBF gene;molecular cloning;expression analysis
Q785;Q786
A
1000-4025(2015)10-1964-08
10.7606/j.issn.1000-4025.2015.10.1964
2015-06-18;修改稿收到日期:2015-08-22
国家自然科学基金(31460099,31160089);甘肃省自然科学基金(1208RJZA268)
张腾国(1971—),男,博士,教授,主要从事抗逆生理及分子生物学研究。E-mail:zhangtengguo@163.com
