转DREB1A/Bar双价基因马铃薯的耐旱性及除草剂抗性分析
2015-06-26贾小霞齐恩芳胡新元王一航文国宏龚成文李建武
贾小霞,齐恩芳,马 胜,胡新元,王一航,文国宏,龚成文,李建武
(1.甘肃省农业科学院马铃薯研究所,甘肃省马铃薯种质资源创新工程实验室,甘肃兰州730070;2.农业部西北旱作马铃薯科学观测实验站,甘肃渭源748201)
转DREB1A/Bar双价基因马铃薯的耐旱性及除草剂抗性分析
贾小霞1,2*,齐恩芳1,2,马 胜1,2,胡新元1,2,王一航1,2,文国宏1,2,龚成文1,2,李建武1,2
(1.甘肃省农业科学院马铃薯研究所,甘肃省马铃薯种质资源创新工程实验室,甘肃兰州730070;2.农业部西北旱作马铃薯科学观测实验站,甘肃渭源748201)
在前期获得DREB1A/Bar双价转基因马铃薯的基础上,对转基因植株进行了耐旱性和除草剂抗性分析。耐旱性分析显示,在正常浇水条件下,对照和各转基因马铃薯株系生长状态良好且大致相同,各株系的丙二醛含量、相对电导率和SOD酶活性无显著差异(P>0.05)。经过控水10 d后,非转基因对照植株叶片明显萎蔫卷曲,而转基因植株仍然保持良好的生长状态;转基因株系的丙二醛含量和相对电导率显著低于非转基因株系(P<0.05),而SOD酶活性显著高于非转基因对照(P<0.05)。控水18 d时,大部分对照植株死亡,死亡率为74.33%;转基因植株只有极少数植株死亡,DR2和DR5的死亡率分别为20.43%和5.65%。用0.3%的市售草铵膦喷施各株系,10 d后,对照植株全部枯死,转基因株系的个别叶片干枯,绝大多数叶片及所有茎秆生长状态良好。以上分析表明,DREB1A和Bar基因的导入,明显增强了转基因马铃薯对干旱和除草剂的抗性。
转基因马铃薯;DREB1A;Bar;抗旱性;除草剂
马铃薯(Solanum tuberosum)不仅产量高,而且营养丰富,是甘肃省的战略性主导产业之一。然而,甘肃地处黄河上游,深居内陆,远离海洋,成雨机会少,大部分地区气候干燥,马铃薯生产常受干旱影响,产量低而不稳。因此,培育综合性状优良的抗旱品种非常迫切。
过去,育种工作者采用品种间杂交和诱变育种等传统技术,在马铃薯抗旱育种方面取得了显著成就。但由于栽培种马铃薯一般是四倍体无性繁殖材料,育种中存在基因分离复杂、花粉不育和现有栽培种基因库狭窄等缺陷,极大地限制了可以利用的基因资源。转基因育种技术能有效弥补传统育种的不足,打破物种间的界限,实现有针对性的改良品种的目的。
目前,马铃薯抗旱转基因的研究,绝大多数用Ca MV35S启动子驱动单个功能基因的表达[1-3]。植物的耐旱性是一个复杂的多基因控制系统[4],通过转入单个功能基因改良的方式,作用单一,很难奏效。转录因子DREB 1A可以调控40多个与干旱、高盐和低温胁迫有关的功能基因的表达[5-6],利用它提高植物抗逆性比单基因更有优势。目前,已利用基因转化技术将DREB1A基因转入拟南芥(Arabidopsis thaliana)[7-8]、烟草(Nicotiana tabacum)[9]、水稻(Oryza sativa)[10]、小麦(Triticum turgidum)[11-12]等作物中,提高了转基因植物的抗逆性。DREB1A转化马铃薯的研究已有报道[13],但马铃薯的耐旱性是否得到提高,尚未见报道。
杂草防治也是马铃薯稳产高产的一个重要环节。随着经济快速发展和城市化进程的加深,大量农村劳动力进入城市,导致农村劳动力相对短缺,加之农村渐渐富起来,人工和机械除草方式已不现实,对化学除草的需求紧迫。Bar基因除作为选择标记外,还能给作物带来抗除草剂的特性。使用与抗除草剂基因相配的除草剂,能有效除去杂草,大大减少劳动力,解决农田的草荒问题。
本研究在课题组已获得DREB 1A/Bar双价转基因马铃薯植株的基础上,进一步扩繁转基因株系,利用植物抗旱性评价通用方法进行耐旱性鉴定,并进行除草剂抗性试验,以期筛选获得抗旱性强并具除草剂抗性的马铃薯种质资源,为马铃薯的抗逆转基因研究提供依据。
1 材料与方法
1.1 试验材料
供试转基因株系及受体陇薯10号,由甘肃省农业科学院马铃薯研究所生物技术与种质资源研究室提供,转基因材料利用农杆菌介导法获得[13]。整个试验完成时间为2013年9月到2014年10月。
1.2 分子生物学鉴定
以含DREB1A的质粒为阳性对照,非转基因马铃薯为阴性对照,提取的草铵膦抗性植株基因组DNA为模板,以DREB1A特异引物D1(5′ATG AAC TCA TTT TCT GCT TTT TC 3′)和D2(5′TTA ATA ACTCCA TAA CGA TAC 3′)进行PCR检测,PCR产物长度为691 bp。
马铃薯植株的PCR-Southern检测,参照李淑洁和张正英[14]的方法,利用Primer 5.0软件设计特异性探针引物,由北京奥科生物公司合成。引物序列为:DRU(5′GCC GAT CAG CCT GTC TCA AT 3′),DRD(5′TCT GCC ATA TTA GCC AAC AAA CTC 3′),参照Roche公司DIG High Prime DNA Labeling and Detection starter Kit I(货号:11745832001)说明书和分子生物学操作技术[15],进行探针制备、转膜及固定、分子杂交和免疫检测。
1.3 DREB1A在转基因株系中的表达分析
挑选Southern杂交呈阳性的转基因株系进行干旱胁迫。2014年5月,将5~7 cm转DREB 1A基因和未转化马铃薯的试管苗移栽于甘肃省农业科学院生物技术研究所温室花盆(盆高为13 cm,上口径13 cm,下口径11 cm)的蛭石中,参试的马铃薯株系通过无性繁殖,挑选生长势一致的植株随机盆栽,每个株系栽9盆,每盆3株。待马铃薯植株长到15~16个叶片时,浇水至饱和状态,开始干旱胁迫(停止浇水),处理10 d时,随机剪取6盆植株中部3~4层叶片进行生理指标测定(重复3次),其余3盆继续胁迫(不浇水),一直持续18 d,逐日观察植株生长情况。
用RNAsimple Total RNAKit(TIANGEN)试剂盒提取胁迫10 d各转基因株系和非转基因对照中部3~4层叶片总RNA,采用First strand cDNA Synthesis Kit(THERMO)试剂盒反转录成cDNA。以反转录的cDNA为模板,用ABIPRISMR 7300实时荧光定量PCR仪(ABI,美国)进行实时荧光定量分析,试验设3次重复。反应体系为25μL,按照SYBR Premix Ex Taq(Ta KaRa)反应系统,以马铃薯Tubulin基因(Tubulin-F:5′-ACC TCT CGT GGA TCA CAG CAA T-3′和Tubulin-R:5′-TCA TCA GCG GCC TCA TCA TCA T-3′)为内参,用DRU/DRD特异引物进行DREB1A的特异扩增。反应条件为95℃预变性3 min,然后95℃变性10 s,56.9℃退火30 s,40个循环。用2-ΔΔCT方法[16]计算转基因马铃薯相对于受体陇薯10号马铃薯的DREB 1A基因的相对表达量。
1.4 生理生化指标的测定
采用电导仪法[17]测定质膜透性,硫代巴比妥酸法[17]测定MDA含量,氮蓝四唑 (NBT)光化还原法[17]测定SOD活性。
1.5 转基因植株除草剂抗性分析
转基因植株进行抗除草剂的检测是用市售除草剂草铵膦直接喷洒,将10%的市售草铵膦用自来水稀释到0.3%的浓度,于2014年8月22日15:40,用喷壶对被检测植株整株进行喷施,至药剂在叶片上开始凝结成水珠时停止,7 d后观察结果。
2 结果与分析
2.1 转基因植株的分子生物学鉴定
2.1.1 转基因马铃薯植株的PCR检测 以转录因子DREB 1A基因的特异引物为引物进行PCR检测,结果阳性对照(质粒pBI121-rd29-BDR)和18株抗性苗扩增出约700 bp的片段,而阴性对照(未转化马铃薯)和部分转化植株无扩增条带(图1为部分转化植株的检测结果)。图1可以看出,以转化植株2,3,4,5和6号的基因组DNA为模板扩增出了目的基因条带,而1号没有目的条带出现,初步表明2,3,4,5和6号植株的基因组中有DREB 1A基因的整合,为转基因植株,而1号没有目的基因的整合,为非转基因植株。
2.1.2 PCR-Southern检测 为进一步验证转基因马铃薯材料的正确性,在PCR检测为阳性的转基因材料中选取5株作为PCR-Southern检测的对象,以250 bp的DREB1A基因片段为探针与从转基因马铃薯叶片DNA中扩增出的DREB1A全长基因进行杂交,Southern Blotting检测结果与上一步PCR结果相吻合,验证了PCR的可靠性。表明选取的这几个材料均为转基因阳性植株(图2)。
2.1.3 实时荧光定量(qRT-PCR)分析 qRT-PCR结果分析表明,转基因植株中DREB 1A的相对表达量均显著高于未转基因对照马铃薯陇薯10号,但不同株系中表达量存在差异(图3)。
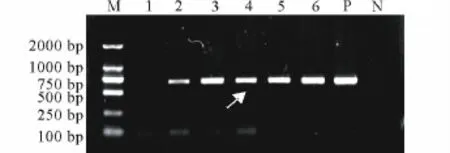
图1 转基因马铃薯DREB1A基因的PCR检测Fig.1 PCR detection of potato transformant

图2 转基因马铃薯DREB1A基因的PCR-Southern检测Fig.2 PCR-Southern analysis of transgenic plants for DREB1A gene
2.2 转基因马铃薯的耐旱性分析
选取qRT-PCR检测中DREB 1A相对表达量较高的2个转基因株系(DR2和DR5)及对照(未转基因陇薯10号)进行组织扩繁,移至盆栽后正常浇水,待各株系长至15~16叶期时进行干旱胁迫,对转基因与对照株系进行耐旱性分析。
2.2.1 干旱胁迫下马铃薯的生长状况 在正常浇水条件下,转基因植株与对照马铃薯生长状态良好且大致相同(图4A),表明DREB1A基因的导入并未对马铃薯的生长发育造成影响。停止浇水10 d时,对照陇薯10号生长发育受到抑制,叶片明显萎蔫卷曲,而转基因植株仍保持良好的生长状态(图4B)。停止浇水18 d时,大部分对照植株死亡,死亡率为74.33%,存活植株的叶片基本全部干枯,只有茎秆呈现黄绿色;转基因植株只有极少数植株死亡,DR2和DR5的死亡率分别为20.43%和5.65%,存活植株的生长虽有所抑制,但表现明显好于对照(图4C)。
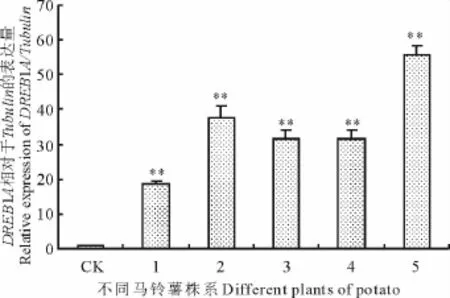
图3 转基因马铃薯中DREB1A基因表达的实时荧光定量分析Fig.3 Q-RT-PCR assays on DREB1A transcript in transgenic potato plants

图4 转基因马铃薯干旱胁迫表型分析Fig.4 Phenotypes of transgenic potato under drought stress
2.2.2 干旱胁迫下相对电导率和丙二醛(MDA)含量变化 在正常生长情况下,转基因株系和非转基因对照的相对电导率无显著差异(P>0.05)(图5A)。表明DREB1A在马铃薯中的表达不但未影响植株的生长也未改变其生理生化特性。干旱胁迫10 d后各株系相对电导率明显上升,但转基因株系的电导率显著低于对照 (图5A)。转基因株系丙二醛含量在干旱胁迫前后的变化显著低于对照,但各转基因株系间无显著差异(图5B)。

图5 转基因马铃薯的相对电导率及MDA含量Fig.5 Relative electric conductivity and MDA content of transgenic potato
2.2.3 干旱胁迫下超氧化物歧化酶(SOD)活性变化在正常浇水条件下,转DREB1A基因株系和对照马铃薯叶片中SOD酶活性较低,并且各株系差异不明显。胁迫10 d后,各株系的SOD活性增强,2个转基因株系的SOD活性相近且高于对照(陇薯10号),差异显著(P<0.05)(图6)。DREB1A基因的表达提高了转基因马铃薯的SOD活性,有利于保护细胞内的蛋白和膜系统免受氧化胁迫的伤害,增强其在干旱环境下的耐受能力。
2.3 转基因植株除草剂抗性分析
用0.3%的市售除草剂草铵膦喷施7 d时,未转基因对照萎蔫,茎秆枯黄,而各转基因株系生长状态良好;喷施10 d后,对照植株全部枯死,转基因株系的个别叶片干枯,绝大多数叶片及所有茎秆生长状态良好(图7)。表明除草剂抗性基因Bar已整合到马铃薯基因组中,并得到有效的表达。
3 讨论
逆境是指对植物生存和生长发育不利的各种环境因子的总称。当植物机体处于逆境时,由于受外界不良环境的刺激,细胞内产生大量的活性氧并形成一系列氧化活性物质,在这些氧化物质的作用下,膜脂发生过氧化,细胞质膜透性发生变化,细胞内的电解质外渗导致离子交换规律被破坏[18]。引起质膜透性发生变化的物质有很多种,其中丙二醛(MDA)因其化学性质稳定,检测方法简单易行,科研工作者常常通过测定丙二醛含量来评估植物细胞质膜的过氧化水平,进而评价植物遭受逆境伤害的程度[19]。为了消弱甚至消除细胞遭受氧化物质的毒害而使植物适应不良的环境条件,植物细胞内清除活性氧的酶促体系和非酶促体系形成一系列反应机制来维持整个防御系统的动态平衡。超氧化物歧化酶(SOD)作为酶促体系的重要成员,在维持植物细胞内活性氧代谢平衡中起着非常重要的作用,常被用来衡量逆境胁迫条件下细胞活性氧清除能力的强弱[20]。本研究发现,在干旱胁迫条件下,转基因株系的超氧化物歧化酶活性显著高于非转基因对照植株,电导率和丙二醛含量则显著低于对照,表明DREB1A基因的转入,提高了超氧化物歧化酶的活性,该酶活性的提高,有效的增强了细胞清除活性氧的能力,进而减轻了活性氧对质膜造成的伤害,增强了转基因马铃薯在干旱环境下的耐受力。该结论与DREB1A基因转化拟南芥[7-8]、烟草[9]、水稻[10]和小麦[11-12]等作物的研究结果一致,都明显提高了转基因植物的耐旱性。

图6 干旱胁迫下转基因马铃薯的SOD活性Fig.6 SOD activity in transgenic plants under drought stress

图7 转基因马铃薯的除草剂抗性分析Fig.7 Herbicide-resistant analysis of transgenic potato
随着转基因技术的快速发展,世界各国已培育出大量的抗除草剂转基因作物,这些转基因产品不仅涉及繁多的作物品种,也涉及多种多样的除草剂类型[22-23]。自1996年美国首次商业化了转基因作物之后,欧美等发达国家已培育并商品化了多种抗除草剂作物[24-26]。抗除草剂转基因作物的大面积种植,不仅为杂草的防治做出了重大的贡献,而且对于降低劳动强度、节约农业生产成本具有十分重要的意义。草铵膦属于有机磷类除草剂,因其具有活性高、药效快和无土壤活性等优点而广受研究者的青睐[27]。为研究抗草铵膦转Bar基因马铃薯的除草剂抗性,本研究用0.3%的市售除草剂草铵膦喷施未转基因对照和5个转基因株系,喷施10 d后,对照植株全部枯死,转基因株系的个别叶片干枯,绝大多数叶片及所有茎秆生长状态良好(图7)。表明除草剂抗性基因Bar已整合到马铃薯基因组中,并得到有效的表达,明显提高了转基因马铃薯的除草剂抗性。
[1] Bussis D,Meineke D,Sonnewald U,et al.Solute accumulation and decreased photosynthesis in leaves of potato plants expressing yeast-derived invertase either in the apoplast,vacuole or cytosol.Planta,1997,202(1):126-136.
[2] Yeo E T,Hawk-bin K,Sang-Eun H,et al.Genetic engineering of drought resistant potato plants by introduction of the trehalose-6-phosphate synthase(TPS1)gene from Saccharomyces cerevisiae.Molecules and Cells,2000,10(3):263-268.
[3] Zhang N,Si H J,Li L,et al.Drought and salinity tolerance in transgenic potato expressing the betaine aldehyde dehydrogenase gene.Acta Agronomica Sinca,2009,35(6):1146-1150.
[4] Courtois B,Mc Laren G,Sinha P K,et al.Mapping QTL associated with drought avoidance in upland rice.Molecular Breeding,2000,6:55-66.
[5] Seki M,Narusaka M,Abe H,et al.Monitoring the expression pattern of 1300 Arabidopsis genes under drought and cold stresses by using a full-length cDNA micro array.Plant Cell,2001,13:61-72.
[6] Fowler S,Thomashow M F.Arabidopsis transcription profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway.Plant Cell,2002,14:1675-1690.
[7] Liu Q,Kasuga M.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,in Arabidopsis.Plant Cell,1998,10:1391-1406.
[8] Kasugam M,Liu Q,Miura S,et al.Improving plant drought,salt,and freezing tolerance by gene transfer of a single stress inducible transcription factor.Nature Biotechnology,1999,17:287-292.
[9] Kasuga M,Miura S,Shinozaki K,et al.A combination of the Arabidopsis DREB1A gene and stress-inducible rd29A promoter improved drought and low-temperature stress tolerance in tobacco by gene transfer.Plant and Cell Physiology,2004,45(3):346-350.
[10] Liu L X,Zhao L S,Liang X X,et al.Study on production of transgenic wheat with a stress-inducible transcription factor gene DREB1A by microprojectile bombardment.China Biotechnology,2003,23(11):53-56.
[11] Jaglo-Ottosen K R,Gilmour SJ,Zarka D G,et al.Arabidopsis aBF1 over-expression induces CoR genes and enhances freezing tolerance.Science,1998,280:104-106.
[12] Pellegrineschi A,Reynolds M,Pacheco M,et al.Stress-induced expression in wheat of the Araobidopsis thaliana DREB1A gene delays water stress symptoms under greenhouse conditions.Geneme,2004,47(3):493-500.
[13] Jia X X,Qi E F,Wang Y H,et al.Construction of bivalent plant expression vector of DREB1A and Bar genes and studies of genetic transformation of potato.Acta Prataculturae Sinica,2014,23(3):110-117.
[14] Li S J,Zhang Z Y.Expression of the Ta6-SFT gene in Brassica napus under drought stress.Acta Prataculturae Sinica,2014,23(5):161-167.
[15] Wei Q,Cui L H,Yang S J.Experimental Guidance of Molecular Biology[M].Beijing:Higher Education Press,2005.
[16] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod.Methods,2001,25:402-408.
[17] Zhang Z A,Zhang M S,Wei R H.Experimental Guidance of Plant Physiology[M].Beijing:China Agricultural Science and Technology Press,2004.
[18] Gao W J,Xu J,Xie K Y,et al.Physiological responses of Agropyron cristatum under Na2CO3and Na HCO3stress.Acta Prataculturae Sinica,2011,20(4):299-304.
[19] Li Y,Liu G B,Gao H W,et al.A comprehensive evaluation of salt-tolerance and the physiological response of Medicago sativa at the seedling stage.Acta Prataculturae Sinica,2010,19(4):79-86.
[20] Zhang H N,Li X J,Li C D,et al.Effects of overexpression of wheat superoxide dismutase(SOD)genes on salt tolerant capability in tobacco.Acta Agronomica Sinica,2008,34:1403-1408.
[21] Wang Y X,Zhang B,Wang T.Effect of salt stress on the contents of chlorophyll and betaine and its membrane permeability of Medicago sativa.Pratacultural Science,2009,26(3):53-56.
[22] Huang D N.Progress on genetically engineering herbicide-resistance into crops.Biological Engineering Progress,1997,17(5):14-17.
[23] Wu A Z,Tang K X,Pan J S,et al.Production of herbicide-resistant rice with transforming heterogene.Acta Genetica Sinica,2000,21(17):992-998.
[24] Manabe T.Benefits of glyphosate tolerant soybeans in Japanese soybean production[C].The 18th Asian-Pa-cific Weed Science Society Conference.Beijing,P R China,2001:449-452.
[25] Marlander B.Genetically modified varieties in Germany-status and prospects with special respect of sustainable sugar beet cultivation.Zukerindustrie,1999,124(12):943-946.
[26] Oard J H.Development,field evaluation,and agronomic performance of transgenic herbicide resistant rice.Molecular Breeding,1996,2(4):359-368.
[27] Vasil I K.Phosphinothricin-resistant Crops[M].Boca Raton FL:CRC,N.Y.,1996:85-89.
参考文献:
[3] 张宁,司怀军,栗亮,等.转甜菜碱醛脱氢酶基因马铃薯的抗旱耐盐性.作物学报,2009,35(6):1146-1150.
[10] 刘录祥,赵林姝,梁欣欣,等.基因枪法获得逆境诱导转录因子DREB1A转基因小麦的研究.中国生物工程杂志,2003,23(11):53-56.
[13] 贾小霞,齐恩芳,王一航,等.转录因子DREB1A基因和Bar基因双价植物表达载体的构建及对马铃薯遗传转化的研究.草业学报,2014,23(3):110-117.
[14] 李淑洁,张正英.Ta6-SFT基因对油菜的转化及抗旱性分析.草业学报,2014,23(5):161-167.
[15] 魏群,崔丽华,杨淑杰.分子生物学实验指导[M].北京:高等教育出版社,2005.
[17] 张治安,张美善,蔚荣海.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004.
[18] 高文俊,徐静,谢开云,等.Na2CO3和Na HCO3胁迫下冰草的生长及生理响应.草业学报,2011,20(4):299-304.
[19] 李源,刘贵波,高洪文,等.紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应.草业学报,2010,19(4):79-86.
[20] 张海娜,李小娟,李存东,等.过量表达小麦超氧化物歧化酶(SOD)基因对烟草耐盐能力的影响.作物学报,2008,34:1403-1408.
[21] 王玉祥,张博,王涛.盐胁迫对苜蓿叶绿素、甜菜碱含量和细胞膜透性的影响.草业科学,2009,26(3):53-56.
[22] 黄大年.农作物抗除草剂遗传工程研究进展.生物工程进展,1997,17(5):14-17.
[23] 吴爱忠,唐克轩,潘俊松,等.转基因培育抗除草剂水稻.遗传学报,2000,21(17):992-998.
Analysis of drought tolerance and herbicide resistance in transgenic potato plants over-expressing DREB1A/Bar
JIA Xiao-Xia1,2*,QI En-Fang1,2,MA Sheng1,2,HU Xin-Yuan1,2,WANG Yi-Hang1,2,WEN Guo-Hong1,2,GONG Cheng-Wen1,2,LI Jian-Wu1,2
1.Potato Research Institute,Gansu Academy of Agricultural Sciences,Gansu Engineering Laboratory of Potato Germplasm Resources Innovation,Lanzhou 730070,China;2.The Ministry of Agriculture,Scientific Observation and Experiment Station of Dry potato in the Northwest,Weiyuan 748201,China
In order to compare drought resistance of DREB1A/Bar transgenic potato plants,with a control cultivar(non-transgenic Longshu 10),5-7 cm seedlings of DREB 1A transgenic lines were grown in pots using vermiculite and regularly watered.Watering continued to the 15-16 leaf stage after which plants were not watered for 18 days to impose for drought stress.During the drought stress,plant phenotypic features were recorded using visual observation and digital camera images.After 10 days of drought stress,stress-related physiological and biochemical parameters were determined.During the normal watering phase both the non-trans-genic control and the transgenic potato lines grew well,the MDA content,relative electrical conductivity and superoxide dismutase(SOD)activity were not significantly different(P>0.05).After 10 days of drought stress the control plants began to wilt,but the transgenic lines remained in good condition.MDA content and relative electrical conductivity in the transgenic line was significantly lower than those of the non-transgenic plants(P<0.05),while the SOD activity was significantly higher than that of non-transgenic plants(P<0.05).After for 18 days of drought stress 74.33%of the control plants were dead whereas fewer transgenic plants had died;the mortality of DR2 and DR5 was 20.43%and 5.65%respectively.The resistance of DREB 1A/Bar transgenic potatoes to glufosinate,a systemic non-selective herbicide,compared with non-transgenic lines was determined by treating plants with a 0.3%glufosinate spray.Ten days after treatment all nontransgenic plants had died,while the transgenic plants were affected slightly.The study indicated that introduction of DREB1A and Bar genes significantly enhanced drought tolerance and herbicide resistance in transgenic potato plants.
transgenic potato;DREB 1A;Bar;drought-tolerance;herbicide
10.11686/cyxb2014533 http://cyxb.lzu.edu.cn
贾小霞,齐恩芳,马胜,胡新元,王一航,文国宏,龚成文,李建武.转DREB1A/Bar双价基因马铃薯的耐旱性及除草剂抗性分析.草业学报,2015,24(11):58-64.
JIA Xiao-Xia,QI En-Fang,MA Sheng,HU Xin-Yuan,WANG Yi-Hang,WEN Guo-Hong,GONG Cheng-Wen,LI Jian-Wu.Analysis of drought tolerance and herbicide resistance in transgenic potato plants over-expressing DREB1A/Bar.Acta Prataculturae Sinica,2015,24(11):58-64.
2014-12-19;改回日期:2015-02-11
甘肃省自然科学基金(145RJZA088),国家自然科学基金(31060200),甘肃省农业科学院中青年基金(2014GAAS20)和国家马铃薯产业技术体系(CARS-10-P05)资助。
贾小霞(1978-),女,甘肃定西人,副研究员,博士。E-mail:jiaxx0601@163.com
*通讯作者Corresponding author.E-mail:jiaxx0601@163.com
