紫杉醇对宫颈癌TC-1细胞表面PD-L1表达的影响*
2015-06-24杨静肖肖魏洁寇蓬杨丽华
杨静,肖肖,魏洁,寇蓬,杨丽华
(昆明医科大学第二附属医院妇科,昆明 650000)
紫杉醇对宫颈癌TC-1细胞表面PD-L1表达的影响*
杨静,肖肖,魏洁,寇蓬,杨丽华
(昆明医科大学第二附属医院妇科,昆明 650000)
目的 探讨紫杉醇对宫颈癌TC-1细胞程序性凋亡配体1(PD-L1)表达的影响及其机制。方法 ①将细胞分为紫杉醇组及紫杉醇联合蛋白激酶D(PKD)阻断药(GÖ6976),每组设4个浓度梯度,各5个复孔,分别加入对应浓度试剂,MTT法检测紫杉醇对TC-1细胞活力的影响及GÖ 6976对紫杉醇IC50值的影响。②将细胞分为0.9%氯化钠溶液组及紫杉醇组,每组5个复孔,分别加入对应浓度试剂,免疫组化法检测紫杉醇对TC-1细胞PD-L1表达的影响。③将细胞分成阴性对照组、GÖ 6976组、紫杉醇组、紫杉醇联合GÖ 6976组4组,每组5个复孔,分别加入对应浓度试剂,免疫组化法检测紫杉醇、GÖ 6976对TC-1细胞PD-L1表达的影响。 结果 紫杉醇组紫杉醇对TC-1 细胞的IC50值为40.0 μg·mL-1,紫杉醇联合GÖ 6976组紫杉醇对TC-1细胞IC50值为38.9 μg·mL-1,两组IC50值差异无统计学意义(P>0.05)。紫杉醇处理TC-1细胞24 h后PD-L1的表达为(88.48±13.44)%,显著高于阴性对照组(39.59±5.99)%(P<0.05)。紫杉醇联合GÖ 6976处理TC-1细胞24 h后PD-L1表达为(79.7±4.7)%,显著低于紫杉醇组(96.8±2.5)%(P<0.05)。 结论 紫杉醇可增加TC-1细胞PD-L1表达,阻断PKD途径可显著抑制PD-L1表达增加的程度,紫杉醇可能是通过PKD途径发挥作用。
紫杉醇;程序性凋亡配体1;蛋白激酶D;癌,宫颈
紫杉醇是宫颈癌常用的化学治疗(化疗)药物[1]。肿瘤化疗效果除了与肿瘤细胞对化疗药物敏感性有关外,还与机体免疫状态有关,机体免疫抑制或免疫逃逸是影响化疗效果的主要原因之一[2]。T淋巴细胞的一种阴性调节信号分子程序性凋亡配体(programmed death ligand-1,PD-L1)是近年来发现的与肿瘤免疫逃逸相关的重要分子之一[3]。PD-L1与T淋巴细胞受体表面程序性凋亡受体(programmed death-1 receptor,PD-1)结合,提供抑制性信号,导致T调节细胞(T regulate cells,Treg) 活性增强及抗肿瘤T 细胞失能,抑制T细胞的分化和增殖,诱导T细胞失能或凋亡[4]。PD-L1在慢性持续感染、肿瘤等病理情况下表达可增加,导致机体免疫抑制疾病进展。有研究表明,内源抗肿瘤介质如干扰素γ(interferon-γ,INF-γ)或抗肿瘤治疗诱导下某些肿瘤细胞可表达PD-L1,抑制T淋巴细胞活性,从而影响治疗效果[5]。笔者尚未见紫杉醇对宫颈癌细胞PD-L1表达影响的研究。本研究通过免疫组化研究紫杉醇对宫颈癌TC-1细胞表面PD-L1表达的影响及其可能机制,以期为提高宫颈癌化疗效果提供理论依据。
1 材料与方法
1.1 细胞、试剂及仪器 细胞株:鼠肺上皮细胞株TC-1,是鼠源性的人乳头瘤病毒16(human papillomavirus 16,HPV16)阳性的肿瘤细胞株,由美国约翰霍普金斯大学医学院TC WU教授惠赠。兔抗鼠PD-L1多克隆抗体购自北京博奥森生物技术有限公司,噻唑蓝(methyl thiazolyl tetrazolium,MTT)购自碧云天生物技术研究所,二甲亚砜(dimethyl sulfoxide,DMSO)购自Gibco,GÖ 6976购自Sigma,紫杉醇购自海南制药厂,SP免疫组化试剂盒和二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自康为世纪。超净工作台(苏州净化设备厂,SPEG AIR TECH);微量加样器(德国Eppendorf,2.5~1 000 μL);光学显微镜、倒置相差荧光显微镜(德国Leica公司),24,96孔板(Costar公司 3524 3599);酶联免疫检测仪(美国Thermo Model 2550 EIA reader)。
1.2 细胞培养 TC-1细胞培养于含10%胎牛血清、青霉素、链霉素浓度均为100 U·mL-1的DMEM培养液,置于 5%二氧化碳、饱和湿度、37 ℃恒温培养箱内培养。常规换液传代,取对数生长期的细胞进行实验。
1.3 MTT法检测紫杉醇对TC-1细胞活力的影响及蛋白激酶D(protein kinases D,PKD)阻断药GÖ 6976对紫杉醇IC50值的影响 将细胞分为紫杉醇组及紫杉醇联合GÖ 6976组,TC-1细胞接种于 96 孔板,每组分4个浓度梯度,每个梯度设5个复孔,紫杉醇组加含紫杉醇终浓度分别为10.0,18.0,32.4,58.3 μg·mL-1的培养液每孔150 μL,紫杉醇联合GÖ 6976组每孔均加入GÖ 6976 5 μmol·L-1,然后加含紫杉醇终浓度分别为10.0,18.0,32.4,58.3 μg·mL-1的培养液。两组均在24 h加MTT,4 h加DMSO,振荡、酶标仪测量吸光度(A)值,计算细胞存活率(%)=(实验组平均A值-空白孔A值)/(对照组平均A值-空白孔A值)×100%。
1.4 紫杉醇对TC-1细胞表面PD-L1表达的影响 将细胞分为0.9%氯化钠溶液组及紫杉醇组,每组设5个复孔,紫杉醇组加入含20.0 μg·mL-1紫杉醇的培养液,0.9%氯化钠溶液组加入含0.9%氯化钠溶液的培养液,每孔500 μL。24 h后免疫组化方法检测TC-1细胞表面PD-L1表达。具体方法为4%多聚甲醛固定细胞,3%过氧化氢封闭内源性过氧化物酶,滴加PD-L1多克隆抗体,4 ℃过夜后生物素化山羊抗兔二抗,室温孵育20 min。DAB显色,苏木精复染,观察、摄像。
1.5 GÖ 6976对紫杉醇引发的TC-1细胞表面PD-L1表达变化的影响 将细胞分成4组,每组设5个复孔,阴性对照组、GÖ 6976组、紫杉醇组、紫杉醇联合GÖ 6976组。阴性对照组加入含0.9%氯化钠溶液和DMSO的培养液,GÖ 6976组加入含5 μmol·L-1GÖ 6976的培养液,紫杉醇组加入含20.0 μg·mL-1紫杉醇的培养液,紫杉醇组+GÖ 6976组加入含20.0 μg·mL-1紫杉醇和含5 μmol·L-1GÖ 6976的培养液,24 h后同“1.4”项下方法,应用免疫组化方法检测TC-1细胞表面PD-L1表达。

1.7 统计学方法 采用SPSS17.0版统计软件对数据进行统计分析处理,计量资料比较采用独立样本t检验、单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 紫杉醇对TC-1细胞活力的影响及GÖ 6976对紫杉醇IC50值的影响 紫杉醇组细胞的抑制率平均9.0%,10.4%,41.3%,62.5%。紫杉醇对TC-1细胞的增殖具有抑制作用,且呈浓度依赖性,紫杉醇对TC-1细胞的IC50为40.0 μg·mL-1。紫杉醇联合GÖ 6976组细胞的抑制率平均为9.2%,11.2%,42.1%,61.6%,紫杉醇对TC-1细胞的IC50值为38.9 μg·mL-1。两组IC50值差异无统计学意义(P>0.05)。
2.2 紫杉醇对TC-1细胞表面PD-L1表达的影响 PD-L1主要表达在细胞的细胞膜和胞质内,呈棕黄色至棕褐色颗粒或团块,多区域分布。紫杉醇处理24 h后TC-1细胞表面PD-L1的表达为(88.48±13.44)%,阴性对照组为(39.59±5.99)%,与阴性对照组比较,紫杉醇处理后的TC-1细胞表面PD-L1表达显著增加,差异有统计学意义(F=4.35,P<0.05)。见图1。

A.阴性对照组;B.紫杉醇组
图1 两组TC-1细胞表面PD-L1表达苏木精-伊红染色图(×200)
A.negative control group;B.paclitaxel group
Fig.1 HE staining on PD-L1 expression at cell surface of TC-1 in two groups(×200)
2.3 GÖ 6976对紫杉醇引起的TC-1细胞表面PD-L1表达变化的影响 与阴性对照组比较,紫杉醇组、紫杉醇联合GÖ 6976组细胞表面PD-L1的表达显著增高,而紫杉醇联合GÖ 6976组与紫杉醇组比较,细胞表面
PD-L1的表达显著降低,差异有统计学意义(F=4.06,P<0.05)。见图2,表1。
3 讨论
PD-L1过度表达与其免疫逃逸机制相关,PD-L1表达增加,与T细胞上的PD-1受体结合增加,传递的负性调控信号增多,导致活性增强及抗肿瘤T 细胞的凋亡和免疫无能,使肿瘤细胞逃避机体的免疫监控和杀伤,产生免疫逃逸。慢性持续感染、肿瘤等多种病理情况可出现PD-L1过度表达,影响肿瘤治疗效果。ZHANG等[6]报道紫杉醇、依托泊苷、5-氟尿嘧啶(5-Fu)诱导乳腺癌细胞表面PD-L1表达增加,促进PD-L1引起的T细胞凋亡,影响紫杉醇、依托泊苷、Fu对乳腺癌的抑制作用。QIN等[7]报道应用顺铂后肝癌细胞株H22过度表达PD-L1 。也有多位学者报道正常宫颈组织中不表达PD-L1,宫颈癌组织中PD-L1高表达,且细胞表面PD-L1的表达与癌细胞浸润深度明显相关[8]。本实验中笔者发现紫杉醇使TC-1细胞表面PD-L1的表达增加,提示应用紫杉醇后可增加PD-L1在肿瘤细胞的表达,这可能是影响紫杉醇化疗效果的原因之一。
QIN等[7]认为化疗药物顺铂使肝癌细胞上PD-L1表达增加是通过Erk /MAPK途径。CHEN等[5]发现干扰素γ通过蛋白激酶D2(PKD2)途径提高口腔鳞状细胞癌细胞表面PD-L1的表达。研究表明,PKD与肿瘤的生长、发展、迁移都有联系[9]。PKD家族存在于大多数真核细胞内,胞质、细胞核、高尔基体及线粒体内均有分布,在细胞间信息传递过程中发挥重要作用[10]。在本研究中,加入PKD阻滞剂后能减少紫杉醇增加肿瘤细胞表面PD-L1的增加程度,提示PKD途径参与了紫杉醇影响肿瘤细胞表面PD-L1表达增加这一过程。这一结果与干扰素增加肿瘤细胞表面PD-L1表达相似。

A.阴性对照组;B.GÖ 6976组;C.紫杉醇组;D.紫杉醇+GÖ 6976组
表1 4组TC-1细胞表面PD-L1的表达的比较
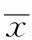

与阴性对照组比较,*1P<0.05;与紫杉醇组比较,*2P<0.05
Compared with negative control group,*1P<0.05;compared with paclitaxel group,*2P<0.05,
紫杉醇能显著抑制肿瘤细胞生长,本实验中也得出了相似的结果。本实验发现PDK阻断药能够显著减少紫杉醇增加肿瘤细胞表面PD-L1表达程度,为了探讨PDK阻断药是否可促进紫杉醇对TC-1细胞的抑制作用,用MTT法检测了PDK阻断药对于紫杉醇IC50值的影响,发现PDK阻断药未能改变紫杉醇对TC-1细胞的IC50值,说明紫杉醇对TC-1细胞的抑制作用与PDK阻断药无显著关系,提示PDK阻断药对于紫杉醇对TC-1细胞的影响是通过调节免疫因子,通过机体免疫效应发挥作用的。
因此,可推测阻断PKD途径可能阻断紫杉醇引起的肿瘤细胞表面PD-L1表达增加,抑制肿瘤细胞免疫逃逸,提高化疗效果,为提高紫杉醇化疗效果提供了理论依据。
[1] SAVARESE A,COGNETTI F.New drugs in the treatment of recurrent or metastatic cervical cancer [J].Crit Rev Onc/Hem,2003,48(3):323-327.
[2] 丁爱萍,张淑兰.调节性T细胞在妇科肿瘤发生发展中的作用及其研究进展[J].中国实用妇科与产科杂志,2012,28(9):718-720.
[3] FLIES D B,SANDLER B J,SZNOL M,et al.Blockade of the B7-H1/PD-1 pathway for cancer immunotherapy[J].Yale J Biol Med,2011,84(4):409-421.
[4] HASPOT F,FEHR T,GIBBONS C,et al.Peripheral dele-tional tolerance of alloreactive CD8 but not CD4 T cells is dependent on the PD-1/PD-L1 pathway[J].Blood,2008,112(5):2149-2155.
[5] CHEN J,FENG Y,LU L,et al.Interferon-gamma-induced PD-L1 surface expression on human oral squamous carcinoma via PKD2 signal pathway[J].Immunology,2012,217(4):385-393.
[6] ZHANG P,SU D M,LIANG M,et al.Chemopreventive ag-ents induce programmed death-1-ligand 1 (PD-L1) surface expression in breast cancer cells and promote PD-L1-mediated T cell apoptosis[J].Mol Immunol,2008,45(5):1470-1476.
[7] QIN X,LIU C,ZHOU Y,et al.Cisplatin induces progra-mmed death-1-ligand 1(PD-L1) over-expression in hepatoma H22 cells via Erk /MAPK signaling pathway[J].Cell Mol Biol (Noisy-le-grand),2010,56 (Suppl):1366-1372.
[9] EISELER T,SCHMID M A,TOPBAS F,et al.PKD is recru-ited to sites of actin remodelling at the leading edge and negatively regulates cell migration[J].FEBS Lett,2007,581(22):4279-4287.
[10] REY O,YUAN J,YOUNG S H,et al.Protein kinase Cν/protein kinase D3 nuclear localization,catalytic activation,and intracellular redistribution in response to G protein-coupled receptor agonists[J].J Biol Chem,2003,278(26):23773-23785.
DOI 10.3870/yydb.2015.08.010
Effect of Paclitaxel on Expression of PD-L1 in Surface of Cervical Cancer TC-1 Cells
YANG Jing, XIAO Xiao, WEI Jie, KOU Peng, YANG Lihua
(DepartmentofGynaecology,theSecondAffiliatedHospitalofKunmingMedicalUniversity,Kunming650000,China)
Objective To investigate effect of paclitaxel on expression of programmed death ligand-1 (PD-L1) in the surface of cervical cancer TC-1 cells and its mechanism. Methods ①The cells were divided into two groups: paclitaxel group, paclitaxel combined with PKD blocker (GÖ 6976) group.There were 4 concentration gradient and 5 holes for each group, and each hole has its corresponding concentration of drugs.Influence of paclitaxel on TC-1 cell viability and effect of PKD blocker GÖ 6976 on IC50value of paclitaxel were evaluated by MTT method.②The cells were divided into 0.9% sodium chloride solution (NS) group and paclitaxel group, There were 5 holes of each group.Effect of paclitaxel on PD-L1 expression on the surface of TC-1 cells were measured by immunohistochemistry.③The cells were divided into 4 groups: NS+DMSO group, GÖ 6976 group, paclitaxel group and paclitaxel+GÖ 6976 group.There were 5 holes for each group.Effect of paclitaxel and GÖ 6976 on PD-L1 expression on the surface of TC-1 cells were measured by immunohistochemistry.The expressions of PD-L1 on the surface of cells were measured by immunofluorescence treated with different drugs. Results The IC50value of paclitaxel was 40.0 μg·mL-1in paclitaxel group, and 38.9 μg·mL-1in paclitaxel combined with PKD blocker GÖ 6976 group, without significant difference between the two groups (P>0.05).The expression of PD-L1 in the surface of TC-1 cells were significantly higher in paclitaxel group than in negative control group [(88.48±13.44)%vs.(39.59±5.99)%,P<0.05].The expression of PD-L1 in the surface of TC-1 cells was (79.7%±4.7)% after treatment with paclitaxel combined with PKD blocker GÖ 6976 for 24 h, and it was significantly lower than that in paclitaxel group [(96.8±2.5)%,P<0.05]. Conclusion Paclitaxel promotes the expression of PD-L1 in the surface of TC-1 cells, which could be significantly inhibited by blocking PKD pathway.Paclitaxel may exert its effect through PKD pathway.
Paclitaxel;Programmed death ligand-1;Protein kinases D;Cancer, cervical
2014-09-03
2015-01-09
*云南省科技厅应用基础研究面上基金资助项目(2012FB162)
杨静(1987-),女,湖北荆州人,在读硕士,研究方向:妇科肿瘤。电话:(0)18163138117,E-mail:olivehope@163.com。
杨丽华(1972-),女,云南丽江人,副教授,博士,研究方向:妇科肿瘤。电话:(0)13759481789,E-mail:13759481789@163.com。
R979.1;R737.3
A
1004-0781(2015)08-1028-04
