氧四环素在典型土壤中的吸附/解吸行为及其吸附态生物有效性研究
2015-06-23彭凤姣应光国周丽君刘有胜潘长桂梁燕秋
彭凤姣, 应光国, 周丽君, 刘有胜, 潘长桂, 梁燕秋
氧四环素在典型土壤中的吸附/解吸行为及其吸附态生物有效性研究
彭凤姣, 应光国*, 周丽君, 刘有胜, 潘长桂, 梁燕秋
(中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广东 广州 510640)
采用批平衡实验方法, 研究了氧四环素(oxytetracycline, OTC)在褐土、红壤与森林土壤中的吸附/解吸行为, 同时以大肠埃希菌(ATCC 25922,ATCC 25922)作为实验菌株, 研究了土壤吸附态的氧四环素的生物活性。结果表明, Freundlich和Langmuir模型均可以对OTC在三种土壤中的吸附和解吸曲线数据进行良好的拟合, OTC在褐土中的吸附/解吸等温线呈线性, 而在红壤与森林土壤中的吸附/解吸等温线呈非线性, 且Langmuir方程拟合效果优于Freundlich方程。OTC在三种土壤上的解吸过程均存在明显的滞后性。土壤吸附态抗生素对细菌生长的抑制作用表明, OTC与土壤发生吸附作用之后, 依然具有生物有效性。
氧四环素; 土壤; 吸附; 解吸; 生物有效性
0 引 言
四环素类抗生素常作为预防和治疗细菌感染的药物以及促进动物生长的饲料添加剂而被广泛使用[1]。据报道, 在美国, 2009年抗生素年使用量为2.27万t, 其中1.3067万t用于畜牧业、农业和水产业[1]。在我国, 2010年抗生素年生产量为21万t, 其中48%用于畜牧业、农业和水产, 42%用于居民临床医疗, 10%用于出口[2]。在环境中频繁检出四环素类抗生素残留物[3–5]。Chen.[6]研究发现在中国华东地区, 养猪场粪便中OTC的浓度高达354 mg/kg, 而土壤中浓度高达15.5~29.0 μg/kg。土壤中的抗生素主要来源于污水处理厂出水和养殖废水灌溉农田[7]、污水处理厂脱水淤泥或粪便农用[6,8]等。土壤环境中的抗生素残留物可以影响土壤微生物的活性以及群落的组成[9–10], 并且通过对微生物群落施加选择性压力而导致抗生素耐药性的产生[11]。因此, 了解抗生素在土壤环境中的行为及效应是很重要的。
OTC是有多个可电离官能团的两性分子(如图1所示)[12], 且在典型环境pH范围内主要以两性离子形态存在。已有的研究表明, OTC可吸附于黏土矿物[13–14]、金属氧化物[12,15]以及腐殖质[16–17]等, 直接影响其在环境中的迁移、转化及其生物有效性。对OTC在土壤中的吸附及其影响因素(离子强度、pH值、阳离子交换容量(CEC值)和土壤有机质等)也开展了相应的研究[18–19]。此外, Laak.[20]建立了土壤性质(pH、有机碳含量、黏土含量、CEC值、氢氧化铝含量以及氢氧化铁含量)与抗生素吸附行为之间相关性的偏最小二乘模型(PLS), 该模型可以用来进行土壤吸附行为的风险评价。
有机污染物吸附于土壤和沉积物中对其环境行为及生物有效性有重要影响[21]。生物体长期暴露于低浓度抗生素及抗生素在环境中的转化产物可能对其产生有毒效应, 并且可能导致微生物种群中耐抗生素基因的扩散[22–23]。已有的研究结果表明, 含抗生素的动物粪便农用可能会影响土著微生物的生长[24]、植物的生长[25]以及促进细菌种群耐抗生素性能的滋生[11]。文献报道土壤结合态抗生素的生物有效性相对于其对应浓度的原始抗生素会有所减弱[26]。但是, 较高浓度土壤结合态的抗生素可抑制土壤中敏感微生物的生长[26–28], 且其生物活性随土壤性质、细菌种类以及抗生素理化性质不同, 存在一定差异[26]。
尽管对于OTC在土壤中的吸附/解吸行为已开展了一些研究[20,28–31], 但是对于土壤结合态抗生素的性质了解甚少。对于进入环境介质中的抗生素发生吸附作用之后是否依然具有生物活性的研究甚少。因此, 本研究选择OTC作为目标化合物, 研究其在我国三种土壤(山东褐土、广东森林土以及湖南红壤)中的吸附/解吸特征及吸附后土壤结合态的OTC的抗菌活性, 为客观评价土壤结合态抗生素的生物有效性提供一定依据。
1 材料与方法
1.1 供试土壤
供试土壤为山东褐土、湖南红壤以及广东森林土壤。从北至南, 分别采自山东德州陵县, 湖南祁阳以及广州市郊区的山坡。采样深度均为0~20 cm土壤样品。褐土是山东地区典型的土壤类型, 红壤为湖南地区典型的土壤类型, 而广东森林土主要是考虑到其高有机质含量; 且各土壤所在地区间的气候条件存在显著性差异; 且土壤性质差异大, 山东褐土偏碱性, 而湖南红壤偏酸性, 广东森林土有机质含量较高; 使用LC-MS/MS分析土壤中抗生素含量水平, 结果表明土壤样品中氧四环素浓度低于仪器检出限(0.95 μg/kg)。土壤风干磨细后过20目筛备用。供试土壤基本理化性质见表1。
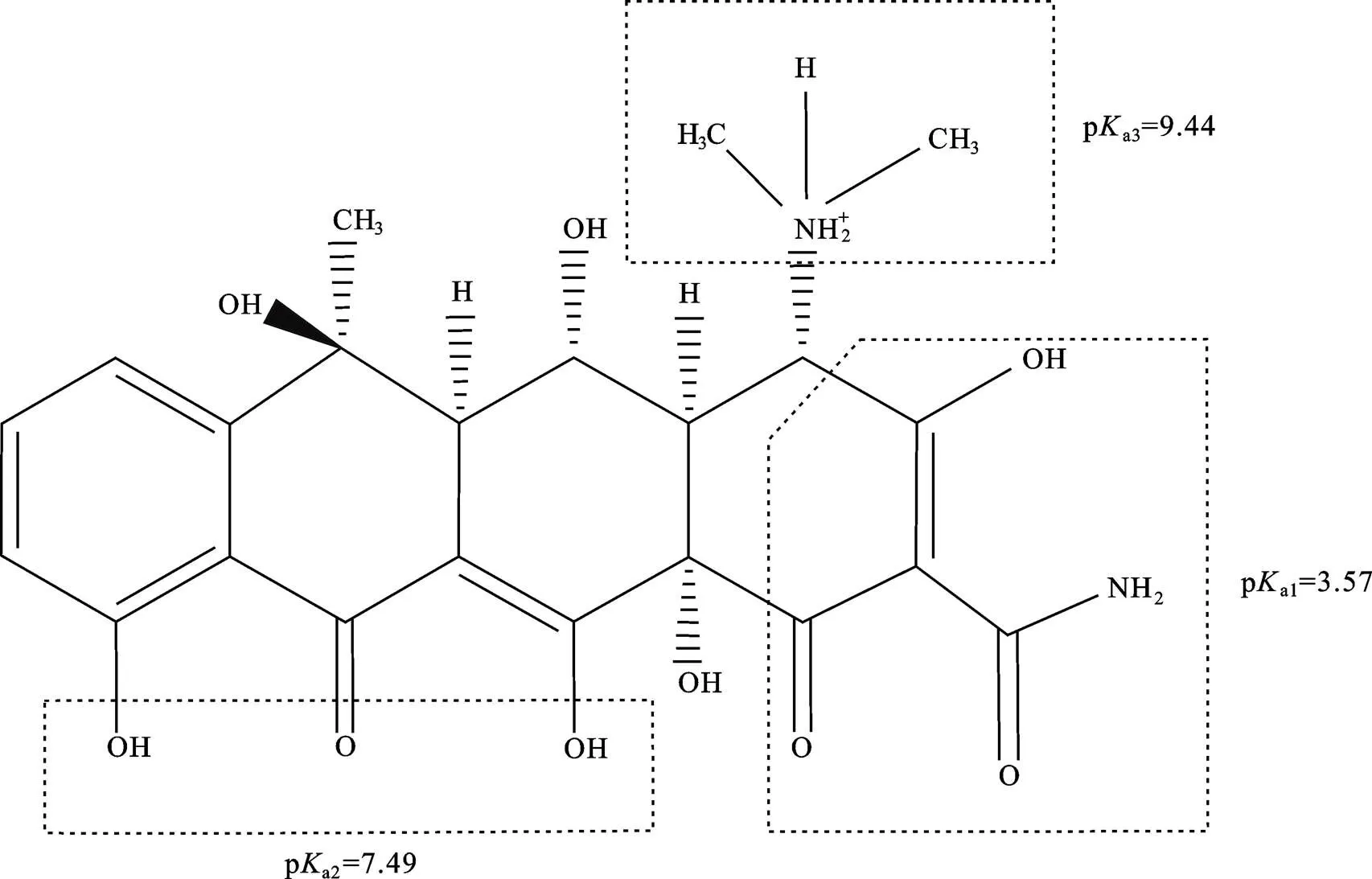
图1 OTC结构图
1.2 化学试剂
盐酸氧四环素标准品(纯度>97%), 购自南京德宝生物制剂有限公司; HCl和HNO3购自广州化学试剂厂; 乙酸和乙酸铵购自美国Sigma-Aldrich公司; 色谱纯级乙腈购于德国Merck公司; MH肉汤培养基和伊红美蓝琼脂(EMB)培养基购于广东环凯微生物科技有限公司; NA营养琼脂培养基购自上海中科昆虫生物技术开发有限公司。
1.3 生物实验菌种及菌种保存
实验菌种: 大肠埃希菌(ATCC 25922)。菌种的培养: 从–18 ℃冰箱中取出标准菌种(ATCC 25922), 接着室温放置一定时间使其解冻, 然后挑出标准菌株于伊红美蓝(EMB)平板上, 倒置放于生化培养箱中(37±0.2)℃培养24 h; 最后挑出单个菌株到液体培养基中(37±0.2) ℃、200 r/min恒温振荡培养箱中培养18 h, 备用。菌种的保存: 用0.85%灭菌生理盐水将目标菌种配成10%的二甲基亚砜溶液储存于1.5 mL离心管中。4℃放置30 min后于–18℃保存。
1.4 实验方法
1.4.1 OTC的吸附/解吸实验
吸附: 吸附实验参照OECD guideline 106批平衡方法[32]进行。准确称取若干份相同质量(0.5 g) 的山东褐土(精确至0.0001 g)于50 mL聚四氟乙烯离心管中, 高压湿法间歇灭菌3次(121℃, 15 psi, 20 min), 烘箱中60 ℃烘干; 加入过滤法灭菌的OTC溶液及背景电解质溶液CaCl2, 使最终溶液体积为20 mL, CaCl2溶液浓度为10 mmol/L。系列OTC浓度值为1、2、5、10、20、40 mg/L。然后涡旋混匀, 将离心管置于360o旋转、(25±1) ℃、20 r/min转速的恒温振荡箱中黑暗条件下振荡24 h; 之后于9130 g条件下离心10 min, 取上清液1 mL, 过0.22 µm水相滤膜, 加入5 µL 6 mol/L HCl调节溶液pH值至2~3, 以防止OTC在水溶液中的降解[33], HPLC法分析平衡溶液中OTC的浓度值e。以上处理均做3个重复, 其中未含抗生素的处理作为空白, 未含土壤的处理作为对照。由公式(1)计算OTC在土壤中的吸附量s(mg/kg)。而OTC与湖南红壤及广东森林土壤的吸附解吸实验的土水比为0.1 g/40 mL, 其他处理均相同。
s= (0–e)/(1)
s为土壤吸附的抗生素量(mg/kg);0为抗生素的起始浓度(mg/L);e为吸附平衡时水相中抗生素的浓度(mg/L);为溶液体积(L);为土壤质量(kg)。
解吸: 离心后样品弃去16 mL上层清液, 加入16 mL 10 mmol/L CaCl2溶液, 继续振荡24 h, 解吸平衡后, 同上操作, 离心并取上清液过滤, 测定其中OTC的浓度值e,解吸。由公式(2)计算得出不同初始浓度OTC在三种土壤中的解吸量解吸(mg)。
解吸=e,解吸1–e,吸附2(2)
解吸为解吸平衡时, 从土壤上解吸下来的抗生素的量(mg);e,解吸为解吸平衡时, 水相中抗生素的浓度(mg/L);e,吸附为吸附平衡时, 水相中抗生素的浓度(mg/L);1为解吸平衡时, 溶液的体积(L);2为解吸实验前, 残余的溶液体积(L)。
以上实验均在避光无菌条件下操作; 而红壤与森林土壤样品在吸附达平衡后弃掉36 mL上清液, 然后准确加入36 mL 10 mmol/L CaCl2溶液, 其他操作同褐土解吸实验操作。
1.4.2 土壤吸附态抗生素的生物活性实验
在严格无菌条件下完成吸附实验, 取出上清液后, 准确加入0.5 mL含0.1 mL菌液(ATCC 25922浓度为 0.5麦氏浊度)的2×MH肉汤培养液, 然后将菌液与土壤涡旋混匀, 置于37℃, 200 r/min恒温振荡器中培养24 h; 涂平板, 恒温培养箱中培养18 h后, 平板细菌计数法数细菌CFU数量; 以上处理均做3个重复。
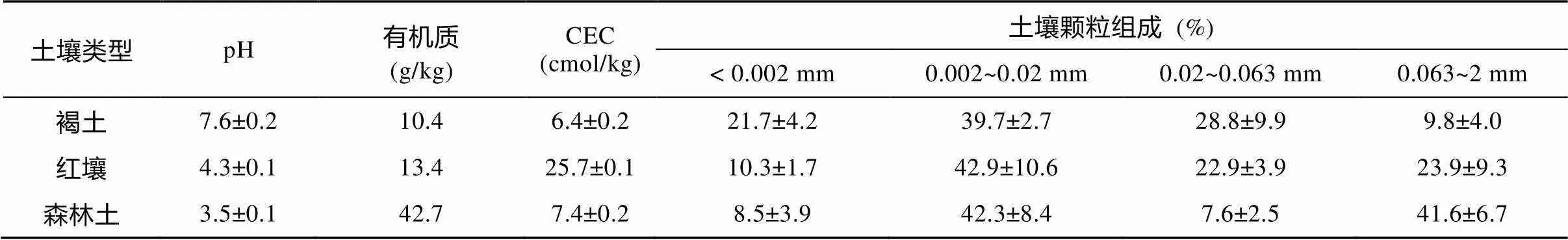
表1 供试土壤基本理化性质
1.5 HPLC分析方法
OTC采用安捷伦1200系列液相色谱进行分析。检测器为紫外检测器(UV), 检测波长为360 nm; 色谱柱为 Zorbax Eclipse XDB-C18(4.6×150 mm, 5 μm); 流动相为乙腈(A)和缓冲液(B)(1‰乙酸+10 mmol/L乙酸铵); 梯度洗脱程序:0 min10%A, 3 min40%A, 5 min80%A, 6 min10%A, 11 min10%A; 流动相流速为0.8 mL/min, 样品进样量为100 μL。在此条件下, OTC峰形良好, 样品中没有任何杂质峰干扰。7次重复样品(0.05 mg/L)的10倍标准偏差计算定量限(LOQ), 为 2.47 μg/L, OTC含量采用外标法定量, 标曲范围为0.05 ~40 mg/L。
1.6 统计分析
吸附量和解吸量均用差减法求得, 吸附/解吸等温线采用Sigmaplot10软件进行拟合。通过SPSS13.0软件使用独立样本t检验方法进行显著性差异分析。
2 实验结果与讨论
2.1 OTC在三种土壤中的吸附特性
本研究对OTC在三种土壤中的吸附等温线分别以下列等温吸附模型进行定量描述。
Freundlich模型
s=fe1/n(3)
s为土壤吸附的OTC量(mg/kg);e为平衡溶液中OTC浓度(mg/L);f为吸附常数, 代表吸附容量, 在解吸方程式中, 以f,des代替f; 1/为常数, 反映吸附的非线性程度以及吸附机理的差异。
Langmuir模型
1/e=1/m+1/(Lme) (4)
e为单位质量土壤吸附量, 等同于式(3)中的s;L是表征吸附表面强度的常数, 与吸附键合能有关, 其解吸参数以L,des表示;m为OTC单分子层吸附时的最大吸附量(mg/kg)。
利用上述2种等温吸附模型对OTC在三种土壤中的吸附数据进行拟合, 结果表明, Freundlich方程以及Langmuir方程均可良好地模拟吸附的结果, 这与鲍艳宇等[34]和齐瑞环等[35]的研究结果具有一致性。通过Sigmaplot软件拟合等温吸附/解吸曲线所得的模型拟合参数列于表2中。从表2可知, OTC在褐土、森林土以及红壤中的f值分别为73.998、1883.045和2631.040, 说明OTC在三种土壤中的吸附能力存在差异, 红壤中OTC的吸附能力最强, 其次为森林土, 褐土吸附最少。表2中1/值(0.869)表明OTC在褐土中的吸附等温线非常接近线性, 并表现出良好的相关性(>0.99); 而森林土或红壤的吸附等温拟合曲线呈明显的非线性。值表示吸附位点能量分布的不均匀性,值越接近1, 分布越均匀[36]。因此, 从表2中1/值可以得知红壤与森林土比褐土的位点能量分布更加不均匀; 从表2中不同模型对应的值可知, Langmuir方程的拟合结果较优。图2为依据Langmuir方程拟合的OTC在褐土、森林土以及红壤中的吸附/解吸等温线图。
用软件SPSS13.0计算OTC在各土壤间吸附的差异性, 结果表明褐土与红壤或森林土间均存在显著性差异(0.05), 而森林土与红壤间不存在显著性差异(0.05)。土壤对OTC的吸附能力存在差异可能与土壤的理化性质及OTC的分子结构等理化性质有关[37–38]。从表1可以看出, 褐土偏碱性(pH= 7.6±0.2), 而红壤与森林土呈较强的酸性, 土壤胶体表面的羟基可发生解离产生负电荷, 对阳离子具有强的吸引力, 当pH为4~6时, OTC主要以电中性的两性离子形态存在, OTC0上带正电荷的叔胺基官能团可与土壤表面的负电荷发生静电作用[13,14,20,28], 或者通过阳离子交换[14]而发生吸附作用, 从而增强红壤与森林土对OTC的吸附。红壤的CEC值为25.73 cmol/kg, 远大于森林土与褐土。研究报道土壤CEC值越高, OTC吸附量越大, 交换性盐基离子通过与羟基或者二羟基部位与土壤表面键合的阳离子发生相互作用而增强土壤对OTC的吸附[20], 因此OTC在红壤中呈现较强的吸附能力。森林土有机质含量为42.66 g/kg, 远高于褐土与红壤(分别为10.39 g/kg和13.44 g/kg), 腐殖酸分子在酸性条件下发生去质子化的位点(主要是羧基官能团)可通过静电吸引与阳离子形态或两性形态的OTC发生络合作用[17, 39, 40], 因此导致森林土强烈吸附OTC。这与MacKay.[16]报道有机质可以强烈吸附OTC, 其d值为5500 kg/L, 是土壤吸附OTC的主要成分的结果相一致。从土壤质地来看, 褐土中黏土含量大于森林土与红壤, 但是由于其pH值偏碱性, CEC值与有机质含量等偏低, 导致OTC在褐土上的吸附能力远不及森林土与红壤。而森林土较高的粗砂含量与较低的CEC值, 限制了OTC在森林土上的吸附。因此, OTC在三种土壤中的吸附能力表现出一定的差异。
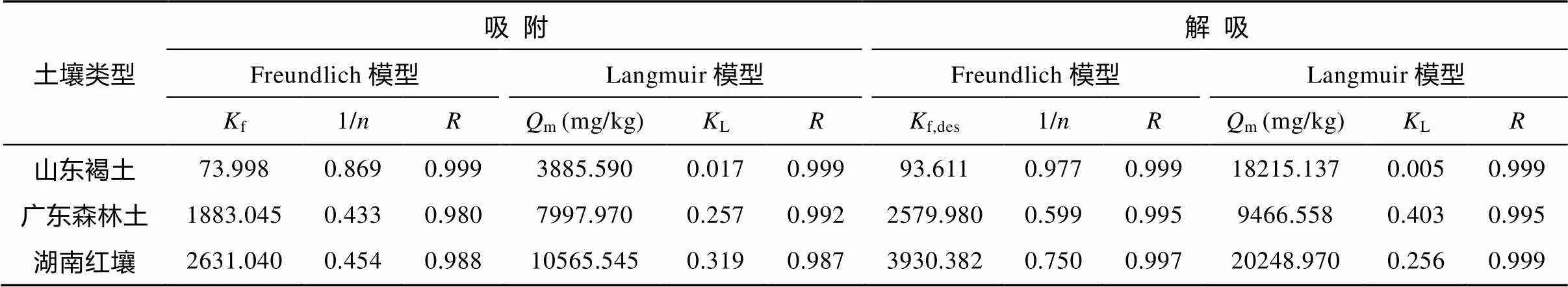
表2 OTC与土壤的吸附/解吸模型参数
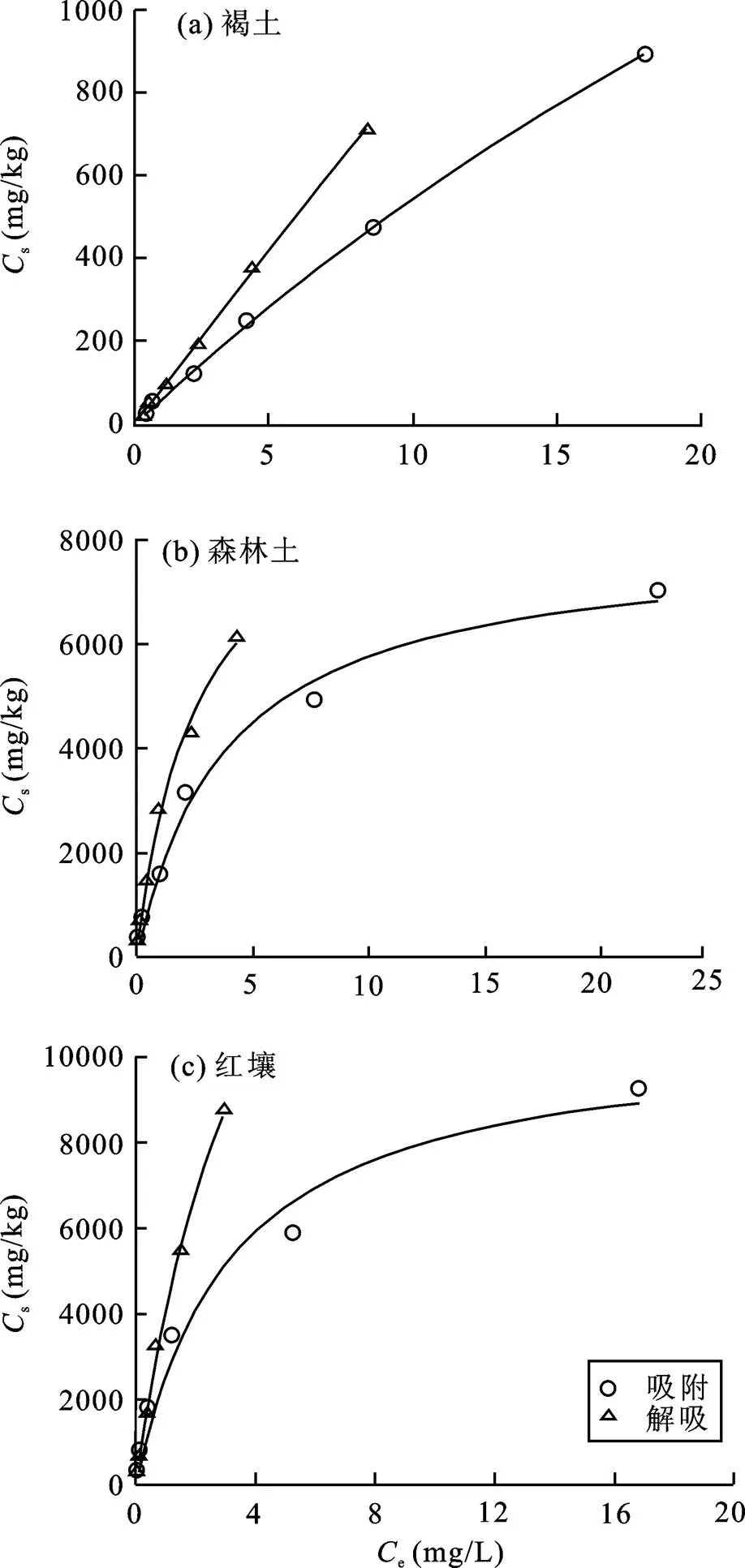
图2 Langmuir模型拟合的OTC在三种土壤中的吸附/解吸等温线
2.2 OTC在三种土壤中的解吸特性
依照Langmuir模型可以较好地拟合OTC在三种土壤中的解吸等温线,如图2中所示。拟合曲线计算得到的等温解吸方程的解吸常数见表2。从表2可以看出, Freundlich方程拟合的OTC在褐土、森林土以及红壤中解吸等温线的f,des值分别为93.611、2579.98和33930.383, 说明OTC在三种土壤的解吸能力存在明显差异。从图2可以看出, Langmuir方程拟合的OTC在褐土中的解吸等温线呈线性, 而Langmuir方程拟合的OTC在森林土或红壤中的解吸等温线呈明显的非线性。OTC在这三种土壤中的解吸行为均存在明显的滞后现象。Huang.[41]提出了滞后性指数HI (Hysteresis Index), 用来定量表示解吸滞后性的强弱, HI表达式为:

式(5)中s与d分别为单循环吸附和解吸实验中土壤的吸附量(mg/kg);和e分别表示特定的温度和平衡浓度条件。HI为0或者负值表示解吸不存在滞后性, 大于0则表示解吸存在滞后性。本研究计算了温度为25 ℃时平衡溶液中不同浓度OTC在三种土壤中对应的HI值(表3)。结果表明, 对于同一土壤, 随OTC浓度值的不同, 其HI值会发生变化。在三种土壤中, HI值随OTC浓度改变而发生变化的趋势不同。对于褐土与红壤, HI值随OTC浓度值增加而增大; 对于森林土, HI值随OTC浓度值增加而减小; 且红壤中OTC的HI值始终高于褐土。其原因是不同土壤与OTC发生吸附作用的主要成分不同。鲍艳宇等[42]报道去除有机质后的土壤对OTC的吸附量会减少, 但不易被解吸下来。森林土有机质含量为42.66 g/kg, 远高于褐土与红壤, 使得OTC与森林土发生吸附作用的主要成分不同于褐土与红壤, 因此导致迟滞系数随浓度值变化的趋势与褐土及红壤相反。此外也可能与一定量土壤对OTC的最大吸附容量的差异性有关。结合图2与表2可知, 在实验所设最大初始浓度(40 mg/L)处, OTC在褐土中的对应吸附量远小于其最大吸附容量(3885.59 mg/kg), 在红壤中的吸附量小于其对OTC的最大吸附容量(10565.55 mg/kg), 而在森林土中的吸附量(7007.47 mg/kg)接近其最大吸附容量(7997.97 mg/kg), 使得大量OTC附着于土壤颗粒表面, 导致容易被解吸下来。从表3可知, 当土壤吸附态OTC低于一定浓度时, 森林土的迟滞系数最大, 解吸能力最弱。但是当土壤吸附态OTC高于一定浓度时, OTC在红壤中迟滞系数最大, 而在森林土中迟滞系数最小。通过软件SPSS13.0比较各土壤间HI值的差异性, 结果表明褐土与红壤间HI值存在显著性差异(<0.05), 而褐土与森林土以及红壤与森林土间, HI值均不存在显著性差异(>0.1)。

表3 OTC在三种土壤中的解吸滞后指数HI
2.3 OTC在土壤中吸附后的生物活性
OTC在土壤中发生吸附作用之后, 土壤吸附态的OTC对ATCC 25922生长抑制的结果如表4所示。结果以对ATCC 25922的抑制率表示。其计算公式为:

从表4中可以看出, 土壤吸附态的OTC可以有效抑制细菌的生长, 且随土壤吸附态OTC浓度值的增加, 抑制作用增强。从褐土吸附态OTC对ATCC 25922生长抑制的结果可以看出浓度值大于120 mg/kg时, 对细菌生长产生明显的抑制作用(抑制率>50%)。这与Chander.[26]之前对四环素与泰乐菌素的研究结果相一致, 在其研究中, 高浓度(2500 mg/kg)土壤吸附态四环素显示出明显的抗菌活性。不同土壤间, 吸附态OTC抗菌活性存在一定差异, 这主要是由于土壤间的吸附/解吸行为差异所致。一般说来, 抗生素越易被解吸, 其对应吸附态抗生素的生物活性越强。因此, 被土壤紧密结合的抗生素不易释放至微生物导致其生物活性减弱[26]。总的说来, 土壤吸附态抗生素的生物活性与影响抗生素在土壤中发生吸附/解吸行为的因素密切相关。Thiele-Bruhn[43]也报道了类似的研究结果, 发现土壤的吸附性质控制抗生素的活性, 尤其是土壤有机质的含量, 土壤pH值影响抗生素的电离而间接影响抗生素对微生物的抑制作用。
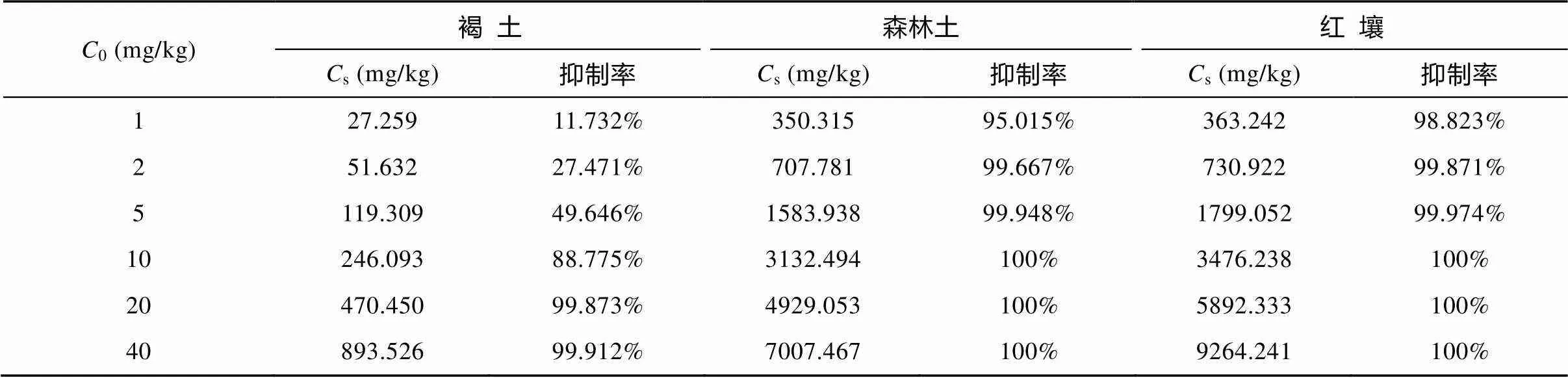
表4 土壤吸附态OTC对E.coli ATCC 25922的抗菌活性
3 结 论
(1) OTC在褐土、红壤以及森林土中的吸附/解吸均可用Freundlich方程及Langmuir方程进行良好地拟合, 且Langmuir方程的拟合结果较优。OTC在土壤中的吸附/解吸行为随土壤理化性质(土壤pH值、CEC值以及有机质含量)的不同存在差异。pH值呈碱性时, 减弱土壤对OTC的吸附能力。阳离子交换以及络合作用是OTC吸附于土壤的主要机制。
(2) OTC在褐土中的吸附/解吸行为与森林土及红壤存在显著性差异(0.05), 在红壤中的吸附能力最强, 森林土次之, 褐土最弱。OTC在各土壤中的解吸行为均存在明显的滞后现象, 且这种滞后性与土壤的理化性质密切相关。
(3) OTC被土壤吸附后对ATCC 25922依然具有生物活性, 且与影响抗生素在土壤中发生吸附/解吸行为的因素密切相关。
[1] Kümmerer K. Antibiotics in the aquatic environment – A review – Part I[J]. Chemosphere, 2009, 75(4): 417–434.
[2] Luo Y, Mao D, Rysz M, Zhou Q, Zhang H, Xu L, Alvarez P. Trends in antibiotic resistance genes occurrence in the Haihe River, China[J]. Environ Sci Technol, 2010, 44(19): 7220– 7225.
[3] Kulshrestha P, Giese R F, Aga D S. Investigating the molecular interactions of oxytetracycline in clay and organic matter: insights on factors affecting its mobility in soil[J]. Environ Sci Technol, 2004, 38(15): 4097–4105.
[4] Xu X R, Li X Y. Sorption and desorption of antibiotic tetracycline on marine sediments[J]. Chemosphere, 2010, 78(4): 430–436.
[5] Sapkota A R, Curriero F C, Gibson K E, Schwab K J. Antibiotic-resistant enterococci and fecal indicators in surface water and groundwater impacted by a concentrated swine feeding operation[J]. Environ Health Perspect, 2007, 115(7): 1040–1045.
[6] Chen Y S, Zhang H B, Luo Y M, Song J. Occurrence and assessment of veterinary antibiotics in swine manures: A case study in East China[J]. Chinese Sci Bull, 2012, 57(6): 606–614.
[7] Chen F, Ying G G, Kong L X, Wang L, Zhao J L, Zhou L J, Zhang L J. Distribution and accumulation of endocrine- disrupting chemicals and pharmaceuticals in wastewater irrigated soils in Hebei, China[J]. Environ Pollut, 2011, 159(6): 1490–1498.
[8] Karcı A, Balcıoğlu I A. Investigation of the tetracycline, sulfonamide, and fluoroquinolone antimicrobial compounds in animal manure and agricultural soils in Turkey[J]. Sci Total Environ, 2009, 407(16): 4652–4664.
[9] Kotzerke A, Hammesfahr U, Kleineidam K, Lamshöft M, Thiele-Bruhn S, Schloter M, Wilke B M. Influence of difloxacin-contaminated manure on microbial community structure and function in soils [J]. Biol Fertil Soils, 2011, 47(2): 177–186.
[10] Liu F, Ying G G, Tao R, Zhao J L, Yang J F, Zhao L F. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities[J]. Environ Pollut, 2009, 157(5): 1636–1642.
[11] Heuer H, Kopmann C, Binh C T, Top E M, Smalla K. Spreading antibiotic resistance through spread manure: Characteristics of a novel plasmid type with low %G+C content[J].Environ Microbiol, 2009, 11(4): 937–949.
[12] Figueroa R A, MacKay A A. Sorption of oxytetracycline to iron oxides and iron oxide-rich soils[J]. Environ Sci Technol, 2005, 39(17): 6664–6671.
[13] Aristilde L, Marichal C, Miéhé-Brendlé J, Lanson B, Charlet L. Interactions of oxytetracycline with a smectite clay: A spectroscopic study with molecular simulations[J]. Environ Sci Technol, 2010, 44(20): 7839–7845.
[14] Figueroa R A, Leonard A, MacKay A A. Modeling tetracycline antibiotic sorption to clays[J]. Environ Sci Technol, 2004, 38(2): 476–483.
[15] Rubert K F, Pedersen J A. Kinetics of oxytetracycline reaction with a hydrous manganese oxide[J]. Environ Sci Technol, 2006, 40(23): 7216–7221.
[16] MacKay A A, Canterbury B. Oxytetracycline sorption to organic matter by metal-bridging[J]. J Environ Qual, 2005, 34(6): 1964–1971.
[17] Gu C, Karthikeyan K, Sibley S D, Pedersen J A. Complexation of the antibiotic tetracycline with humic acid[J]. Chemosphere, 2007, 66(8): 1494–1501.
[18] Laak T L, Gebbink W A, Tolls J. The effect of pH and ionic strength on the sorption of sulfachloropyridazine, tylosin, and oxytetracycline to soil[J]. Environ Toxicol Chem, 2006, 25(4): 904–911.
[19] Zhao Y P, Gu X Y, Geng J J, Gao S X, Wang X R. Tetracycline adsorption on kaolinite: pH, metal cations and humic acid effects[J]. Ecotoxicology, 2011, 20(5): 1141–1147.
[20] Laak T L, Gebbink W A. Estimation of soil sorption coefficients of veterinary pharmaceuticals from soil properties[J]. Environ Toxicol Chem, 2006, 25(4): 933–941.
[21] Chefetz B, Xing B. Relative role of aliphatic and aromatic moieties as sorption domains for organic compounds: A review[J]. Environ Sci Technol, 2009, 43(6): 1680–1688.
[22] Luczkiewicz A, Fudala-Ksiazek S, Jankowska K, Quant B, Olanczuk-Neyman K. Diversity of fecal coliforms and their antimicrobial resistance patterns in wastewater treatment model plant[J]. Water Sci Technol, 2010, 61(6): 1383–1392.
[23] Hölzel C, Harms K, Küchenhoff H, Kunz A, Müller C, Meyer K, Schwaiger K, Bauer J. Phenotypic and genotypic bacterial antimicrobial resistance in liquid pig manure is variously associated with contents of tetracyclines and sulfonamides[J]. J Appl Microbiol, 2010, 108(5): 1642–1656.
[24] Kong W D, Zhu Y G, Fu B J, Marschner P, He J Z. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community[J]. Environ Pollut, 2006, 143(1): 129–137.
[25] Kong W D, Zhu Y G, Liang Y C, Zhang J, Smith F A, Yang M. Uptake of oxytetracycline and its phytotoxicity to alfalfa (.)[J]. Environ Pollut, 2007, 147(1): 187–193.
[26] Chander Y, Kumar K, Goyal S M, Gupta S C. Antibacterial activity of soil-bound antibiotics[J]. J Environ Qual, 2005, 34(6): 1952–1957.
[27] Subbiah M, Mitchell S M, Ullman J L, Call D R. β-lactams and florfenicol antibiotics remain bioactive in soils while ciprofloxacin, neomycin, and tetracycline are neutralized[J]. Appl Environ Microbiol, 2011, 77(20): 7255–7260.
[28] Goetsch H E, Mylon S E, Butler S, Zilles J L, Nguyen T H. Oxytetracycline interactions at the soil-water interface: Effects of environmental surfaces on natural transformation and growth inhibition of Azotobacter vinelandii[J]. Environ Toxicol Chem, 2012, 31(10): 2217–2224.
[29] Figueroa-Diva R A, Vasudevan D, MacKay A A. Trends in soil sorption coefficients within common antimicrobial families[J]. Chemosphere, 2010, 79(8): 786–793.
[30] Jones A D, Bruland G L, Agrawal S G, Vasudevan D. Factors influencing the sorption of oxytetracycline to soils[J]. Environ Toxicol Chem, 2005, 24(4): 761–770.
[31] Kim Y, Lim S, Han M, Cho J. Sorption characteristics of oxytetracycline, amoxicillin, and sulfathiazole in two different soil types[J]. Geoderma, 2012, 185–186: 97–101.
[32] OECD. OECD Guidelines for Testing of Chemicals, Test Guideline 106: Adsorption/Desorption Using A Batch Equilibrium Method[M]. Paris: Revised Draft Document OECD, 2000: 1–45.
[33] Sassman S A. Lee L S. Sorption of three tetracyclines by several soils: Assessing the role of pH and cation exchange[J]. Environ Sci Technol, 2005, 39(19): 7452–7459.
[34] 鲍艳宇, 周启星, 张浩. 阳离子类型对土霉素在2种土壤中吸附-解吸影响[J]. 环境科学, 2009, 30(2): 551–556. Bao Yan-yu, Zhou Qi-xing, Zhang Hao. Influences of cation species on adsorption and desorption of oxytetracycline in two typical soils of China[J]. Environ Sci, 2009, 30(2): 551–556 (in Chinese with English abstract).
[35] 齐瑞环, 李兆君, 龙健, 范菲菲, 梁永超. 土壤粉碎粒径对土霉素在土壤中吸附的影响[J]. 环境科学, 2011, 32(2): 589–595. Qi Rui-huan, Li Zhao-jun, Long Jian, Fan Fei-fei, Liang Yong-chao. Effects of soil trituration size on adsorption of oxytetracyclineon soils[J]. Environ Sci, 2011, 32(2): 589–595 (in Chinese with English abstract).
[36] Carter M C, Kilduff J E, Weber W J. Site energy distribution analysis of preloaded adsorbents[J]. Environ Sci Technol, 1995, 29(7): 1773–1780.
[37] Aboul-Kassim T A, Simoneit B R T. The Handbook of Environmental Chemistry Vol. 5 Part E, Pollutant-Solid Phase Interactions: Mechanism, Chemistry and Modeling[M]. Berlin Heidelberg: Springer-Verlag, 2001: 107–167.
[38] 张劲强, 董元华, 安琼, 刘新程. 兽药抗生素在土壤环境中的行为[J]. 土壤, 2005, 37(4): 353–361. Zhang Jin-qiang, Dong Yuan-huan, An Qiong, Liu Xin-cheng. Veterinary antibiotics behavior in the soil environment[J]. Soil, 2005, 37(4): 353–361 (in Chinese with English abstract).
[39] Pils J R, Laird D A. Sorption of tetracycline and chlortetracycline on K- and Ca-saturated soil clays, humic substances, and clay-humic complexes[J]. Environ Sci Technol, 2007, 41(6): 1928–1933.
[40] Zhao Y P, Gu X Y, Gao S X, Geng J J, Wang X R. Adsorption of tetracycline (TC) onto montmorillonite: Cations and humic acid effects[J]. Geoderma, 2012, 183–184: 12–18.
[41] Huang W, Yu H, Weber Jr W J. Hysteresis in the sorption and desorption of hydrophobic organic contaminants by soils and sediments: 1. A comparative analysis of experimental protocols[J]. J Contam Hydrol, 1998, 31(1/2): 129–148.
[42] 鲍艳宇, 周启星, 万莹, 谢秀杰. 土壤有机质对土霉素在土壤中吸附-解吸的影响[J]. 中国环境科学, 2009, 29(6): 651– 655.Bao Yan-yu, Zhou Qi-xing, Wan Ying, Xie Xiu-jie. Effect ofsoil organic matter on adsorption and desorption of oxytetracycline in soils[J]. China Environ Sci, 2009, 29(6): 651–655 (in Chinese with English abstract).
[43] Thiele-Bruhn S. Microbial inhibition by pharmaceutical antibiotics in different soils Dose-response relations determined with the iron (III) reduction test[J]. Environ Toxicol Chem, 2005, 24(4): 869–876.
Adsorption and desorption of oxytetracycline on typical soils and soil-adsorbed oxytetracycline’s bioavailability
PENG Feng-jiao, YING Guang-guo*, ZHOU Li-jun, LIU You-sheng, PAN Chang-gui and LIANG Yan-qiu
(State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China)
This study investigated the adsorption and desorption of OTC in three different soils by using batch equilibrium tests, and assessed the biological activity of soil-adsorbed OTC by usingATCC 25922 as the experimental strain. The results showed that the data of adsorption and desorption for OTC on all soils were well fitted with both Freundlich and Langmuir models. Both adsorption and desorption isotherms of OTC on the Cinnamon soil were linear, while those for the Forest soil and Red soil were nonlinear. The Langmuir model gave better fitting than Freundlich model for all three soils. An adsorption-desorption hysteresis phenomenon was observed in all the three soils. The bioavailability experiments withshowed that the adsorbed OTC was still active against bacteria.
oxytetracycline (OTC); soil; adsorption; desorption; bioavailability
P593
A
0379-1726(2015)01-0071-08
2013-11-30;
2014-03-02;
2014-03-27
中国科学院重要方向创新项目(KZCX2-EW-108); 环保公益项目(201309031)
彭凤姣(1987–), 女, 硕士研究生, 研究方向为环境化学与环境微生物学。E-mail: pengfengjiao@163.com
YING Guang-guo, E-mail: guang-guo.ying@gig.ac.cn; Tel: +86-20-85290200
