广东省不同区域菜园土壤微生物群落功能多样性比较
2015-06-23赵兰凤刘小锋官利兰张新明
赵兰凤,刘小锋,官利兰,程 根,张新明
(华南农业大学资源环境学院,广东广州510642)
广东省不同区域菜园土壤微生物群落功能多样性比较
赵兰凤,刘小锋,官利兰,程 根,张新明
(华南农业大学资源环境学院,广东广州510642)
【目的】了解广东省不同区域菜园土壤微生物碳代谢功能群落结构的特点与差异.【方法】采用Biolog生态微平板方法分析广东的粤北、粤东、粤西和粤中4个不同区域菜园土壤微生物碳代谢群落结构.【结果和结论】4个不同区域的土壤微生物平均颜色变化率(AWCD)、Shannon指数、Simpson指数、McIntosh指数变化趋势均不同,反映微生物活性的AWCD表现为:粤北>粤东>粤西>粤中,表明不同区域菜园土壤微生物在碳源利用能力、微生物丰度等方面存在差异.4个区域土壤微生物对6类31种碳源的利用程度存在差异;主成分分析显示,4个区域土壤微生物代谢基质主成分1的贡献率为54.76%,主成分2为13.25%;主成分1载荷0.18以上的基质有22种,主成分2有15种;碳源在主成分分离中起主要贡献作用的是氨基酸类、羧酸类、酚类和碳水化合物类碳源.表明不同区域菜园土壤微生物群落碳源利用模式及代谢功能不同,即土壤微生物群落功能多样性有差异.
菜园土壤;微生物群落;功能多样性;Biolog法
生物多样性及其变化是全球变化研究的重要内容之一.人为活动已经使生物多样性大幅度下降,引起了人们的高度重视.土壤微生物是土壤有机质和养分转化、循环的动力,它们参与土壤有机质分解、腐殖质形成、土壤养分转化和循环等过程.土壤微生物群落的组成与活性不仅在很大程度上决定了生物地球化学循环、土壤有机质的周转及土壤肥力和质量,也与植物的生产力有关[1].土壤微生物多样性研究主要包括遗传多样性、结构多样性和功能多样性,其中功能多样性是指微生物群落利用碳源的模式或作用的过程[2].Biolog分析被用作表征微生物群落的功能潜力,即被用于估计碳源利用模式等功能多样性[3].研究土壤微生物多样性可了解土壤微生物和土壤质量因环境条件的改变及人类对土壤的利用而发生的变化,为农业的可持续发展研究和生态环境的保护提供依据.Biolog生态微平板法是快速简便分析微生物群落功能多样性的方法[4-6],本研究利用Biolog微平板鉴定系统对广东省有代表性的4个区域的菜园土壤微生物碳代谢功能群落结构进行分析,研究不同区域土壤微生物群落功能多样性差异及其对碳源特异利用的情况.
1 材料与方法
1.1 材料
根据广东省不同地区温湿度条件和施肥管理情况不同,选择了粤东(梅州五华)、粤北(清远连州)、粤西(云浮罗定)和粤中(广州增城)4个区域,分别在上述4个典型县(市)采集3年以上连续种植蔬菜的菜地土壤样品,每个典型县(市)取0~20 cm土层的混合土样5个.种植蔬菜品种较多,主要有生菜、芥菜、油麦菜、青菜、藤菜、豆角、苦瓜、茄子等.复种指数高,1年3茬的种植模式占42%.经问卷调查,每年按666.7 m2施化肥氮(N)、磷(P2O5)、钾(K2O)分别为29.60、30.44、29.41 kg;有机肥氮、磷、钾均值与化肥氮、磷、钾均值之比分别为 0.38、0.22和0.21;总施肥量氮、磷、钾平均达到40.75、37.10和35.72 kg.不同地区养分投入量存在较大差异,云浮和梅州的有机养分投入量略高于清远、增城;化肥和总养分投入量均为:粤中>粤西>粤东>粤北.表1列出了4个典型区域土壤的主要理化性质.
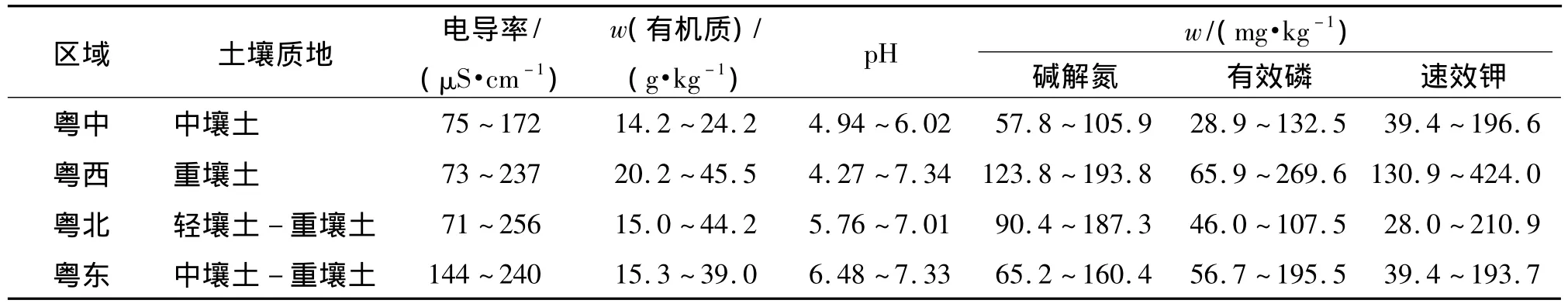
表1 供试土壤基本理化性质Tab.1 Basic physicochem ical properties of parent soils
1.2 方法
土壤细菌功能多样性分析采用Biolog Eco微平板法,具体操作以及多样性指数计算参见文献[3-4].选取培养时间为72 h的D590nm计算微生物群落功能多样性指数、微生物利用碳源底物能力和碳源相对利用率,并进行微生物群落功能主成分分析.采用Excel2003和DPS 14.10[7]统计软件处理数据.
2 结果与分析
2.1 不同区域菜园土壤平均颜色变化率和多样性指数比较
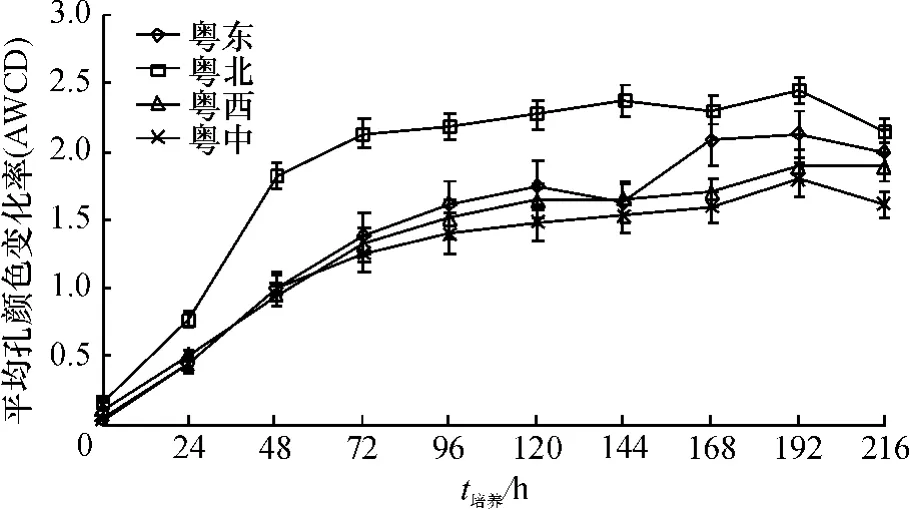
图1 不同区域菜园土细菌群落AWCD的变化Fig.1 Variations in AWCD of vegetable garden soil bacterial community over time in different regions
4个不同区域菜园土壤微生物平均颜色变化率(AWCD)随培养时间的变化情况见图1.由图1可以看出,不同区域的AWCD值在24 h内升高幅度非常大,说明此时碳源开始被利用,且已经进入指数期,144 h左右达到平稳状态.不同区域土壤微生物AWCD值的变化速率和最终值以粤北最高,粤东次之,粤西和粤中微生物活性最低.4个区域土壤微生物AWCD值变化趋势不同,表明了各个区域土壤微生物在碳源利用能力、微生物丰度等方面存在差异,粤北地区土壤微生物群落的代谢最快、活性最强,粤中地区土壤微生物群落代谢相对较慢、活性较弱,可能与温湿条件、施肥和管理等因素有关,微生物活性受温度和水分的影响,粤北地区由于昼夜温差较大、降雨量充沛,为土壤微生物群落提供了良好的生态环境.另外,微生物受土壤环境条件的限制,长期使用化肥严重影响土壤微生物活性,据调查,粤西和粤中地区化肥投入量显著高于粤东和粤北地区,因此,明显抑制了微生物的活性.
Shannon指数、Simpson指数和McIntosh指数的分析结果(表2)表明,粤北地区的土壤微生物AWCD值和Shannon指数显著高于其他3个区域,粤中地区的Simpson指数显著低于其他3个区域,粤北地区的McIntosh指数显著高于粤西地区和粤中地区,与粤东地区差异不显著.4个区域的代谢多样性方差分析表明,粤北地区的微生物活性、物种丰富度、优势度和均匀度均最高,粤东地区次之,粤中地区的微生物活性最低,表明不同区域菜园土壤微生物对碳源利用有显著性差异,说明不同区域菜园土壤由于温湿条件和施肥管理等不同其均匀度与群落丰富度、物种优势度之间有着不一致的现象.

表2 不同区域菜园土微生物群落功能AWCD值和多样性指数比较1)Tab.2 AWCD and diversity indexes of vegetable garden soilm icrobial community in different regions
2.2 不同区域菜园土壤微生物碳源利用能力
Biolog Eco微平板上含有31种碳源,根据碳源官能团不同将其分为6类,其中,聚合物类4种,碳水化合物类10种,羧酸类7种,氨基酸类6种,胺类2种,酚类2种.4个区域土壤微生物群落对6类碳源的相对利用率见图2.由图2可以看出,菜园土壤微生物在碳源代谢方面优势群落依次为氨基酸类代谢群落、胺类代谢群落、羧酸类代谢群落,对氨基酸类的利用程度较高,对聚合物类的利用程度较低.4个不同区域菜园土壤微生物对6类碳源的利用程度存在差异,同一区域对不同碳源的利用程度也有差异,如:粤东地区土壤微生物对羧酸类的利用程度最高,相对利用率为20.1%,酚类最低,为13.2%;粤中地区土壤微生物对氨基酸类的利用程度最高,相对利用率为20.6%,对碳水化合物类利用最低,为12.4%.
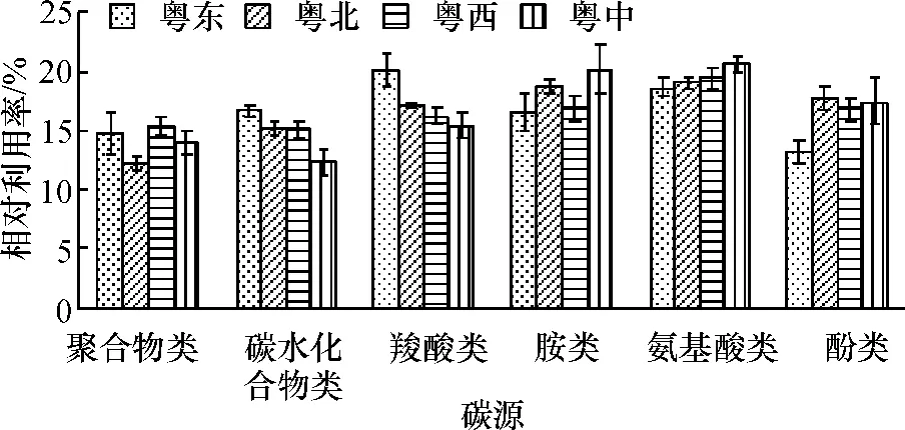
图2 不同区域菜园土壤微生物群落对Biolog生态微平板中6类碳源的相对利用率Fig.2 Relative utilization ratios of6 groups of carbon sources in Biolog-Eco-plate by vegetable garden soilmicrobes in different regions
不同区域对同一碳源的利用情况存在差异(表3),粤北地区菜园土壤微生物对6类碳源的利用能力均高于其他3个区域,且对羧酸类、氨基酸类和酚类的利用能力显著高于其他3个区域.不同区域对同一碳源利用程度的差异表明不同区域优势群落不同,这是由于各区域温湿条件和施肥制度不同,导致优势群落有所不同,因此,各区域土壤微生物功能多样性也不同.

表3 菜园土微生物利用碳源底物能力比较1)Tab.3 Comparison of carbon substrate utilization by vegetable garden soilm icrobial community in different regions
2.3 不同区域菜园土壤微生物群落功能主成分分析
由于土壤微生物群落代谢功能与环境因子有关,可将PCA分析后的主成分纳入到与环境因子(温湿条件和施肥管理制度)的相关分析中,其各自的载荷不同代表了各个区域菜园土微生物碳代谢的差异.前11个主成分占总变异的100%,包含了全部的变异信息.根据提取的主成分个数一般要求累计方差贡献率达到85% 的原则[8],共提取了5个主成分,累计贡献率达88.20%.其中第1主成分(PC1)的方差贡献率为54.76%,第2主成分(PC2)为13.25%.第3~5主成分贡献率均较小,分别为8.38%、8.00%和3.81%.选取前2个主成分进行分析,以PC1为横轴、PC2为纵轴,得到不同处理土壤微生物碳源利用的主成分分析图(图3).由图3可以看出,4个不同区域的土壤微生物在PC1轴和PC2轴上的得分系数有很好的分离,粤北地区在PC1轴上与其他3个区域的类群散点距离较大,粤中地区在PC2轴上与粤东地区和粤西地区差异较大,表明不同区域土壤微生物在碳源利用模式上有明显差异;粤东和粤西2个区域土壤微生物群落具有相似的碳源利用模式,土壤微生物群落代谢功能相似.Garland[6]认为,各样本在空间位置上的不同是和碳源底物的利用能力相关联的,即各样本在PC空间轴坐标的差异与聚集在该PC轴上碳源的利用能力相关联.
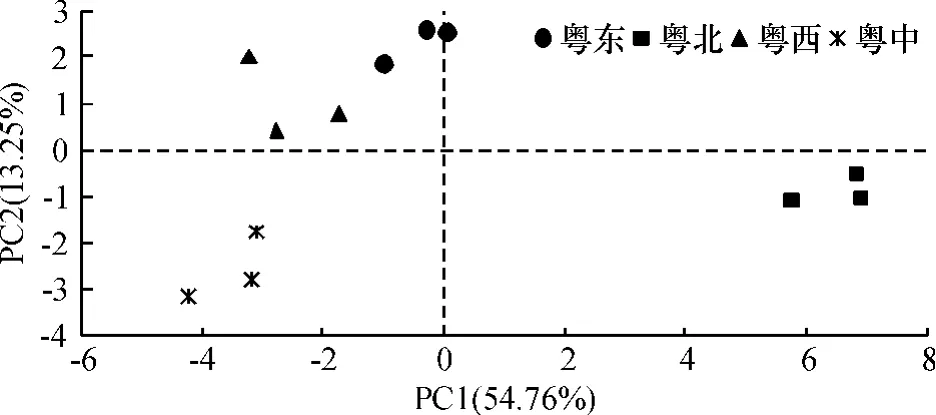
图3 不同区域菜园土微生物功能多样性主成分分析Fig.3 Principal component analysis of vegetable garden soilmicrobial community in different regions
Choi等[5]认为,主成分1和主成分2上大于0.18或小于-0.18的载荷系数可认为具有较高的载荷量.主成分分析中的载荷因子可反映不同区域菜园土壤微生物碳代谢的差异,绝对值越大表明该基质的影响越大.由表4可以看出,4个不同区域土壤微生物代谢基质主成分1载荷0.18以上的基质有22种(其中碳水化合物类7种、氨基酸6种、聚合物类4种、羧酸类3种、酚类2种);主成分2荷载0.18以上的基质有15种(其中碳水化合物类和氨基酸类各5种、羧酸类3种、酚类和胺类各1种).将每个主成分得分系数与6类碳源D590nm进行相关分析显示,6类碳源D590nm值与第1主成分得分系数均存在显著的正相关性(P<0.05),与除聚合物外的其他5类碳源存在极显著正相关(P<0.01),但与第2主成分无显著相关性.说明4个不同区域土壤微生物碳代谢功能群落结构的差异主要体现在主成分1载荷因子高的碳源上.可见,在主成分分离中起主要作用的是氨基酸类、羧酸类、酚类和碳水化合物类碳源.上述结果表明,各区域土壤微生物在利用碳源的类型上是存在差异的,对碳源的利用有利于土壤微生物种群数量的提升,不同的碳源因子对土壤微生物群落功能的影响有显著差异,这是因为不同温湿条件、管理方式和施肥制度的土壤中存在的碳源因子质与量是不同的[9-11].
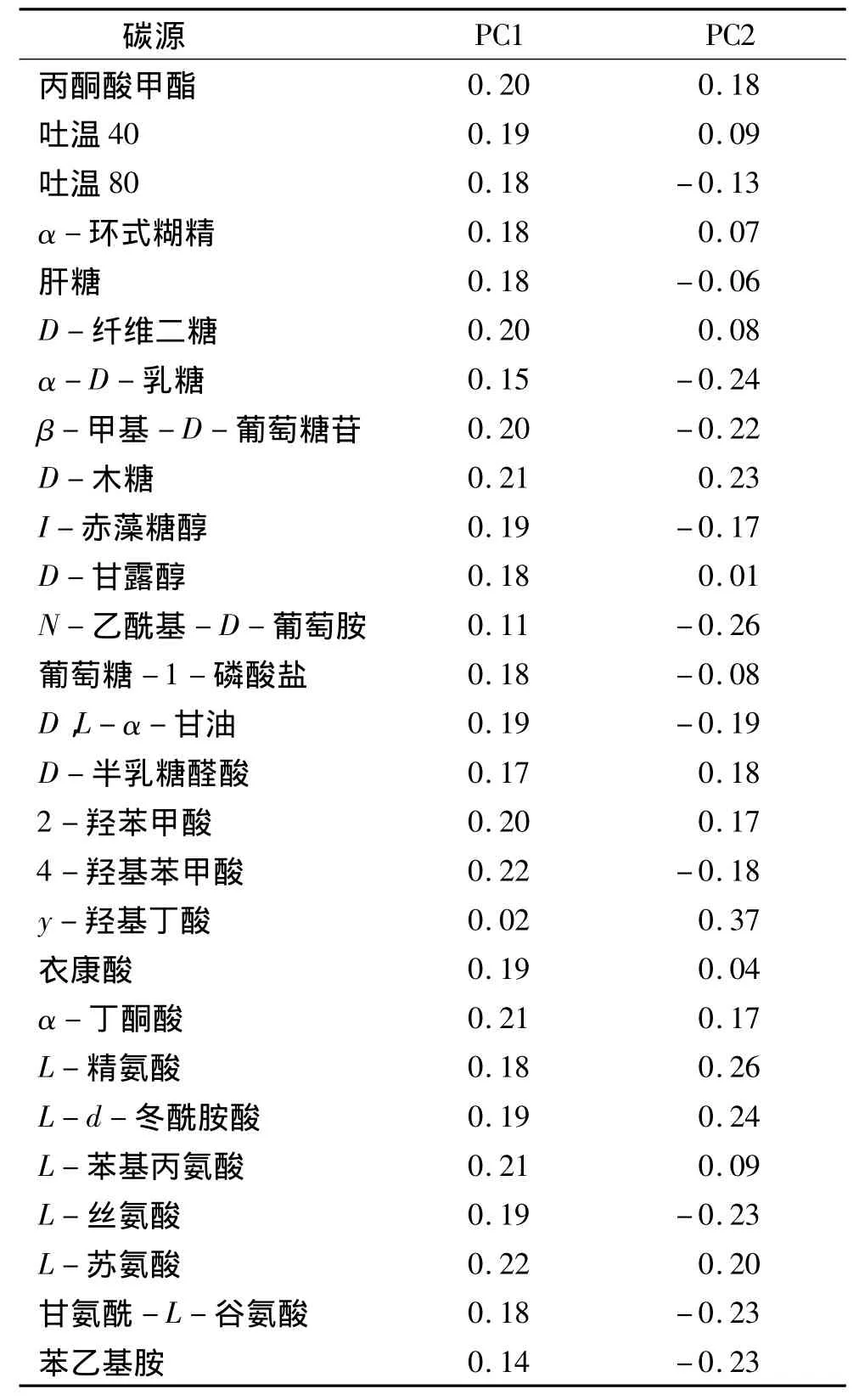
表4 对主成分贡献大于0.18或小于-0.18的主要碳源Tab.4 M ain carbon sources on the contribution of principal com ponents
3 讨论与结论
AWCD能够反映土壤微生物的代谢活性,是土壤微生物群落利用单一碳源能力的重要指标[12].微生物对每种碳源的利用能力不同,导致微孔板上氧化剂颜色变化深浅不一,通过AWCD反映了土壤微生物利用碳源的能力和代谢活性大小,其值越高,土壤中微生物群落代谢活性也就越高[13-14].粤北地区的土壤微生物AWCD显著高于其他3个区域,表明粤东、粤西、粤北和粤中4个不同地区的土壤微生物碳源利用能力差异很大,粤北地区的气候条件及施肥管理更适合微生物生长繁殖,使微生物群落代谢活性增加.其原因可能是微生物群落功能多样性受气候及施肥管理影响,因为粤北地区昼夜温差较大和降雨量充沛,施肥总量和化肥施用量显著低于其他3个区域,造成底物供给差异,使微生物群落活性和功能不同,影响土壤中一些微生物群落的生长繁殖和生理机能[15-17],通过改变土壤微生物群落结构来提高土壤微生物群落代谢功能.Dilly等[18]的研究也表明在年均温和降雨量有差异的德国南、北、中部的秸秆腐解微生物群落表现出不同.
微生物群落在土壤中处于一个动态平衡,影响土壤的理化因子都会干扰土壤微生物群落的平衡从而影响土壤微生物的活性及其生态功能,进而影响土壤环境质量.多样性指数分析结果表明,粤北地区土壤微生物多样性指数均高于其他3个区域,Shannon指数显著高于其他3个区域,表明粤北地区的土壤微生物群落的物种丰富度优于其他3个区域;粤中地区的Simpson指数显著低于其他3个区域,说明粤中地区的土壤微生物群落的物种优势度最差,这可能与化肥施用量较大有关.由于微生物利用高C/N碳源,故其生长受氮素限制.
土壤微生物多样性反映了群落总体变化,但不能反映微生物群落代谢的详细信息,研究微生物对不同碳源利用能力的差异,有助于更加全面地了解微生物群落代谢功能特性[19].对不同处理的Biolog Eco微平板上的6大类碳源利用能力分析可知,粤北地区的土壤微生物对酚类、羧酸类和氨基酸类的利用能力显著高于其他3个区域,说明不同地区土壤微生物的碳源利用能力差异较大,粤北地区的土壤微生物对碳源的利用能力较强,增强了土壤微生物群落代谢功能,这与AWCD和多样性指数的分析结果相一致.主成分分析结果表明,不同区域土壤微生物群落对碳源的代谢特征产生明显变异.
[1] ZELLES L.Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation ofmicrobial communities in soil:A review[J].Biol Fert Soils,1999,29: 111-129.
[2] 李玉新,赵忠,陈金良.沙棘林土壤微生物多样性研究[J].西北农林科技大学学报,2010,38(8):67-74.
[3] GARLAND JL,MILLSA L.Classification and characterization of heterotrophicmicrobial communities on the basis of patterns of community-level sole-carbon-source utilization[J].Appl Environ Microbiol,1991,57:2351-2359.
[4] JEFFREY S B,DONALD D K.Microbial diversity in the rhizosphere of corn grown under conventional and low input systems[J].Appl Soil Ecol,1996,5:21-27.
[5] CHOIK H,DOBBSFC.Comparison of two kinds of Biolog microplates(GN and ECO)in their ablility to distinguish among aquatic microbial communities[J].J Microbiol Methods,1999,36(3):203-213.
[6] GARLAND JL.AnaIysis and interpretation of communitylevel physiological profiles inmicrobial ecology[J].FEMS Microbiol Ecol,1997,24(4):289-300.
[7] TANGQ Y,ZHANG CX.Data processing system(DPS) software with experimental design,statistical analysis and data mining developed for use in entomological research[J].Insect Sci,2013,20(2):254-260.
[8] HAO L R,FAN Y,HAO Z O,et al.Pragmatic statistic analysis of SPSS[M].Beijing:ChinaWater Power Press,2002.
[9] 陈皓文.张家界、韶山和衡山空气微生物粒子沉降量分析[J].国土与自然资源研究,2003(2):54-56.
[10]杨靖,潘立勇,韩炜.空气微生物不同高度分布情况研究[J].环境科技,2009,22(6):50-53.
[11]方治国,欧阳志云,胡利锋,等.室外空气细菌群落特征研究进展[J].应用与环境生物学报,2005,11(1): 123-128.
[12]ZABINSKICA,GANNON JE.Effects of recreational impacts on soil microbial communities[J].Environ Manage,1997,21(2):233-238.
[13]KONOPKA A,OLIVER L,TURCO R F.The use of carbon substrate utilization patterns in environmental and ecologicalmicrobiology[J].Microbiol Ecol,1998,35(2): 103-115.
[14]GARLAND JL.Analysis and interpretation of communitylevel physiological profiles in microbial ecology[J].FEMSMicrobial Ecol,1997,24(4):289-300.
[15]AVRAHAMIS,LIESACKW,CONRAD R.Effects of temperature and fertilizer on activity and community structure of soil ammonia oxidizers[J].Environ Microbiol,2003,5(8):691-705
[16]TIAN G,BADEJO M,OKOH A,et al.Effects of residue quality and climate on plant residue decomposition and nutrient release along the transect from humid forest to Sahel of West Africa[J].Biogeochem,2007,86(2):217-229.
[17]THOMSEN I K,SCHJNNING P,JENSEN B,et al.Turnover of organicmatter in differently textured soils:II:Microbial activity as influenced by soil water regimes[J].Geoderma,1999,89(3/4):199-218.
[18]DILLY O,BLOEM J,VOS A,et al.Bacterial diversity in agricultural soils during litter decomposition[J].Appl Environ Microbiol,2004,70(1):468-474.
[19]LACOMBE S,BRADLEY R L,HAMEL C,et al.Do treebased Intercropping systems increase the diversity and stability of soilmicrobial communities[J].Agric,Ecosystems Environ,2009,131(1/2):25-31.
【责任编辑 周志红
】
An com parative study on functional diversity of soilm icrobial community in vegetable garden soils from different regions of Guangdong Province
ZHAO Lanfeng,LIU Xiaofeng,GUAN Lilan,CHENG Gen,ZHANG Xinming
(College of Natural Resources and Environment,South China Agricultural University,Guangzhou 510642,China)
【Objective】To understand the characteristics and differences among the carbon catabolic diversities of vegetable garden soilmicrobes from the different regions of Guangdong Province.【Method】The community structures of vegetable garden soilmicrobes in the northern,eastern,western and central regions of Guangdong Province(NR,ER,WR and CR)were analyzed using the Biolog Eco-Plate Method.【Result and conclusion】Therewere different changing tendencies of the AverageWell Color Development (AWCD),Shannon Index,Simpson Index and McIntosh Index in the four regions.The AWCD value,which directly reflected themicrobial activities,was in the order of NR>ER>WR>CR,demonstrating the differences among the uses of carbon sources and abundance in vegetable garden soilmicrobes from the different regions.Therewere differences among utilization degrees of the 31 types,6 classes of carbon sources by the vegetable garden soilmicrobes from the four regions.Through principal component analysis,it showed that the contribution rate of the PC1 of themetabolism substrates of vegetable garden soil microbes in the four regions was 54.76%,PC2 was 13.25%,and there were 22 types ofmetabolism substrates in PC1 with over 0.18 of load,but only 15 types in PC2.Amino acids,carboxylic acids,phenols and carbohydrateswere the fourmain carbon sources separating the two principal component factors.In conclusion,the carbon source utilization modes and metabolic functions of the microbes among the vegetable garden soils from the four regions differ from each other,that is,there are different functional diversities ofmicrobial community among the vegetable garden soils from the four regions under investigation.
vegetable garden soil;microbial community;functional diversity;Biologmethod
S154.3
A
1001-411X(2015)01-0054-06
赵兰凤,刘小锋,官利兰,等.广东省不同区域菜园土壤微生物群落功能多样性比较[J].华南农业大学学报,2015,36(1):54-59.
2014-01-26 优先出版时间:2014-12-02
优先出版网址:http://www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2015.01.010.html
赵兰凤(1978—),女,高级实验师,硕士,E-mail:lanfengzhao@scau.edu.cn;通信作者:张新明(1965—),男,副教授,博士,E-mail:xmzhang@scau.edu.cn
广东省科技计划项目(2012A020100004)
