恶性梗阻性黄疸PTBD对免疫功能影响的前瞻性对照研究
2015-06-21北京市垂杨柳医院放射科北京100022
1.北京市垂杨柳医院放射科 (北京 100022)
2.首都医科大学附属北京朝阳医院放射科 (北京 100020)
张东坡1李建军1戴定可2于 平2翟仁友2
·腹部疾病·
恶性梗阻性黄疸PTBD对免疫功能影响的前瞻性对照研究
1.北京市垂杨柳医院放射科 (北京 100022)
2.首都医科大学附属北京朝阳医院放射科 (北京 100020)
张东坡1李建军1戴定可2于 平2翟仁友2
目的 通过前瞻性临床对照研究,比较经皮肝穿胆道引流术不同引流方法治疗恶性梗阻性黄疸对免疫功能的影响。方法 自2006年3月-2007年2月应用PTBD治疗符合入组标准的恶性梗阻性黄疸病例91例,男57例,女34例,年龄30-81岁,平均(60.4±11.6)岁。行PTIEBD(内外引流)的患者随机入组:IED-A组(餐后关闭引流2小时)20例、IED-B组(日间关闭引流)20例、IED-C组(持续关闭引流)15例;行PTEBD(外引流)患者36例。对术前3天内、术后2-4天、术后8-10天、术后1个月外周血总T细胞(TC)、辅助性T细胞(TH)、抑制性T细胞(TS)及TH/TS、免疫球蛋白(IgG, IgA, IgM)进行统计学方差分析。结果 术前3天内各组各免疫指标差异无显著性(P>0.05)。术后1个月TC、TH及TH/TS水平IED-B组>IED-A组>ED组,各组间比较均有显著性差异(P<0.05)。术后1个月IgG、IgA水平ED组>IED-A组>IED-B组,IED-B组与ED组间差异具有统计学意义(P<0.05)。术后1个月较术前TC、TH及TH/TS、IgG、IgA水平IED-A组、IED-B组均有明显恢复,差异有统计学意义(P<0.05),ED组差异无统计学意义(P<0.05)。IED-C组TC、TH及TH/TS、IgG、IgA水平术后2-4天与术前比较,差异无明显统计学意义(P>0.05)。结论 IED-A组、B组术后梗黄患者免疫功能可明显恢复,其中IED-B组效果较好;ED组及IED-C组梗黄患者免疫功能无明显恢复。
黄疸/梗阻性;经皮肝穿胆道引流术;放射学/介入性;细胞免疫;体液免疫
研究表明[1],恶性梗阻性黄疸患者免疫系统会受到明显的抑制。胆道内引流在治疗梗阻性黄疸时机体免疫功能可以得到有效恢复,而外引流则不能有效提高阻黄机体的免疫功能[2]。由于国内外对经皮肝穿胆道外引流术(PTEBD)与经皮肝穿胆道内外引流术(PTIEBD)不同引流方法对机体免疫功能影响的对照研究甚少,本研究通过前瞻性、对照的临床试验,旨在比较PTEBD与PTIEBD及其不同引流方法治疗恶性梗阻性黄疸对机体免疫功能影响的近期疗效。
1 资料与方法
1.1 一般资料 本组收集自2006年3月至2007年2月朝阳医院介入科应用PTBD治疗梗阻性黄疸患者121例(共217例次),符合入组标准的梗阻性黄疸病例93例,男57例,女34例,年龄30~81岁,平均(60.4±11.6)岁,其中胆管细胞癌24例,原发性肝癌7例,胆囊癌8例,胃癌1例,胰腺癌12例,壶腹癌7例,肝门或腹膜后淋巴结转移28例,肝转移癌2例,肝癌肝移植术后2例。
入组标准:(1)各种原因引起的梗阻性黄疸拟行PTBD治疗者;(2)血清总胆红素>120μmol/L;(3)影像检查示胆管扩张:肝内胆管>4mm和/或肝外胆管>8mm;(4)住院后首次处理单纯行PTEBD或PTIEBD;(5)患者为在我院住院病例;(6)无介入治疗禁忌症;(7)患者知情同意并接受本试验。
排除标准:(1)住院后首次接受PTBD治疗,同时置入内外引流管和外引流管者;(2)首次治疗行胆道支架置入术,或同时加放引流管者;(3)术前KPS评分<30分者;(4)其他不符合入组标准的情况。
本组病例行PTEBD36例,为ED(外引流)组;行PTIEBD55例,为IED(内外引流)组;对于行PTIEBD的患者采用分段随机入组的方法随机入组:IED-A组(餐后关闭引流2小时)、IED-B组(日间关闭引流)、IED-C组(持续关闭引流);其中IED-A组20例,IED-B组20例,IED-C组由于减黄效果较差,术后胆道感染发生率较高,未进行第四阶段试验,病例数为15例。对于首次引流术后因临床情况而更改原引流方式的情况分别记录。出现黄疸到行PTBD治疗的时间间隔为胆道梗阻时间,本组病例胆道梗阻时间为5~360天,平均(27.52±50.54)天。根据梗阻水平不同分为肝门水平梗阻38例(见图1、2),肝内水平梗阻16例(见图3、4),肝外水平梗阻37例(见图5-6)。
1.2 操作器械 所用基本器械包括22GChiba针、一步法PTBD穿刺套盒(COOK)、两步法PTBD穿刺套管针(COOK)、超滑导丝(COOK)、5F-7F动脉鞘(COOK)、5F KMP造影导管(COOK)。胆汁引流管(COOK):7F、8.5F、10F,5、6侧孔外引流管,32侧孔内外引流管。
1.3 操作方法 所有患者均先行PTC,了解胆道梗阻部位、程度和范围。DSA透视下经右侧或剑突下重新穿刺插管或应用一步法建立操作通路,交换成超滑导丝和5F造影管,探查通过狭窄段。如不能或不宜通过狭窄段,则直接顺超滑导丝引入外引流管。如导管与导丝可越过阻塞段,则用多侧孔导管跨越阻塞段再行造影,以便准确了解阻塞段长度。此时如要置入内外引流管,则将超滑导丝送入十二指肠,再顺超滑导丝引入内外引流管。对于左右肝管不相通者,需左右肝管分别穿刺引流。下列情况一般行PTEBD术:导丝不能通过胆道狭窄段,因胆道感染严重不宜行PTIEBD,病人病情较重不宜长时间手术操作,拟行胆道内支架治疗前或外科术前减黄等。
1.4 术后随访 对于本组病例出院后行术后一个月内的随访,随访期内无失访病例,随访率100%。
1.5 统计学处理 数据采用SPSS11.5软件分析。对于计数资料采用卡方检验分析,对于计量资料应用单因素方差分析、两个独立样本t检验,对于不符合正态分布的计量资料采用秩和检验,结果用( ±S)表示,P<0.05认为有统计学意义。

表1 各引流组病例数变化情况 (例)
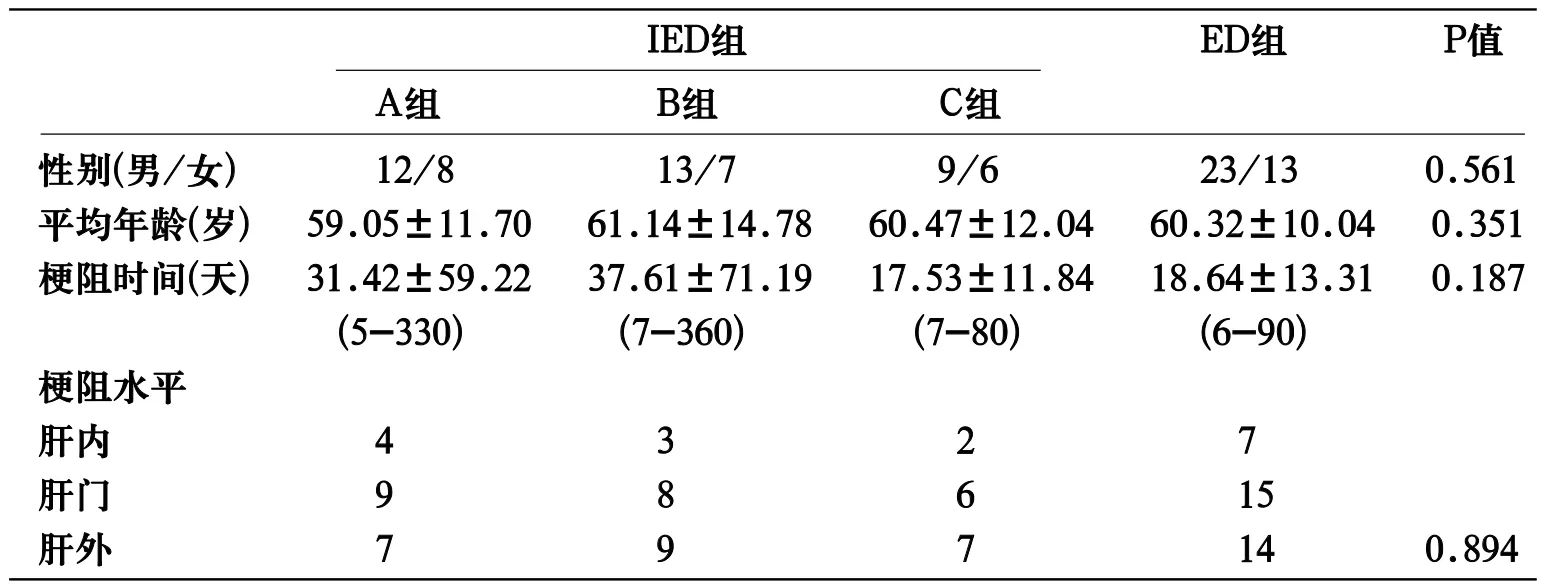
表2 各引流组间性别、年龄、梗阻时间及梗阻水平配伍情况
表3 PTBD前后各组各免疫指标的检测结果(±S)
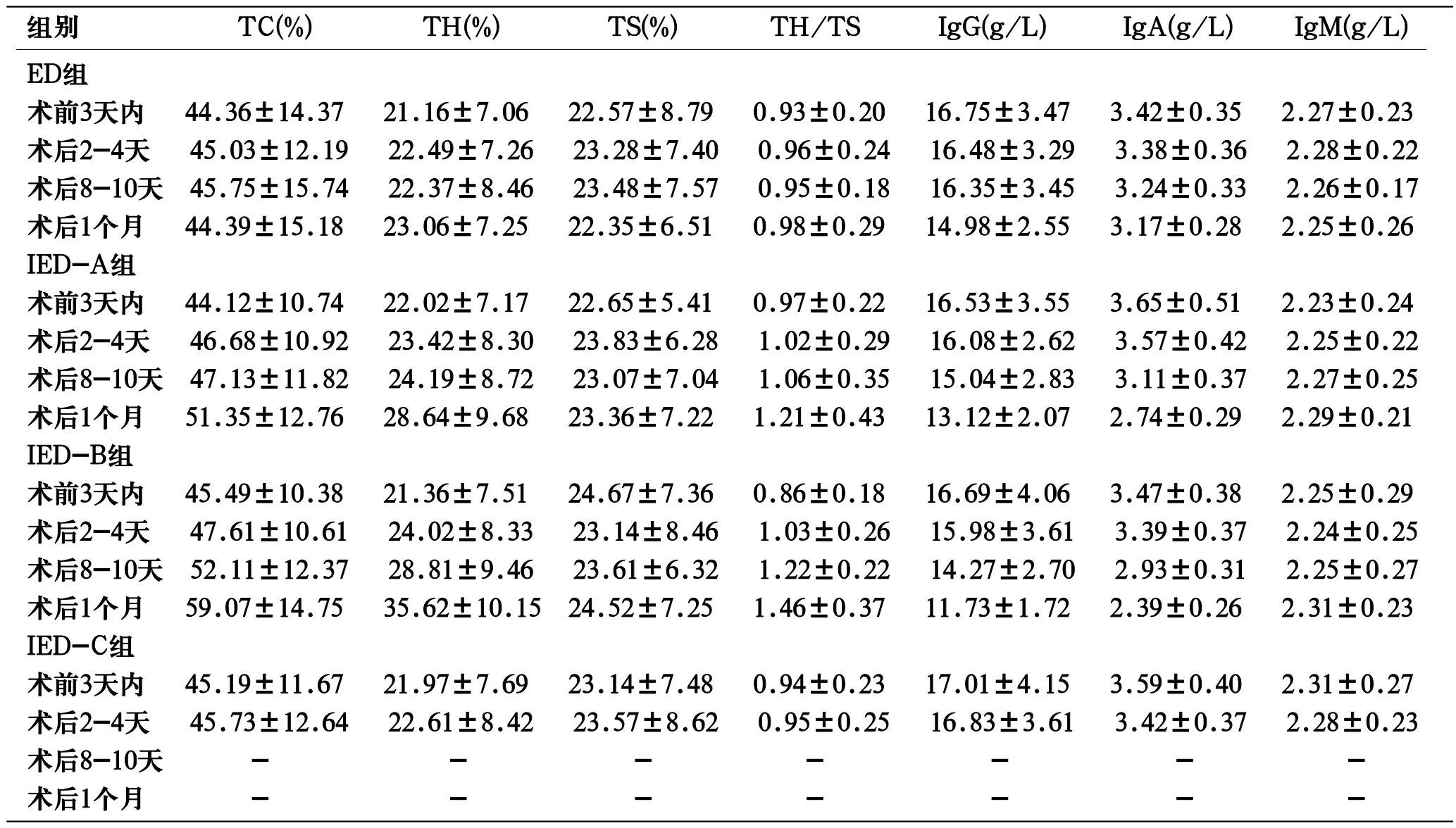
表3 PTBD前后各组各免疫指标的检测结果(±S)
注:术前及术后2-4天各免疫指标各组间差异无显著性(P>0.05)。
组别 TC(%) TH(%) TS(%) TH/TS IgG(g/L) IgA(g/L) IgM(g/L)ED组术前3天内 44.36±14.37 21.16±7.06 22.57±8.79 0.93±0.20 16.75±3.47 3.42±0.35 2.27±0.23术后2-4天 45.03±12.19 22.49±7.26 23.28±7.40 0.96±0.24 16.48±3.29 3.38±0.36 2.28±0.22术后8-10天 45.75±15.74 22.37±8.46 23.48±7.57 0.95±0.18 16.35±3.45 3.24±0.33 2.26±0.17术后1个月 44.39±15.18 23.06±7.25 22.35±6.51 0.98±0.29 14.98±2.55 3.17±0.28 2.25±0.26IED-A组术前3天内 44.12±10.74 22.02±7.17 22.65±5.41 0.97±0.22 16.53±3.55 3.65±0.51 2.23±0.24术后2-4天 46.68±10.92 23.42±8.30 23.83±6.28 1.02±0.29 16.08±2.62 3.57±0.42 2.25±0.22术后8-10天 47.13±11.82 24.19±8.72 23.07±7.04 1.06±0.35 15.04±2.83 3.11±0.37 2.27±0.25术后1个月 51.35±12.76 28.64±9.68 23.36±7.22 1.21±0.43 13.12±2.07 2.74±0.29 2.29±0.21IED-B组术前3天内 45.49±10.38 21.36±7.51 24.67±7.36 0.86±0.18 16.69±4.06 3.47±0.38 2.25±0.29术后2-4天 47.61±10.61 24.02±8.33 23.14±8.46 1.03±0.26 15.98±3.61 3.39±0.37 2.24±0.25术后8-10天 52.11±12.37 28.81±9.46 23.61±6.32 1.22±0.22 14.27±2.70 2.93±0.31 2.25±0.27术后1个月 59.07±14.75 35.62±10.15 24.52±7.25 1.46±0.37 11.73±1.72 2.39±0.26 2.31±0.23IED-C组术前3天内 45.19±11.67 21.97±7.69 23.14±7.48 0.94±0.23 17.01±4.15 3.59±0.40 2.31±0.27术后2-4天 45.73±12.64 22.61±8.42 23.57±8.62 0.95±0.25 16.83±3.61 3.42±0.37 2.28±0.23术后8-10天 - - - - - - -术后1个月 - - - - - --
2 结 果
2.1 一般情况 本研究入选病例91例,手术成功率100%。IED-A组:入组20例。3例改行胆道支架治疗(见图3、4),1例加放外引流,其中死亡2例。IED-B组:入组20例。2例因胆道感染改为IED-A组处理,3例改行胆道支架治疗,其中因肝性脑病死亡1例。IED-C组:入组15例。12例因胆道感染改为IED-A组处理,3例改行胆道支架治疗,其中2例分别由于胆道感染、肿瘤晚期死亡。ED组:入组36例。2例改行内外引流(见图1、2),12例改行胆道支架治疗,1例行外科手术,其中2例分别由于胆道感染、肝性脑病死亡。2例因胆道感染死亡。各组病例数变化情况见表1。
各引流组间性别、年龄、梗阻时间及梗阻水平配伍情况(见表2):各组性别比例、梗阻水平类型比例应用卡方分析,年龄应用单因素方差分析、梗阻时间应用秩和检验:各组间差异无统计学意义(P>0.05)。
2.2 PTBD前后各组各免疫指标变化情况(见表3)术后8-10天TC、TH及TH/TS水平IED-B组>IED-A组>ED组,IED-B组与IED-A组、ED组组间比较均有显著性差异(P<0.05),IED-A组、ED组组间差异无统计学意义(P>0.05)。术后1个月TC、TH及TH/TS水平IED-B组>IED-A组>ED组,各组间比较均有显著性差异(P<0.05)。术后1个月较术前3天内TC、TH及TH/TS水平IED-A组、IED-B组均明显增高,差异有统计学意义(P<0.05),ED组差异无统计学意义(P<0.05)。IED-C组TC、TH及TH/TS术后2-4天与术前比较,差异无明显统计学意义(P>0.05)。TS在各组间及各组内不同时间比较均无显著性差异(P>0.05)。
术后8-10天、术后1个月IgG、IgA水平ED组>IED-A组>IED-B组,IED-B组与ED组间差异具有统计学意义(P<0.05);其余各组间比较,差异无统计学意义(P>0.05)。术后1个月较术前IgG、IgA水平IED-A组、IED-B组明显下降,差异具有显著性(P<0.05),ED组差异无统计学意义(P>0.05)。IED-C组IgG、IgA水平术后2-4天与术前比较,差异无明显统计学意义(P>0.05)。IgM在各组间及各组内不同时间比较均无显著性差异(P>0.05)。
2.3 术后胆道感染 IED-A组、B组、C组、ED组术后胆道感染发生率分别为20%(4/20)、15%(3/20)、80%(12/15)、11.1%(4/36),IED-C组发生率明显高于其他各组(P<0.008),故终止IED-C组试验。
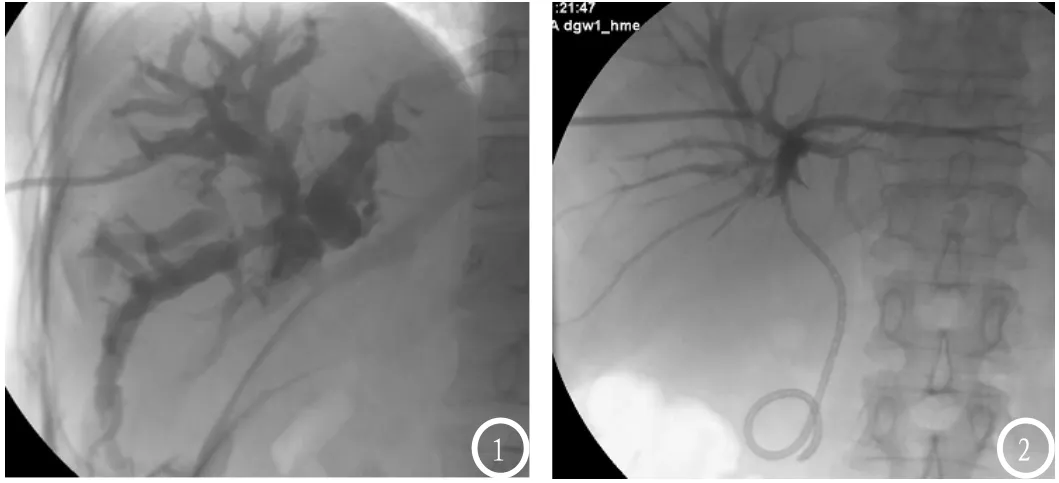
图1 、2 女性,57岁,胆囊癌,肝门水平梗阻,右侧入路置入一外引流管;术后3天外引流管移位后,重新置入内外引流管。
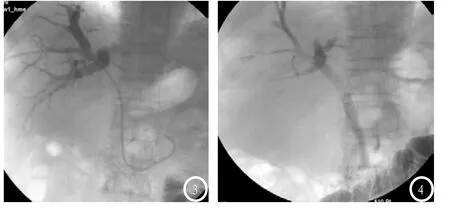
图3 、4 女性,64岁,胆囊癌肝转移,肝内水平梗阻,经右侧入路置入一内外引流管,后改行胆道内支架治疗,置入2枚支架.
3 讨 论
研究表明[1-3],恶性梗阻性黄疸患者免疫系统受到明显的抑制,但对梗阻性黄疸机体免疫功能下降的发生机制尚不十分清楚。细胞免疫是机体免疫的主要方式,T细胞在免疫应答中起关键作用。李桦等[4]观察梗阻性黄疸患者外周血T细胞亚群和自然杀伤细胞的变化,结果发现梗阻性黄疸时TC、TH、及TH/TS比值下降,自然杀伤细胞百分比下降。TH细胞数量降低标志着T淋巴细胞网络的调节功能在梗阻性黄疸时处于低水平状态,不能有效地适应由于大量抗原进入机体所造成的机体的反应。Greve[5]对比研究无菌和有菌鼠胆总管结扎后细胞免疫功能的变化,发现无菌鼠T淋巴细胞对植物血凝素丝裂原的刺激反应正常,而注射内毒素后可发现与有菌鼠相同的细胞免疫抑制现象,说明内毒素是导致淋巴细胞功能下降的关键因素。Sheen-Chen等[6]认为内毒素存在时,可刺激其腹膜巨噬细胞产生TNF,通过TNF抑制宿主细胞免疫功能。Saitoh[7]在动物实验中发现,梗阻性黄疸时内毒素血症发生率较高,而在缓解内毒素血症方面,内引流明显优于外引流。Roughneen[8]将梗阻性黄疸小鼠淋巴细胞反复冲洗,清除胆红素影响,T淋巴细胞仍然对植物血凝素丝裂原刺激反应性低下,说明胆红素并不是免疫抑制的主要因素。
本研究显示IED-B组免疫机能恢复方面效果好于IED-A组及ED组,其中ED组在术前术后各时间段比较中机体细胞免疫及体液免疫均无明显改变。术后8~10天、术后1个月IED-B组TC、TH、TH/TS水平较术前明显升高,与IED-A组及ED组相比有明显差异,同时IED-A组较ED组TC、TH、TH/TS水平也有明显的恢复。IED-A组术后1个月细胞免疫功能较术前可见明显恢复。不同引流方法在机体细胞免疫方面产生这样差别的原因,有如下考虑:对于IED-B组是内外引流,其日间关闭引流管,所以相对有较多量的胆汁能够进入肠道,从而可有效改善和控制内毒素血症的发生和发展,而内毒素血症是导致淋巴细胞功能下降的关键因素,从而可以有效的使细胞免疫功能得到恢复。IED-A组虽然也是内外引流,但其长时间向体外引流胆汁,也使得大量胆汁丢失,从而在减少肠源性内毒素的产生及吸收方面效果较IED-B组差;但也可以观察到其术后细胞免疫功能的恢复情况,且术后1个月较术前有明显恢复,说明此种引流方法对于免疫功能的恢复亦能起到一定的作用。由于ED完全将胆汁引流到体外,对于内毒素血症的缓解和改善无任何帮助,所以在免疫功能恢复方面无明显作用。
血清免疫球蛋白的水平,代表了机体体液免疫的功能。王炳煌[9]等指出梗阻性黄疸时血清及胆汁中的免疫球蛋白有变化,主要表现为血清IgG及IgA明显升高,这种代表体液免疫功能的免疫球蛋白水平的增高,是机体细胞免疫功能受损后的代偿现象。这样有利于机体发挥抗损伤、抗感染作用。Parks等[10]研究发现梗阻性黄疸时机体细胞免疫功能下降时,体液免疫功能不变或代偿性升高。本研究同样表明,在IED-B组、IED-A组,随着TC、TH、TH/TS等细胞免疫指标的恢复,免疫球蛋白IgG、IgA逐渐降低,这也正说明了梗阻性黄疸时IgG、IgA的增高是机体细胞免疫功能受损后的代偿反应,随着机体细胞免疫功能的恢复,IgG、IgA就会逐渐降低。
总之,经皮肝穿胆道内外引流IED-A组、B组术后梗黄患者免疫功能可明显恢复,其中IED-B组效果较好;ED组梗黄患者免疫功能无明显恢复;IED-C组由于胆道感染发生率较高不宜采用。
[1] Scott-Conner CE, Grogan JB. The pathophysiology of biliary obstruction and its effect on phagocytic and immune function. J Surg Res, 1994, 57(2): 316-336.
[2] Kei M, Tetsuo A, Hirohiko H, et al. Short-term effects of external and internal biliary drainage on liver and cellular immunity in experimental obstructive jaundice. J Hepatobiliary Pancreat Surg, 2004, 11(3): 176-180.
[3] 薛平,胡以则,卢海武,等.恶性梗阻性黄疸经内镜胆管引流对免疫功能的影响.中华普通外科杂志,20O0,15:377-378.
[4] 李桦,丁叔陶,张寿熙,等.梗阻性黄疸患者围手术期外周血T细胞亚群和自然杀伤细胞的变化.中华实验外科杂志,1993,10(1):90-93.
[5] Greve JW, Gouma DJ, Soeters PB, et al. Suppression of cellular immunity in obstructive jaundice is caused by endotoxins: a study with germ-free rats. Gastroenterology,1990, 98(2): 478-485.
[6] Sheen-Chen SM, Chen HS, Ho HT, et a1. Effect of bile acid replacement on endotoxin-induced tumor necrosis factor-alpha production in obstructive jaundice. World J Surg, 2002, 26: 448-450.
[7] Saitoh N, Hiraoka T, Uchino R, et al. Endotoxemia and intestinal mucosal dysfunction after the relief of obstructive jaundice by by internal and external drainage in rats. Eur Surg Res 1995; 27(1):11-18.
[8] Roughneen PT, Gouma DJ, Kulkarni AD, et al. Impaired specific cell-mediated immunity in experimental biliary obstruction and its reversibility by internal biliary drainage. J Surg Res. 1986, 41(2): 113-125.
[9] 王炳煌,王华,梗阻性黄疸对免疫功能的影响. 医师进修杂志,1997 ,20(9): 456-457.
[10]Parks RW, Halliday MI, McCrory DC, et a1. Host immune responses and intestinal permeability in patients with jaundice. Br J Surg, 2003, 90(2): 239-245.
A Prospective Control Study of the Effects of PTBD on Immunity for the Malignant Obstructive Jaundice
ZHANG Dong-po, ZHAI Ren-you, LI Jian-jun,et al., CHUI Yangliu of Beijing Hospital Radiology Department.
Objective To evaluate the effect of the different methods of PTBD on immunity to treat the patients with the malignant obstructive jaundice throught this prospective clinical control study.Methods There are 91 consecutive cases with the malignant objective jaundice (M:F=57:34), mean age (60.4±11.6 years) who were selected by our standard were accepted PTBD therapy from 2006.3 to 2007.2. The patients who undergo PTIEBD will be send into three group at random: group IED-A(turn off drainage for 2 hours after each meal) 20 cases, group IED-B(turn off drainage duaring daytime) 20 cases, group IED-C(turn off drainage persistently) 15 cases. Thirty-six patients underwent PTIEBD. TC, TH, TS, TH/TS, IgG, IgA, IgM before operation and 2-4 days, 8-10 days, and 1 month after the operation were analyzed by ANOVA test.Results There is no obvious difference in TC, TH, TS, TH/TS, IgG, IgA, IgM among these groups before operation(P>0.05). At 1 month after PTBD, the level of TC, TH, TH/TS: group IED-B>group IEDA>group ED, and the difference between three group is obvious(P<0.05); the level of IgG, IgA: group ED>group IEDA>group IED-B, and comparing group ED with group IED-B, the difference is obvious(P<0.05). At 1 month after PTBD, the level of TC, TH, TH/TS, IgG, IgA has been improved in group IED-A and group IED-B obviously(P<0.05). TC, TH, TH/TS, IgG, IgA did not change obviously after operation in IED-C group(P>0.05).Conclusion The immunity can be improved in group IED-A,B obviously, and group IED-B is better than group IED-A. In group ED and group IED-C, the immunity cann’t be improved obviously.
Jaundice/Obstructive, Percutaneous Transhepatic Biliary Drainage (PTBD), Radiology/Interventional
R256.41
A
10.3969/j.issn.1009-3257.2015.04.009
2015-07-08
张东坡,男,医学影像学专业,主治医师,主要从事医学影像学研究
翟仁友
