木炭还原氧化铜实验的再探究
2015-06-18汪阿恋吴新建张贤金叶燕珠
汪阿恋+吴新建+张贤金+叶燕珠
摘要:为解决木炭还原氧化铜实验存在的不足,在总结文献资料相关方法的基础上,探究木炭还原氧化铜实验的最佳反应条件。使用自制的高活性木炭粉,以酒精灯为热源,在传统的固固加热装置中进行木炭还原氧化铜的比较实验,使操作简便,实验现象明显,成功率高,有良好的课堂演示效果。
关键词:木炭还原氧化铜;实验探究;演示实验;实验改进
文章编号:1005–6629(2015)4–0066–03 中图分类号:G633.8 文献标识码:B
“木炭还原氧化铜”实验是初中化学一个重要的固相反应演示实验,可以让学生学习固相反应,了解木炭具有还原性,在化学教学中有着重要的意义。但由于该实验影响因素较多,若控制不好条件往往得不到明显的实验现象,是一个公认的疑难实验。近年来许多人对该实验进行了探究,也有不少的改进方案,但仍然存在实验成功率不高、实验现象不明显、装置复杂等问题。如何做好该实验,还需做深入探究。
1 实验改进方案综述
人们从不同的角度对该实验进行了改进,有人从反应物选择方面入手,例如蒯世定等[1]采用加热铜绿[Cu2(OH)2CO3]生成的新制氧化铜与木炭粉、石蜡等反应,实验效果明显;任娟等[2]采用固相反应法直接制备纳米氧化铜,且木炭与纳米氧化铜的质量比为1:10,以装有95%酒精的酒精灯作为热源加热。在反应物配比方面,李晓萍[3]认为实验关键条件是反应物配比,其他因素只是影响了配比,反应物木炭与氧化铜的最佳配比为1:10.5~1:11,干燥与否、称取木炭质量的不同等因素只是造成了实际比例的改变。有的老师则改换了实验装置,比如李颖等[4]选择了自制的胖肚移液管来做这个实验,使装置可重复使用,操作简便,现象明显,药品用量少,适合学生分组实验;刘彬[5]在采用硬质玻璃管(Φ7×85mm)制作的微型仪器中进行实验,并利用正交试验方法选择反应的最佳条件,节省药品并减少废弃物的排放,可培养学生的环保意识。作为一个典型的固相反应,卫泽敏等[6]从固相反应原理解析该反应的反应条件,对于可自发进行的固相反应而言,反应温度、反应混合物的干燥及机械加工程度是影响反应速率的主要因素。笔者认为反应物的颗粒及混匀程度是该实验至关重要的影响因素,在以往的文献中更多的是探讨如何制得高活性的氧化铜,而本文则着重阐述木炭粉的制备。对于初中生来说实验装置越简单越好,最好能与教材提供的装置相符。故笔者采用自制的木炭粉、市售的粉末状氧化铜作为反应物,以普通酒精灯为热源,在传统的固固加热(固相反应)的实验装置中进行实验,操作过程简单、安全,反应时间短,成功率高,演示效果好。
2 实验药品及仪器
药品:木炭(市售,块状)、粉状氧化铜(分析纯,福晨化学试剂厂)、澄清石灰水
仪器:搅拌机(又称粉碎机)(美国waring公司,型号HGB2WTS3,功率400W)、玻璃棉、试管、酒精灯、导管、止水夹、单孔橡皮塞、烧杯(100mL)
3 实验步骤及现象
3.1 实验药品准备
自制木炭粉:将块状木炭(约22g)直接放入搅拌机中,在高转速模式下进行粉碎,直至木炭粉用肉眼观察已无小炭粒反光。一次可制得约20g的木炭粉,搅拌时间3min左右,需注意在粉碎过程中每隔1min使机器暂停运转以免过热。
药品干燥:分别取研磨好的木炭粉(约20g)及市售的氧化铜粉末(约50g)置于两培养皿中,放入烘箱中于120℃干燥2h,烘干后分别装入试剂瓶并放在干燥器中待用。
3.2 实验步骤及现象
称取0.4g干燥的木炭粉,4.0g左右的氧化铜粉末,放入一干净的研钵中,用力研磨3~4min使反应物充分混匀。将研磨后的物料大部分装入 15×150mm的普通试管中,竖直试管于石棉网上轻敲几下使其夯实,再横放试管轻敲几下,在靠近物料的地方填入适量的玻璃棉。按图1所示的示意图将实验装置组装好。用普通酒精灯预热后,集中火力在物料下加热。加热到2′30″左右可发现物料剧烈反应,出现红热现象,同时导管口冒出大量气体,伴有白烟,澄清石灰水变浑浊。用止水夹夹紧导气管上的橡皮管,熄灭酒精灯。待冷却后倒出物料,可以发现物料变成砖红色且有金属光泽的铜粒生成。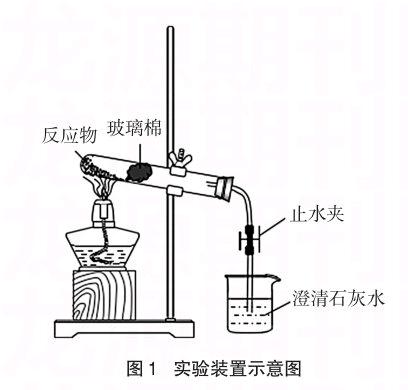
4 实验结果及讨论
4.1 实验结果
利用搅拌机对市售木炭块进行处理,方法简单易操作、费用低、高效,制得的木炭粉粒度小、活性高。自制木炭粉与市售氧化铜的质量比约为1:10,反应物于研钵中充分研磨以提高固体间的接触面积。在传统固固加热的反应装置中,利用普通酒精灯为热源加热,最终反应现象明显(出现红热),反应时间短,反应产物有大颗红色的铜粒出现。该实验采用教材的原型装置,学生易于接受,实验操作简便、易行,实验现象明显,成功率极高,具备了一个演示实验所需的条件。
4.2 讨论
固相反应在一般情况下都属于非均相反应,由于固体质点间具有很大的作用力,扩散受到限制使得反应活性较低,反应速度较慢,通常需要在高温下进行。反应物的组成和活性、反应物颗粒的均匀性、反应温度、压力和气氛等因素都会影响固相反应。木炭还原氧化铜作为一个典型的固相反应,木炭和氧化铜的质量比、加热效率、机械加工及混合程度等都会影响该反应的速率,本文就这几个方面对实验的影响进行了探讨。
关于木炭和氧化铜的质量比,笔者经过实践发现木炭与氧化铜的比例在1:5~1:11的范围都可以发生反应并观察到红热现象,只是木炭比例较高时反应后会有较多黑色的碳残留,生成的铜粒比较细小。反应物的质量比例在1:10左右较为适宜,在此比例下反应较为彻底,有大颗的铜粒生成,利于学生观察。
如何提高加热效率以加快微粒的扩散速度和成核速度,以引发显著的反应(红热)也是关键因素。在反应热源方面,若用酒精喷灯加热,可较快地达到反应温度,1min左右即可观察到剧烈的燃烧现象,此时反应的热效应产生的高热量常常会将试管烧破迸射出红热的铜,故一定要做充分预热,防止试管烧破。另外用酒精喷灯作为热源,有点燃不方便(耗时长)且噪声较大等不足。按照笔者的做法,只需用普通酒精灯加热,在2.5min左右即可观察到明显的红热现象,做到了既安全又可靠。铜的熔点是1083℃,该温度远高于酒精灯火焰温度,要获得经熔化而成珠状、小块状的铜,主要是靠其反应热,并使反应热集中不分散。所以该实验的加热仅仅是引发,使反应迅速发生,使热量集于一小处就成了成功关键,故选用普通酒精灯加热就可以了。要注意调节灯焰达到较佳状态,加热时一定要防止火焰飘动,可在酒精灯上加上一个防风罩,且最好选用小号或中号试管,试管过大,成功率明显下降。
反应物的粒度大小及混合程度会影响固体表面积及固体间的接触面积,这是该实验的关键点。笔者用搅拌机将市售的块状木炭进行打磨,可快速地制得粒度很小的木炭粉,而市售的氧化铜粉末则无需再研磨。物料的总量要控制在4.0g左右,反应物太少无法形成大颗的铜粒,不利于学生观察反应产物。反应混合物要在研钵中用力充分地研磨,填料要压实以增加木炭和氧化铜的接触面积。
综上所述,木炭还原氧化铜实验在反应物有足够的机械加工程度(保证磨细、研匀,是本实验成功的最重要的关键因素)、烘干(反应物烘干去水也是本实验成功很重要的关键因素)、适当的质量比及保证稳定的热源的情况下,就可利用传统固固加热装置在较短时间内获得良好的课堂演示效果。
参考文献:
[1]蒯世定,杨道华.碳还原氧化铜实验的探究[J].中学化学教学参考,2010,(1):49~50.
[2]任娟,杨东清.纳米氧化铜在中学化学演示实验中的应用研究——碳还原氧化铜实验的改进[J].化学教与学,2013,(4):85.
[3]李晓萍,郑琳戈.木炭还原氧化铜实验成功的关键[J].中小学实验与装备,2007,(6):12~13.
[4]李颖,杜晶晶.木炭还原氧化铜实验改进2例[J].化学教育,2010,(2):71~72.
[5]刘彬.碳还原氧化铜的探究[J].化学教与学,2011,(9):91~93.
[6]卫泽敏,吴先强.以木炭还原氧化铜探究固相反应机理及反应条件[J].化学教学,2009,(8):48~49.
