接种固氮菌Klebsiella sp.120对甘蔗光合特性和主要矿质营养元素含量的影响
2015-06-15邢永秀罗丽静魏春燕杨丽涛1李杨瑞1
邢永秀, 莫 遥, 罗丽静, 魏春燕, 杨丽涛1, *, 李杨瑞1, *
(1 广西农业科学院, 中国农业科学院甘蔗研究中心, 农业部广西甘蔗生物技术与遗传改良重点实验室,广西甘蔗遗传改良重点实验室, 南宁 530007; 2 广西大学农学院,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 3 广西作物遗传改良与生物技术重点开放实验室, 南宁 530007)
接种固氮菌Klebsiellasp.120对甘蔗光合特性和主要矿质营养元素含量的影响
邢永秀1, 2, 3, 莫 遥2, 罗丽静2, 魏春燕2, 杨丽涛1, 2*, 李杨瑞1, 2*
(1 广西农业科学院, 中国农业科学院甘蔗研究中心, 农业部广西甘蔗生物技术与遗传改良重点实验室,广西甘蔗遗传改良重点实验室, 南宁 530007; 2 广西大学农学院,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 3 广西作物遗传改良与生物技术重点开放实验室, 南宁 530007)
【目的】甘蔗是最重要的糖料和能源作物,生物量大,产量高,但大量氮肥的使用不仅增加了甘蔗的种植成本,而且对农田环境造成了污染。发挥与甘蔗联合固氮的生物固氮菌的作用,是降低甘蔗氮肥施用量的方法之一。Klebsiellasp.120是从广西种植的甘蔗体内分离到的具有固氮能力的菌株。为了探讨该菌对甘蔗的促生效应及其在甘蔗上的应用潜能,本文研究了接种该固氮菌对甘蔗光合特性及矿质元素含量的影响。【方法】采用桶栽方法,在甘蔗的分蘖期用接种菌株淋浇4个不同甘蔗品种的根际,在处理后的30 d 和60 d取样分析该菌对甘蔗的光合生理和矿质营养元素含量的影响。【结果】接种菌株对4个甘蔗品种的叶绿素含量和净光合速率有一定的促进作用,但不同品种之间存在差异。处理30 d 后,淋浇固氮菌处理的甘蔗品种ROC22的叶绿素含量明显提高,比对照增加23%。另外3个甘蔗品种(B8、GT21和GT28)处理组的叶绿素含量均有一定的提高,但与对照相比差异不显著。处理30 d后,只有ROC22和B8品种的净光合速率高于对照,且ROC22品种处理与对照间的差异达到了显著水平。处理60 d后,4个甘蔗品种的净光合速率均高于处理30 d,而且各品种接种处理均高于对照,其中以对ROC22和GT21的促进效果最为明显,达到了显著水平。接种处理对不同甘蔗品种的营养元素含量影响不同,接种处理对4个甘蔗品种叶片中的氮元素含量有促进作用,其中对ROC22的促进效果最为明显,接种处理比对照增加59.8%。接种固氮菌对甘蔗叶片磷和钾元素含量的影响不明显。接种固氮菌对4个甘蔗品种叶片的铁、锰元素含量的影响不明显; ROC22叶片中的锌含量及ROC22和B8叶片中的铜含量接种处理与对照相比显著提高。【结论】接种Klebsiellasp.120固氮菌对甘蔗光合特性及矿质元素含量的影响与甘蔗品种有关,其中对ROC22品种的促生效果最为明显。研究结果可为固氮菌株Klebsiellasp. 120 在甘蔗上的进一步应用提供参考依据。
甘蔗; 联合固氮菌;光合特性;矿质营养

Klebsiellasp.120是本课题组从甘蔗体内分离到的具有固氮能力的内生固氮菌,且具有溶磷和溶铁的特性,对甘蔗组培苗具有促进生长的作用[8],但其在甘蔗不同生育期的效果如何还未有报道。本试验采用淋根接种的方法,研究接种该固氮菌对甘蔗光合特性和矿质元素积累的影响,以期为该菌在甘蔗上的应用提供科学依据和参考。
1 材料与方法
1.1 供试材料
本试验于2012年7月在广西大学甘蔗研究所进行。采用桶栽试验,桶直径50 cm,高45 cm,每桶装土壤30 kg。土壤基本性状为: 有机质含量21.47 g/kg,全氮2.17 g/kg,全磷0.71 g/kg,全钾16.69 g/kg,速效氮81.67 mg/kg,有效磷7.43 mg/kg,速效钾71.00 mg/kg。
供试甘蔗品种为ROC22、B8、GT21和GT28的健康种苗。试验所用菌株为Klebsiellasp.120,菌株活化后用LB培养基培养过夜,然后用无菌蒸馏水稀释至109cfu/mL备用。
1.2 试验设计
当甘蔗品种炼苗成活后,每个品种移栽大小、长势较一致的植株10株,每桶1株,共40桶。在甘蔗分蘖初期,每个甘蔗品种的其中5桶作为处理组,围绕根系周围浇淋上述培养好的Klebsiellasp.120菌液400 mL,另外5桶浇淋400 mL无菌蒸馏水作为对照组,每处理5次重复,10 d后再按上述方法接种一次。在整个试验过程中,除了在移栽时每桶添加2 g复合肥外(N ∶P ∶K比例为18 ∶7 ∶16),相当于每公顷施纯N 17 kg,P2O510.5 kg,K2O 17 kg),甘蔗生长期间只进行水分和虫害管理。
1.3 测定项目与方法
1.3.1 叶绿素含量 在接种处理后的30 d 和60 d,分别选取各处理3株生长良好、无病虫害、叶面积相近的甘蔗+1叶叶片中上部,用SPAD-520型叶绿素仪(柯尼卡美能达公司生产)测定其叶绿素相对含量。
1.3.3 甘蔗叶片氮、磷、钾元素含量 在接种处理后60 d,取每个处理健康的甘蔗+1叶剪下带回实验室清洗擦干后,放入烘箱于105℃杀青30 min,65℃烘干48 h后用微型粉碎机粉碎相应样品,过筛后装入封口袋中备用。样品的消化按文献[9]的方法。叶片氮含量的测定参照孔祥生等[10]的方法;磷含量用钼蓝比色法;钾含量用火焰分光法测定[11]。
1.3.4 甘蔗叶片Fe、Mn、Cu、Zn、Mg元素含量 准确称取样品0.2000 g,放入干燥的消煮管底部,加浓HNO35 mL,在管口放上弯颈小漏斗,在远红外消煮炉中加热,待溶液蒸发到约2 mL左右时,再加入2 mL高氯酸,消煮至冒白烟,消化到液体变为无色透明为止,然后转到50 mL容量瓶中并定容。利用ZEEnit700P原子吸收分光光度计测定Fe、Mn、Cu、Zn、Mg的含量。
1.3.5 产量 收获时将每个处理的蔗茎放在一起,称重、计算各处理的蔗茎产量。
1.4 数据处理
试验数据采用Microsoft Excel 2003软件整理、作图,SPSS 17.0软件进行统计分析,采用DUNCAN法进行多重比较。
2 结果与分析
2.1 接种固氮菌对叶绿素含量的影响
叶绿素直接参与光能的吸收和能量转化,叶绿素含量的高低会影响甘蔗的光合能力。由表1可知,接种固氮菌Klebsiellasp.120对4个甘蔗品种叶片叶绿素含量均有不同程度的影响。接种30 d 后,甘蔗品种ROC22的叶绿素含量比对照提高了23%,差异显著;甘蔗品种B8、GT21和GT28的叶绿素含量均有一定的提高,但3个品种的接种处理与对照的差异均不显著,4个甘蔗品种中接种固氮菌Klebsiellasp.120对 ROC22和B8的效果较好。接种60 d后,4个甘蔗品种叶片的叶绿素含量都有一定的提高,但接种处理与对照间均未达到差异显著水平。
2.2 接种固氮菌对不同甘蔗品种叶片气体交换的影响

图1 接种 Klebsiella sp.120 固氮菌对不同甘蔗品种气体交换参数的影响Fig.1 Gas exchange in four sugarcane cultivars inoculated with Klebsiella sp.120[注(Note): 柱上不同字母表示处理间差异达5% Different letters above the bars mean significant among treatments at the 5% levels.]
从图1A可以看出,接种固氮菌Klebsiellasp.120 30 d后,ROC22、B8两品种叶片的净光合速率(Pn)高于对照,且ROC22的接种处理与对照的差异达到了显著水平。GT28叶片的净光合速率与对照差异不明显,而GT21的接种处理却低于对照。接种60 d后,4个甘蔗品种叶片的净光合速率比接种30 d时高,各品种接种处理的净光合速率均高于对照,以GT21的提高幅度最大,ROC22和GT21品种的接种处理与对照间叶片净光合速率也达到了显著差异水平。图1B显示,接种固氮菌对4个甘蔗品种的蒸腾速率有不同的效应。在接种处理30 d后, ROC22、B8、GT28 3个品种叶片的蒸腾速率(Tr)均高于对照,其中ROC22的效果最为明显,接种处理与对照间的差异达到了显著水平。在接种60 d后,除ROC22外,其他3个品种叶片的蒸腾速率(Tr)均高于对照,但各处理间的差异不显著。接种Klebsiellasp 120固氮菌对各甘蔗品种细胞间CO2浓度的影响如图1C,处理30 d后,B8、GT21、GT28的接种处理的胞间CO2浓度均高于各对照,或与对照相近,但差异均不显著。接种60 d后, B8、GT21、GT28品种接种处理叶片胞间CO2浓度明显高于对照,差异达到了显著水平。接种固氮菌对不同甘蔗品种气孔导度(Gs)的影响如图1D所示。从图中可以看出,在接种30 d后,ROC22、B8、GT28 3个品种接种处理的+1叶叶片气孔导度高于对照,但只有ROC22的接种处理与对照间的差异达到了显著水平。接种60 d后,4个甘蔗品种接种处理的叶片气孔导度均高于对照,其中以GT28和GT21的效果最为明显,但均与对照的差异不显著。
2.3 接种固氮菌对甘蔗氮、磷、钾含量的影响

2.4 接种固氮菌对甘蔗叶片铁、锰、铜、锌和镁含量的影响
固氮菌对4个甘蔗品种叶片铁、锰、铜、锌和镁含量的影响如表3所示。4个品种相比较,GT21叶片中的铁含量较低,接种固氮菌对4个甘蔗品种叶片铁含量的影响不太明显,各处理间差异均未达显著水平。4个甘蔗品种叶片中锰含量以GT28的对照最低,接种处理对4个品种叶片的锰含量的影响均不显著,各处理间只有ROC22T与GT21CK、GT28T和GT28CK的差异达到了显著差异水平。铜是植物体内的极微量元素,过多会造成中毒,缺乏会影响植物生长发育。接种固氮菌处理提高了ROC22和B8叶片的铜含量,且这两个品种接种处理与对照间的差异达到显著水平;接种固氮菌降低了GT21和GT28叶片的铜含量,但与对照的差异不显著。各处理间相比,ROC22T与其他各处理间的差异都达到了显著水平,B8T与GT21T和GT21CK间也有显著差异。锌元素在植物体内有重要的功能,尤其对生长素的合成。不同甘蔗品种+1叶锌含量以GT21品种最高,接种处理只提高了ROC22品种叶片中的锌含量,且与对照有显著差异,但降低了B8、GT21和GT28叶片中的锌含量,B8和GT21的接种处理与对照有显著差异,4个甘蔗品种+1叶镁含量的相差不大,接种处理各品种叶片镁的含量有所降低,但与对照的差异不显著。
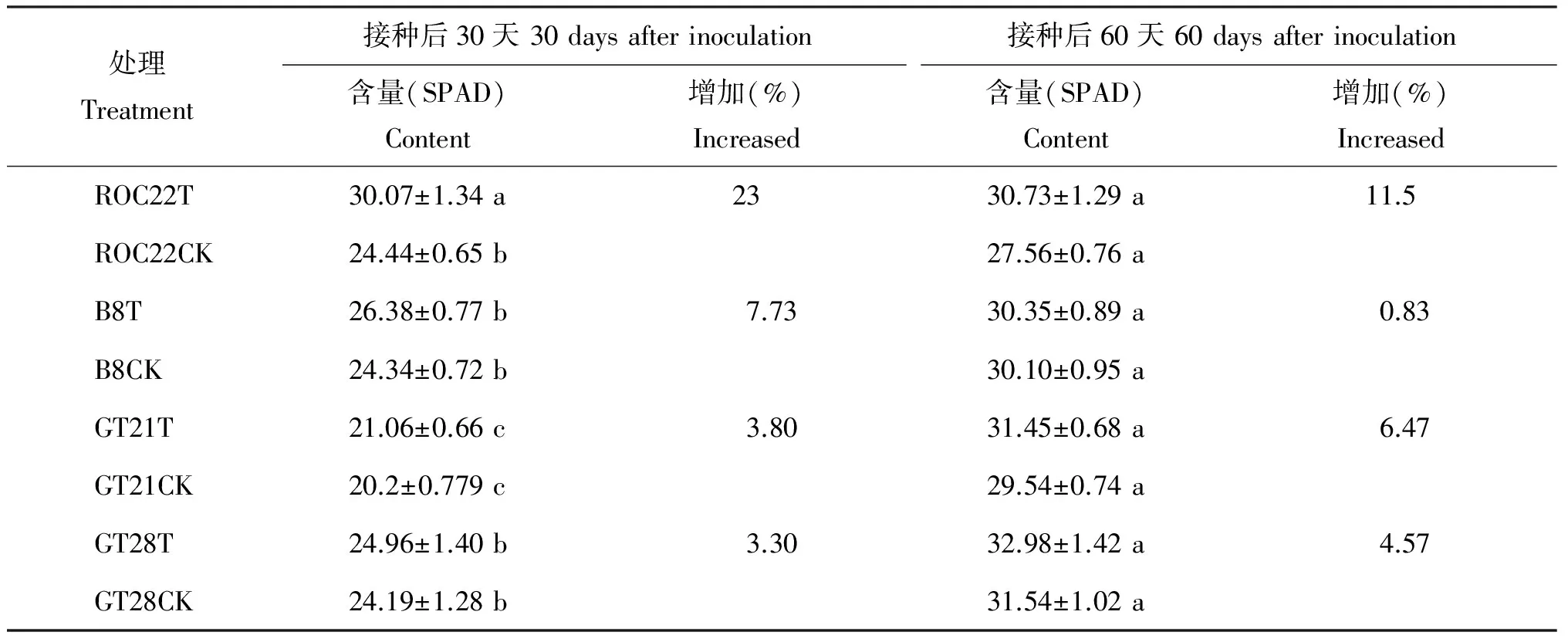
表1 接种固氮菌 Klebsiella sp.120后不同甘蔗品种叶绿素的相对含量
注(Note): T—固氮菌接种处理Treatments with inoculation; CK—无菌蒸馏水处理Treatments with sterilized distilled water. 同列数据后不同字母表示同一品种不同处理间差异达5%显著水平 Values followed by different letters in a column are significantly different in the same cultivar among treatments at the 5% level.

表2 接种 Klebsiella sp.120 固氮菌后不同甘蔗品种的氮、磷、钾含量(mg/g)
注(Note): T—固氮菌接种处理Treatments with inoculation; CK—无菌蒸馏水处理Treatments with sterilized distilled water. 同列数据后不同字母表示同一品种不同处理间差异达5%显著水平 Values followed by different letters in a column are significantly different in the same cultivar among treatments at the 5% level.
2.5 接种固氮菌对甘蔗生物量的影响
从表4可以看出,接种Klebsiellasp.120对4个甘蔗品种的产量和锤度(蔗汁中固溶物的百分含量,与甘蔗蔗糖分有高度正相关)有一定影响,对ROC22和B8品种的产量有一定的促进作用,但对4个品种的锤度的影响不明显。
3 讨论与结论
光合作用是植物产量形成的基础,叶绿素在植物光合作用过程中具有重要作用。吴凯朝等[12]将内生固氮菌Yantoeaagglomeras接种到不同品种的甘蔗中,在伸长期叶绿素a含量和净光合速率均高于对照,但不同品种间有较大差异。宋亚娜等[13]报道,接种固氮醋酸杆菌可以显著提高甘薯组培苗的生物量和叶片叶绿素含量。在本试验条件下,采用浇淋土壤的方法将固氮菌Klebsiellasp.120接种到甘蔗,结果发现接种处理对4个参试甘蔗品种的叶绿素含量都有不同程度的提高,其中对ROC22的叶绿素含量提高效果较明显,比对照增加37.9%,接种处理与对照间差异达到了显著水平。接种固氮菌对甘蔗叶片的净光合速率和蒸腾速率有一定的提高,但对不同的品种影响效果不同,以对ROC22的效果最为明显,这与其对甘蔗收获后的生物量的影响的效果最好相一致。接种固氮菌Klebsiellasp.120对不同甘蔗品种的光合特性影响的效果不同,除了不同品种间的光合生理效应存在差异外,还可能与内生固氮菌和甘蔗之间的联合共生关系有关。因此,需进一步研究该固氮菌株与甘蔗的联合共生效果,以充分发挥其生物固氮作用。
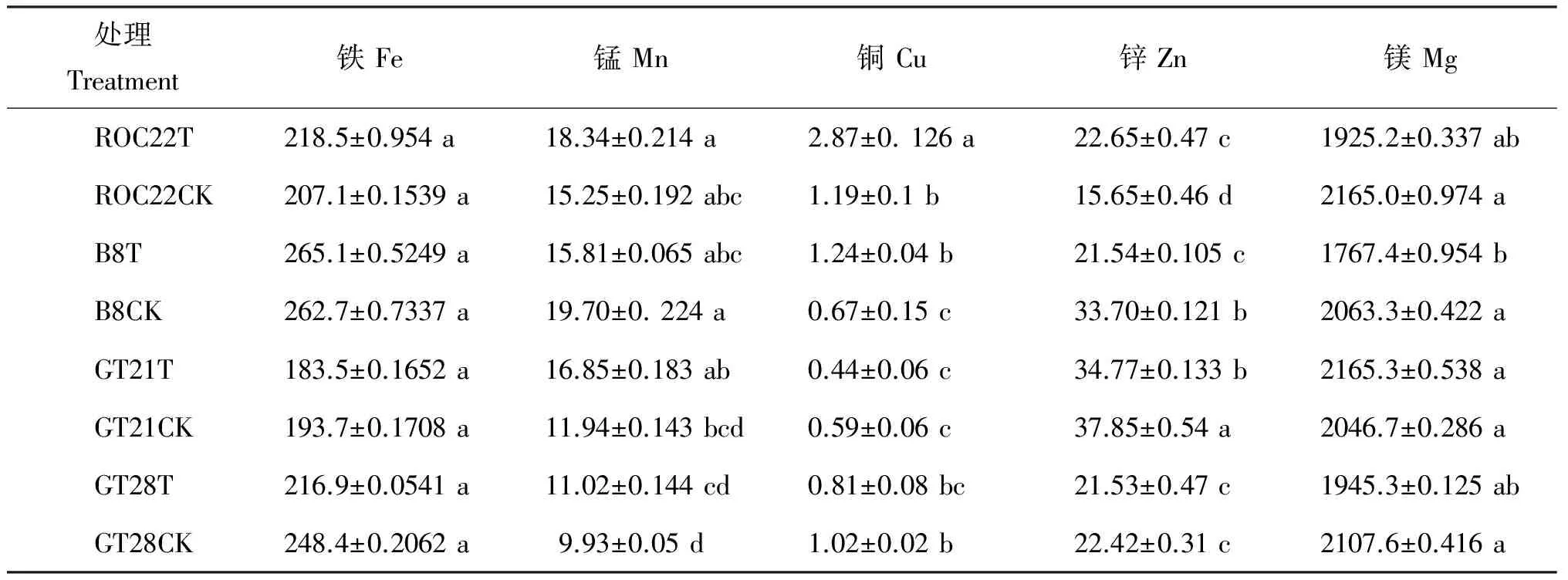
表3 接种 Klebsiella sp.120 固氮菌后不同甘蔗品种叶片中的铁、锰、铜、锌、镁含量(mg/kg)
注(Note): T—固氮菌接种处理Treatments with inoculation; CK—无菌蒸馏水处理Treatments with sterilized distilled water. 同列数据后不同字母表示同一品种不同处理间差异达5%显著水平 Values followed by different letters in a column are significantly different in the same cultivar among treatments at the 5% level.

表4 接种 Klebsiella sp.120 固氮菌后不同甘蔗品种的产量和锤度
注(Note): T—固氮菌接种处理Treatments with inoculation; CK—无菌蒸馏水处理Treatments with sterilized distilled water.
固氮菌对提高植物体内营养元素的含量有积极作用。联合固氮菌可以通过生物固氮、提高根际矿质营养的可利用性、提高根系的吸收面积和提高寄主的生化过程等机制来提高植物对矿质营养的吸收[1]。在温室条件下,Klebsiellavariicola处理甘蔗GT21组培苗,可促进植株对氮、磷和钾的吸收[13]。接种固氮菌株UPMB10和SP7可提高香蕉叶片和茎中氮、磷和钙的含量[14]。Munusamy等[7]用几个菌株单独或混合接种甘蔗发现,在无氮肥的情况下,甘蔗叶片氮含量增加约40%。在本试验中,采用根部淋浇固氮菌液的方法将固氮菌接种到甘蔗后,4个甘蔗品种都表现出接种处理组叶片的氮含量高于对照,尤其对ROC22的效果最为明显,处理组叶片氮素含量增加了59.8%。氮含量的增加是甘蔗生物固氮的结果,还是接种的固氮菌与甘蔗的互作过程中通过影响甘蔗的氮代谢,进而对氮素的合成与运输起到了积极作用,还是接种菌株提高了甘蔗从土壤中吸收氮素的能力,均有待进一步深入研究。磷是植物生长很重要的一个营养元素,而土壤中的可溶性磷非常低,溶磷细菌可能降低了根际土壤的pH,使得根际土壤中的一些低分子量的有机酸如苹果酸、草酸和柠檬酸等分解[15]。Bastian等[16]证明A.diazotrophicus和H.seropedicae都能在给定的培养条件下产生IAA和赤霉素GA1、GA3组分,增强植物对氮、磷和其他矿质元素的吸收。Estrada等[17]的研究表明,植物内生固氮菌还具有促进植物根系生理变化的作用,固氮菌的一些分泌物有助于植物吸收同化土壤中的磷素。接种固氮菌有利于植物的生长发育,可能是促进了根系的发育,增加了根系对矿质营养和水分的吸收[18-19]。生物固氮效率的大小与水分、磷、钾和微量元素含量有关[20]。本试验所用的Klebsiellasp.120是一个可溶磷和溶铁的固氮细菌[7],在本试验条件下,接种固氮菌对甘蔗叶片的磷含量有一定提高,但处理与对照间磷素含量差异都未达到显著水平。接种固氮菌株Klebsiellasp.120对不同甘蔗品种叶片铜含量的影响不同,接种提高了ROC22和B8叶片的铜含量,而另外两个甘蔗品种叶片中的铜含量却有降低趋势。接种处理只显著提高了ROC22叶片中的锌含量。对于固氮菌对植物微量元素含量的影响前人研究较少,固氮菌对微量元素的影响机制如何,还需要开展深入的研究。本研究结果表明,接种Klebsiellasp.120对甘蔗品种的光合特性及矿质元素含量的影响与甘蔗品种有关,以对ROC22的促生作用比较明显,但对另外3个品种的影响结果不一致。
本试验是在土壤未灭菌的情况下进行的接种试验,接种效果可能不能很好地反映固氮菌的促生性能,但试验条件更接近甘蔗生长的自然条件,所得结果对应用该固氮菌制作甘蔗专用微生物菌肥有一定的参考价值。但也应该指出,本试验所得结果是在桶栽低氮的条件下获得的,氮肥施用量远低于实际生产中的氮肥用量。有研究表明,生长在低氮条件下的甘蔗比种植在高氮肥和中氮肥投入的甘蔗的生物固氮量大,在低氮土壤上种植的甘蔗品种,固氮菌接种更容易成功[21]。因此在实际生产中,进一步研究不同氮肥配比和固氮菌处理对甘蔗产量和经济效益的影响,具有重要的实践意义。由于该试验采用的是将固氮菌培养液淋浇到土壤中的方法,处理后只对甘蔗的光合作用和叶片矿质元素含量进行了分析,而该菌对甘蔗根系以及对土壤中矿质营养元素的影响如何,还待进一步深入研究。
[1] Vessey J K. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant and Soil, 2003, 255: 571-586.
[2] Boddey R M, Urquiaga S, Reis V M, Döbereiner J. Biological nitrogen fixation associated with sugar cane[J]. Plant and Soil, 1991, 137: 111-117.
[3] Boddey R M, Mark B P, Palmer B, Dart P J. The use of15N natural abundance technique to quantify biological nitrogen fixation by woody perennials[J]. Nutrient Cycling in Agroecosystems, 2000, 57: 235-270.
[4] Sevilla M, Burris R H, Gunapala N, Kennedy C.Comparison of benefit to sugarcane plant growth and15N2incorporation following inoculation of sterile plants withAcetobacterdiazotrophicuswild-type and nif-mutant strains[J]. Molecular Plant-Microbe Interactions, 2001, 14(3), 358-366.
[5] Oliveira, A L M, Stoffels M, Schmid Metal. Colonization of sugarcane plantlets by mixed inoculations with diazotrophic bacteria[J]. European Journal of Soil Biology, 2009, 45: 106-113.
[6] 黄杏, 杨丽涛, 李杨瑞. 固氮菌接种对甘蔗根系生理特性的影响[J]. 广西农业科学, 2009, 40(3): 233-237. Huang X, Yang L T, Li Y R. Effects of inoculating nitrogen fixation bacteria on physiological characteristics of roots of sugarcane[J]. Guangxi Agricultural Sciences, 2009, (40)3: 233-237.
[7] Munusamy G, Jacques B, Muthukumarasamy Retal. Improved yield of micropropagated sugarcane following inoculation by endophyticBurkholderiavietnamiensis[J]. Plant and Soil, 2006, 280: 239-252.
[8] Lin L, Li Z, Hu C Jetal. Plant growth-promoting nitrogen-fixing enterobacteria are in association with sugarcane plants growing in Guangxi, China[J]. Microbes and Environments, 2012, 27: 391-398.
[9] 鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社, 2000.27-34. Bao S D. Soil agrochemical analysis (third edition)[M]. Beijing: China Agriculture Press, 2000. 27-34.
[10] 孔祥生, 易现峰. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2008. 58-62, 66-67. Kong X S, Yi X F. Experimental technology of plant physiology[M]. Beijing: China Agriculture Press, 2008. 58-62, 66-67.
[11] 吴凯朝, 梁俊, 韦莉萍, 等. 内生固氮菌对甘蔗伸长期光合生理特性的影响[J]. 广西植物, 2011, 31(5): 668-673. Wu K C, Liang J, Wei L Petal. Effect of nitrogen fixing bacteria on photosynthesis and chlorophyll fluorescence in sugarcane at elongating stage[J]. Guihaia, 2011, 31(5): 668-673.
[12] 宋亚娜, 郑伟文. 接种重氮营养醋杆菌对植物生长的影响[J]. 江西农业大学学报(自然科学版), 2003, 25(4): 587-590. Song Y N, Zheng W W. Influence ofAcetobacterdiazotrophicuson the growth of plant[J]. Acta Agricultural Universitatis Jiangxiensis (Nature Science Edition.), 2003, 25(4): 587-590.
[13] Wei C Y, Lin L, Luo L Jetal. Endophytic nitrogen-fixingKlebsiellavariicolastrain DX120E promotes sugarcane growth[J]. Biology and Fertility of Soils, 2014, 50(4): 657-666.
[14] Baset M A, Shamsuddin Z H, Mahmood M A. Use of plant growth promoting bacteria in banana: A new insight for sustainable banana production[J]. International Journal of Agriculture and Biology, 2010, 12(3): 459-467.
[15] Zaidi A, Khan M S, Ahemad M, Oves M. Plant growth promotion by phosphate solubilizing bacteria[J]. Acta Microbiologica et Immunollogica Hungarica, 2009, 56: 263-284.
[16] Bastian F, Rapparini F, Baraldi Retal. Inoculation with Acetobacterdiazotrophicusincreases glucose and fructose content in shoots ofSorghumbicolor(L.) Moench[J]. Symbiosis, 1999, 27(2): 147-156.
[17] Estrada G A, Baldani V L D, de Oliveira D Metal. Selection of phosphate-solubilizing diazotrophicHerbaspirillumandBurkholderiastrains and their effect on rice crop yield and nutrient uptake[J]. Plant and Soil, 2013, 369: 115-129.
[18] Barriuso J, Pereyra M T, Lucas García J Aetal. Screening for putative PGPR to improve establishment of the symbiosisLactariusdeliciosus-Pinussp.[J]. Microbial Ecology,2005, 50: 82-89.
[19] Richardson A E, Simpson R J. Soil microorganisms mediating phosphorus availability[J]. Plant Physiology, 2011, 156: 989-996.
[20] Urquiaga S, Cruz K H S, Boddey R M. Contribution of nitrogen fixation to sugar cane: Nitrogen-15 and nitrogen-balance estimate[J]. Soil Science Society of America Journal, 1992, 56: 105-114.
[21] Oliveira A L M, Canuto E L, Reis V M, Baldani J I. Response of micropropagated sugarcane varieties to inoculation with endophytic diazotrophic bacteria[J]. Brazilian Journal of Microbiology, 2003, 34: 59-61.
Effects of inoculating nitrogen fixing bacteriaKlebsiellasp.120 on photosynthetic characteristics and mineral nutrient contents of sugarcane
XING Yong-xiu1, 2, 3, MO Yao2, LUO Li-jing2, WEI Chun-yan2, YANG Li-tao1,2*, LI Yang-rui1,2*
(1GuangxiAcademyofAgriculturalSciences/SugarcaneResearchCenterofChineseAcademyofAgriculturalSciences/KeyLaboratoryofSugarcaneBiotechnologyandGeneticImprovement(Guangxi),MinistryofAgriculture/GuangxiKeyLaboratoryofSugarcaneGeneticImprovement,Nanning530007,China; 2AgriculturalCollegeofGuangxiUniversity/StateKeyLaboratoryofSubtropicalBioresourcesConservationandUtilization,Nanning530004,China; 3GuangxiCropGeneticImprovementandBiotechnologyLaboratory,Nanning530007,China)
【Objectives】 Sugarcane (SaccharumofficinarumL.) is an important sugar and energy crop with high biomass and high productivity. However, application of large amount chemical nitrogen fertilizer in sugarcane is very common in China, which not only increases the production cost, but also causes environmental pollution. A possible method of reducing sugarcane nitrogen fertilization is inoculation of nitrogen fixation bacteria. The nitrogen fixing bacteria (NFB) strainKlebsiellasp.120 was isolated from surface-sterilized roots of sugarcane cultivar ROC22. Its effect on photosynthetic characteristics and mineral nutrient accumulation in sugarcane was investigated.【Methods】 Four sugarcane cultivars were planted in pots. The strainKlebsiellasp.120 was inoculated to the plants by root watering at the tillering stage. Effects of the inoculation on photosynthetic characteristics and mineral nutrient accumulation of the four cultivars were studied after the treatment of 30 and 60 days, respectively.【Results】 The results show that the photosynthetic rates and chlorophyll contents of different cultivars are affected differently by the inoculation withKlebsiellasp.120. After 30 days inoculation increases signiticantly the chlorophyll contents in leaves of sugarcane cultivar ROC22 (increased by 23%), slightly in the other three sugarcane cultivars B8, GT21 and GT28, compared to the uninoculated controls. The net photosynthetic rates of sugarcane cultivar ROC22 and B8 are higher than the controls after 30 days, and there are significant differences. The net photosynthetic rates of the four sugarcane cultivars inoculated the strain after 60 days are higher than those after 30 days. The net photosynthetic rates of the four sugarcane cultivars are significantly higher than controls after the treatment 60 days. The effects of inoculation on the net photosynthetic rates are better in the cultivars ROC22 and GT21. The effects of the inoculation treatments on the nutrient element contents are different. The contents of N in the NFB inoculation treatment group are all higher than control group for the four sugarcane cultivars, especially in cultivar ROC22(increased by 59.8%). There are no differences in the contents of P and K in all the cultivars between the inoculation treatment group and the control group. Among the four cultivars, the Zn content in leaves of ROC22 and the Cu contents in leaves of ROC22 and B8 are improved significantly by inoculating, compared with the control. 【Conclusions】 The effects of inoculatingKlebsiellasp. 120 on the photosynthetic characteristics and mineral contents depend on sugarcane cultivars. The effect is most obvious in the sugarcane cultivar ROC22 among the selected four sugarcane cultivars. Therefore, experiment should be carried out for different sugarcane cultivars for the effective performance of the strainKlebsiellasp.120.
sugarcane; associative nitrogen fixing bacteria; photosynthetic characteristics; mineral nutrient
2013-10-29 接受日期: 2014-05-04
国家自然科学基金项目(31171504,31101122);广西自然科学基金项目(2011GXNSFF018002,2013GXNSFAA019082);广西八桂学者和特聘专家专项基金;广西农科院博士后项目(桂农科博2010016)资助。
邢永秀(1972—),女,山西代县人,博士,副教授,主要从事甘蔗栽培生理与生物固氮研究. E-mail: xing20020208@163.com * 通信作者 E-mail: liyr@gxu.edu.cn; liyr@gxaas.net
S566.1.01; S144.3
A
1008-505X(2015)02-0467-08
