山茱萸总苷干预急性缺氧乳鼠心肌细胞凋亡线粒体通路的研究
2015-06-13陈克芳李建军潘爱珍侯祥平
陈克芳,李建军,潘爱珍,侯祥平
急性心肌梗死(acute myocardial infarction,AMI)早期心肌细胞丢失的主要方式为细胞凋亡,凋亡通路的激活决定细胞凋亡的进行,而细胞凋亡通路主要包括半胱氨酸天冬氨酸蛋白水解酶(caspase)信号途径和不依赖于caspase的两种信号通路,依赖于caspase的信号途径主要为线粒体途径。我们早期的实验已经证实,山茱萸总苷可以抑制急性缺氧时心肌细胞的凋亡[1],但具体机制尚不清楚,而线粒体的能量耗竭及活性氧的释放是导致急性心肌梗死时心肌细胞坏死、凋亡的主要病理改变,因此认为山茱萸与线粒体之间必然存在一定的联系。本实验从对心肌细胞凋亡线粒体通路中caspase-9的研究来探明山茱萸总苷抑制心肌细胞凋亡的机制,为开发治疗心肌梗死的天然药物提供实验依据。
1 材料与方法
1.1 动物 出生1 d~3 d的SD大鼠,由中山大学实验动物中心提供。
1.2 试剂 DMEM/F12培养基,吉诺生物医药技术有限公司产品;DMEM无糖培养基,Gibco公司产品;胎牛血清,Gbico公司产品;0.25%胰蛋白酶,吉诺生物医药技术有限公司产品;青霉素-链霉素溶液,Gibco公司产品;抗α-Sarcomeric actin,武汉博士德生物有限公司产品;SABC抗caspase-9试剂盒及DAB显示试剂盒,武汉博士德生物有限公司产品。
1.3 药物 山茱萸,广东一方制药有限公司提供。
1.4 主要仪器 CO2细胞培养箱,Thermo公司提供。
1.5 方法
1.5.1 山茱萸总苷提取物制备 广东省中医研究所按文献[2]方法提取,提取物浓缩干燥至粉末状。
1.5.2 心肌细胞原代培养 将出生1 d~3 d的SD大鼠,用75%酒精消毒后取出心脏,迅速放入4℃预冷D-Hank’s液的培养皿中,洗去心脏表面及血管中的血细胞,剪去心房和大血管。将心脏剪成1 mm×1 mm×1 mm大小的组织块,加入10 mL左右的0.125%胰酶消化液,于37℃水浴箱中分次消化,每次约10 min。收集除第1次以外的细胞悬液于50 mL离心管中,加入含量为10%FBS的DMEM/F12培养液,终止消化。1 000 r/min离心5 min,弃上清,加入含10%FBS的DMEM/F12培养液,轻轻吹打使其形成单细胞悬液,将细胞悬液吸入培养皿中,按差速贴壁法于37℃、5%CO2培养箱中孵育1.5 h,去除成纤维细胞,纯化心肌细胞。之后轻轻收集尚未贴壁的细胞悬液,调整细胞密度为1×105/mL~5×105/mL,接种于6孔培养板中。细胞于37℃、5%CO2环境中培养,每2 d换一次液,培养3 d~4 d后使用[3]。
1.5.3 实验分组 缺氧模型组:正常培养3 d的心肌细胞弃去培养液,换成无糖DMEM液,用无菌液状石蜡封住液体表面,使细胞缺氧[4]。对照组:心肌细胞不做任何处理,正常条件培养。山茱萸总苷干预组:细胞缺氧处理之前24 h在培养液中加入0.49 g/L的山茱萸总苷,缺氧培养的同时加入0.49 g/L的山茱萸总苷进行干预。各组设1 h、2 h、3 h、5 h 4个时间点进行指标观察。
1.5.4 心肌细胞的鉴定 按照SABC抗a-横纹肌肌动蛋白试剂盒说明方法:将培养3 d的细胞爬片用4%的多聚甲醛固定30 min,然后用30%H2O21份+纯甲醇50份混合液室温浸泡30 min后蒸馏水洗1次~2次,滴加5%BSA封闭液,室温20 min,甩去多余液体,滴加1∶100稀释的一抗(小鼠抗大鼠α-Sarcomeric actin),对照组用蒸馏水代替一抗,37℃孵育1 h,PBS洗2 min×3次。滴加生物素化山羊抗小鼠IgG,室温20 min,PBS洗2 min×3次。滴加试剂SABC,37℃20 min,PBS洗5 min×4次。二甲苯透明,中性树胶封片[5]。
1.5.5 SABC法检测心肌细胞caspase-9的表达 培养的细胞爬片,3 d后弃去培养基,4%的多聚甲醛固定30 min,30%H2O21份+纯甲醇50份混合,室温浸泡30 min,以灭活内源性过氧化氢酶,蒸馏水洗1次~2次。滴加5%BSA封闭液,室温20 min,甩去多余液体,不洗,滴加1∶100稀释的一抗(小鼠抗大鼠α-Sarcomeric actin),对照组用蒸馏水代替一抗,37℃孵育1 h,PBS洗2 min×3次。滴加生物素化山羊抗小鼠IgG,室温20 min,PBS洗2 min×3次。滴加试剂SABC,20℃~37℃20 min,PBS洗5 min×4次。DAB显色:取1 mL蒸馏水,加试剂盒中A、B、C试剂各1滴,混合均匀后加至切片,室温显色,镜下控制反应时间,一般5 min~30 min。蒸馏水洗。苏木素轻度复染1 min,自来水冲洗。75%、85%、95%、100%梯度酒精脱水,二甲苯透明,中性树胶封片。
1.6 统计学处理 采用SPSS13.0进行数据分析,计量资料以均数±标准差(x±s)表示,两组比较采用t检验,多组数据之间的比较采用单因素方差分析,检验水平取α=0.05。
2 结 果
2.1 心肌细胞鉴定 心肌细胞中含有α-Sarcomeric actin,本实验选用的一抗为小鼠抗大鼠α-横纹肌肌动蛋白,因此染色后心肌细胞胞浆将被着深棕色,而非心肌细胞则呈阴性染色。心肌细胞的纯度鉴定采用每张玻片随机取10个视野,分别计算出心肌细胞阳性率,重复3次并取平均值为97.260%、96.875%、96.970%,三者取平均值得出心肌细胞的纯度为97.035%。
2.2 SABC法检测心肌细胞caspase-9的表达 与对照组相比,缺氧各组caspase-9的表达增加,差异有统计学意义(P<0.01),并且随着时间的延长,阳性表达的比例增加,5 h达到最高,给予山茱萸总苷干预之后,治疗组每个时间点的caspase-9表达都有所下降,与缺氧组相比,差异有统计学意义(P<0.01)。详见表1。
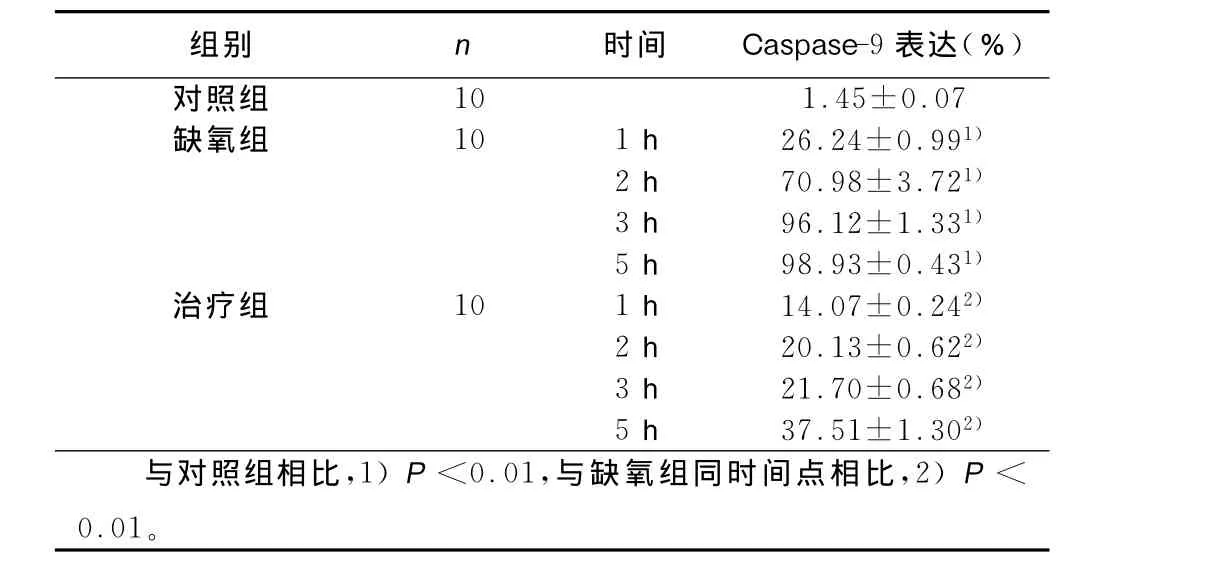
表1 SABC法检测心肌细胞caspase-9的表达(x±s)
2.3 心肌细胞各组caspase-9表达免疫组化染色情况 实验发现,对照组正常心肌细胞阳性着色的细胞很少;随着缺氧时间延长,阳性着色比例较对照组明显增多;治疗组较缺氧组阳性着色比例明显减少。
3 讨 论
凋亡通路的激活引起细胞凋亡,而细胞凋亡通路主要包括caspase的信号途径和不依赖于caspase的两种途径。具体通路主要有2种:外源性途径和内源性途径。①外源性途径[6]:Fas等配体与死亡受体(death receptors)结合,FADD 聚集,死 亡 效应域(death effector domain,DED)形成,caspase-8活化,下游的caspase-3被激活,最终引起细胞的自动连锁反应,细胞发生凋亡。②内源性途径:在该途径中,线粒体通路起着主要的作用,长期以来,人们一直忽略了线粒体在细胞凋亡中的作用。但是近年来越来越多的对于线粒体在细胞凋亡中扮演角色的研究发现,线粒体中含有许多与细胞凋亡相关的酶或蛋白、基因等,并且在细胞凋亡中起着重要的作用,如细胞色素C(Cyt-C)[7]、凋亡诱导因子(apoptosis inducing factor,AIF)等,当各种细胞凋亡信号,如应激、炎症、缺氧等传至细胞后,Cyt-C由线粒体进入胞浆,并且结合凋亡蛋白酶活化 因 子 1(apoptotic protease-activating factor-1,Apaf-1),在ATP 或dATP的作用下,通过改变 Apaf-1的分子结构,引起caspase-9的活化,caspase-9活化之后便会激活最重要的凋亡执行者caspase-3酶系列,引起细胞凋亡的自动连锁反应,完成细胞凋亡[8]。
由此可知caspase-9在线粒体凋亡途径中起着非常重要的作用,其与ATP、凋亡蛋白激活因子-1结合形成凋亡体,激活caspase-3而最终导致细胞的凋亡。因此抑制caspase-9的表达则可以阻断casepase-3的激活,最终达到阻止细胞凋亡的目的。以上的实验证明正常的心肌细胞caspase-9几乎没有表达,而缺氧、缺血则可以引起心肌细胞的凋亡,并且随着时间的延长,caspase-9阳性表达细胞比例明显增多,表明其参与细胞凋亡的过程。每组给予山茱萸总苷0.49 g/L干预后,缺氧处理组的caspase-9阳性表达下降,差异有统计学意义。这表明山茱萸总苷可以抑制caspase-9的表达,通过阻断心肌细胞凋亡线粒体信号通路而抑制心肌细胞的凋亡,起到保护心肌细胞的作用。
[1] 陈克芳,李建军,潘爱珍,等.山茱萸总苷干预急性缺氧乳鼠心肌细胞凋亡的研究[J].中西医结合心脑血管病杂志,2012,10(12):1488-1489.
[2] 吴红,梁恒,刘永红,等.山茱萸总皂苷的提取分离与含量测定[J].第四军医大学学报,2003,24(5):430-431.
[3] 辛毅,许秀芳,黄益民.乳小鼠心肌成纤维细胞和心肌细胞的分离培养及荧光鉴定[J].新乡医学院学报,2011,28(5):541-547.
[4] 曾文静,刘菊英,柯昌斌.液体石蜡封闭法建立大鼠心肌细胞缺氧/复氧损伤模型[J].郧阳医学院学报,2010,29(2):108-110.
[5] 张乃菊,陈天平,祝晓光.乳鼠心肌细胞和心脏成纤维细胞的原代培养[J].蚌埠医学院学报,2010,35(6):558-561.
[6] 张玉清,王宇彬,宋书凯.Fas系统诱导细胞凋亡与冠状动脉粥样硬化性心脏病的研究进展[J].国际内科学杂志,2008,35(4):205-207.
[7] 杨泽栋,李永东.细胞色素C评价心肌细胞凋亡的研究进展[J].医学综述,2012,18(3):341-343.
[8] Youle RJ,Strasser A.The Bcl-2 protein family:Opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.
