激活低密度脂蛋白受体相关蛋白-1依赖的细胞信号通路可促进轴突生长及神经损伤修复
2015-06-13李超欧阳佳朱军
李超 欧阳佳 朱军
激活低密度脂蛋白受体相关蛋白-1依赖的细胞信号通路可促进轴突生长及神经损伤修复
李超1欧阳佳2朱军1
目的初步探讨低密度脂蛋白受体相关蛋白-1(LRP1)依赖的信号通路对轴突生长及神经损伤修复的作用。方法在培养胎鼠皮层神经元过程中加入LRP1激动剂RBD,观察其与对照组相比能否促进神经突触的生长及其信号机制,此外通过制作小鼠脊髓损伤模型并予以鞘内注射RBD,观察其对神经损伤修复的影响。结果体外培养皮层神经元中加入RBD后引起神经营养因子受体TrkC,Akt信号转导通路和细胞外调节蛋白激酶(ERK)的活化,其与对照组相比定量分析表达均明显升高(P<0.05),促进神经突的生长。鞘内注射RBD后小鼠脊髓损伤后的运动功能恢复评分也明显提高(P<0.05)。结论激活LRP1依赖的信号通路可明显促进轴突生长及小鼠脊髓损伤后的功能修复。
低密度脂蛋白受体相关蛋白-1;脊髓损伤;行为学;创伤修复
低密度脂蛋白受体广泛存在于包括中枢神经系统在内的细胞中,并在脂质代谢中发挥重要作用。近几年研究显示此受体系统在调节细胞活性,包括细胞信号及功能等方面有着重要作用[1]。低密度脂蛋白受体相关蛋白1(low density lipoprotein receptor-related protein-1,LRP1)条件性缺失,小鼠神经元则表现出脂质代谢改变,突触消失及神经变形等。LRP1受体也存在于胶质细胞,最近研究报道LRP1的活化可以磷酸化神经营养因子受体TrkA,并且外周神经损伤后施旺细胞表达的LRP1被证实与损伤修复和再生相关[3-4]。然而,LRP1依赖的细胞信号通路在中枢神经系统损伤方面的研究报道并不多见。在此重要发现的基础上我们提出假设:LRP1活化可以激活神经元中的神经营养因子信号通路并在脊髓损伤后可以促进轴突的再生。
材料与方法
一、实验动物
孕龄2周及成年雌性C57小鼠清洁级,购于维通利华公司。
二、试剂与设备
无血清培养基(DMEM)粉剂、胎牛血清、购自Gibco公司;anti-LRP1和NF200购于美国Abcam公司,二甲基亚砜(DMSO)、NMDA、甘氨酸、谷氨酰胺、多聚赖氨酸、胰蛋白酶购自Sigma公司;阿糖胞酐购自Pharmacia Bio公司。激光共聚焦显微镜(德国莱卡公司),DG3022A酶联免疫检测仪(国营华东电子管厂),二氧化碳细胞培养箱(日本三洋公司),荧光相差显微镜(日本Olympus)。
三、实验方法
首先,通过体外试验确定LRP1激动剂RBD (the LRP1 binding domain,RBD)是否能够促进胎鼠皮层神经元轴突生长及其通过LRP1受体激活的信号通路机制,其次通过体内试验评估C57脊髓损伤小鼠鞘内注射LRP1激动剂RBD后能否促进其功能恢复。
1.原代皮层神经细胞培养:皮质放置在35 mm无菌培养皿中(含有冷的无血清高糖DMEM),剪成大约1 mm小块,把组织吸出到另一个培养皿中,去除培养基,加入2 mg/ml木瓜蛋白酶1 ml,消化37℃30 min,然后加入200 μl的2.5 mg/ml DNase I 30 s,最后,加入1 ml FBS终止消化。然后将培养皿内容物转移到15 ml离心管中,加入10 ml高糖DMEM培养基,用100 μm细胞过滤器放在50 ml离心管过滤掉所有的剩余组织碎片。800转离心5 min,弃掉上清。0.1 mg/ml L-PLL加入6孔板中37℃孵育过夜。然后用HBSS洗两遍,每平方厘米接种50 000细胞,neurobasal培养基(含有10%B27 supplement和100 μ/ml P/S)孵育,3 d换液1次。以处理因素不同共分为4组,为对照组(未做处理),拮抗剂组中加入LRP1拮抗剂(receptor associated protein,RAP) (200 nmol/L),激动剂组中加入RBD(100 nmol/L),以及RAP和RBD共同刺激组。
2.脊髓损伤模型手术过程:成年雌性C57小鼠18只,用3.6%的水合氯醛麻醉后,放在电热毯上,于整个手术过程中维持体温在37℃。减去术区毛发并用75%酒精消毒3次,切开皮肤并去除皮下脂肪,分离肌肉组织充分暴露T9-T10节段的椎板,用显微纹氏钳咬除T10椎板,并小心打开硬脊膜避免损伤脊髓,然后用显微刀片对脊髓进行背侧半切,达中央管水平,此种模型可以破坏损伤节段以下的皮质脊髓束,背侧柱,红核脊髓束及部分网状脊髓束,同时于损伤处鞘内植入Alzet微量泵,分别予以鞘内注射RBD(5 μmol/L,n=10)及生理盐水(n=8),考虑到随着植入时间的延长,会对损伤局部产生炎症刺激,故两组均于术后第5天取下微量泵。
3.免疫荧光染色:将T10节段厚度10 μm的脊髓冰冻切片在PBS中冲洗后,用10%的小牛血清(BSA)室温封闭1 h,然后用2%BSA和0.2%的PBS-Triton稀释的anti-neurofilament-200(NF200)和anti-LRP1孵育过夜,过后用Alexa Flour 488/555荧光二抗室温孵育1 h,最后用Dapi封片。
4.细胞免疫化学染色:将培养的皮层神经元细胞用4%的多聚甲醛固定,0.1%Triton破膜30 min,PBS冲洗后,滴加5%的BSA室温1 h,然后加入anti-NF200并于4孵育过夜,过后用荧光二抗Alexa Flour 488孵育1 h,PBS冲洗3次后Dapi封片。
5.Western blotting:收集细胞裂解后提取蛋白并检测蛋白浓度,将30 μg的样品进行SDS-PAGE凝胶电泳。加入Anti-pTrkC(1:1 000,Cell Signaling Technology),anti-tTrkC(CST),pERK或tERK (1:1 000,CST)。并4℃冰箱孵育过夜,相应二抗室温孵育2 h,TBST冲洗3次5 min,并用ECL显色后,由quantity-one软件系统计算分析蛋白表达量。
6.行为学检测:所有小鼠在手术前均接受训练,将其放入旷场中每天分为十个训练部分,每个部分5 min,为术后检测其运动功能恢复的旷场实验做准备,还于步态仪上进行步态训练,每天7个训练部分,每部分5 min。
(1)旷场实验:在空旷的场地中对术后小鼠进行运动功能恢复的检测,每只动物均在旷场中自由活动4 min,通过两个观察者对不同处理组的小鼠的运动能力予以盲测评分。所有小鼠均与术后1、3、7、14、21、28 d予以检测评分。
(2)步态分析:大鼠后肢运动功能评分(basso monse scale,BMS)大于5分的小鼠方可进行此项检测,此检测用来评估术后小鼠感觉运动协调能力的恢复情况,小鼠走过长约1 m的步态分析仪,错误步态(比如踏空)会被电脑自动记录并予以统计分析,小鼠均于术后14、21、28天予以检测。
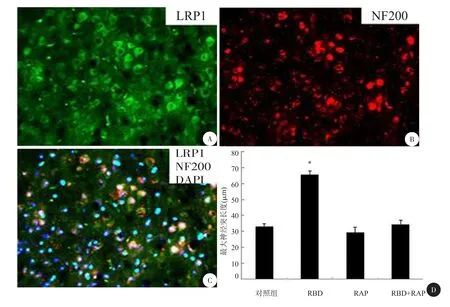
图1 LRP-1在对照组、RBD、RAP与RBD+RAP组小鼠的活化程度
四、统计学处理
采用SPSS 13.0软件进行统计分析,对照组与RBD组,RAP组间的LRP-1,NF200及BMS评分等均数的比较采用单因素方差分析,用LSD-t检验比较两两之间的差异,P<0.05为差异有统计学意义。
结果
一、LRP1的免疫荧光表达
LRP1表达在神经元中,活化后增加了神经突的生长通过对正常C57小鼠脊髓进行LRP1和NF200的免疫荧光双标,显示LRP1与NF200共定位(图1A),证实其表达于脊髓神经元中。分离的神经元培养18 h后,NF200分别标记RBD处理组和未处理组后显示处理组比未处理组神经突长2倍以上。(图1BP<0.01)在神经元培养中我们又增添了单独加入LRP1拮抗剂RAP组和RBD&RAP组,结果显示,当只加入RAP后并未显示促进神经突生长的作用,但RAP明显降低了RBD的促增长效应,以上数据显示,LRP1活化明显促进神经突的生长。
二、LRP1配体通过反式激活LRP1受体在神经元中活化了TrkC信号通路
之前有研究显示,LPR1依赖的信号通路在PC12细胞中可以通过反式激活TrkA促进神经突的生长[5-7]。为了揭示RBD在促进C57胎鼠神经元中神经突生长的分子机制,进一步检测了LRP1激动剂RBD是否可以激活TrkC。在神经元培养过程中加入RBD后30 min,对TrkC进行定量分析显示与对照组相比TrkC表达明显升高(P<0.05)(图2A),为了确定TrkC的活化是否是LRP1依赖度的信号通路所必须的,进一步证实,加入RBD后明显激活了ERK,并且这种活化作用可被TrK抑制剂k252a阻止(图2B)。所以,认为LRP1依赖的信号通路需要TrkC的活化。然而,在培养的神经元中LRP1激动剂可能也可以通过TrkA和B受体激活ERK,但是在联合加入RBD和k252a后,pERK几乎完全降低到基线水平,最终证实了TrkC的活化在LRP1依赖的信号通路中的重要性。
三、鞘内注射RBD促进脊髓损伤后运动功能的恢复
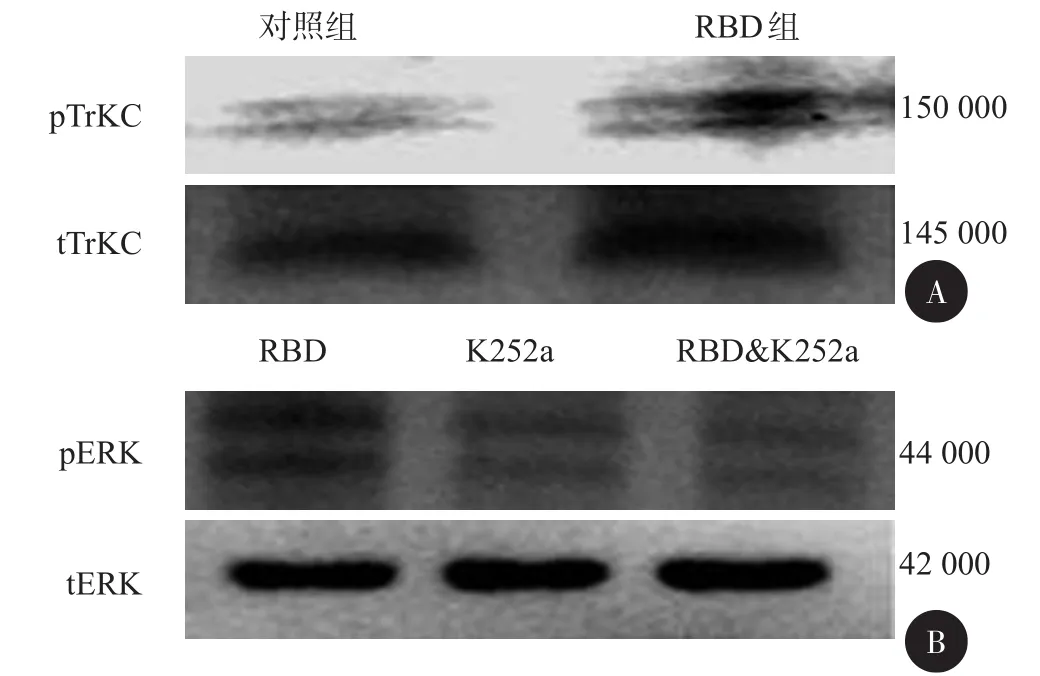
图2 不同组间采用immunoblot检测的表达
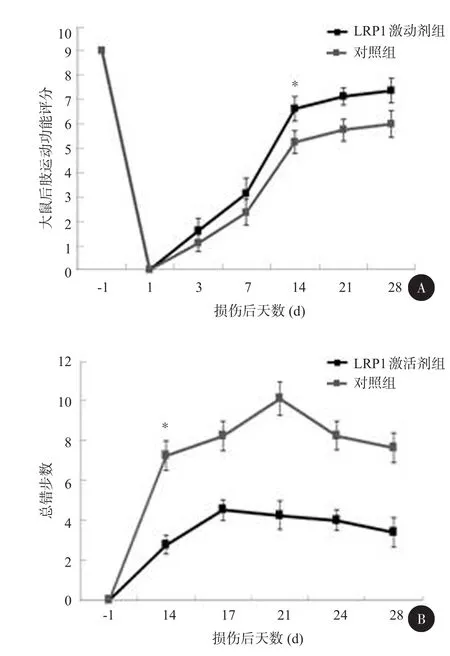
图3 RBD组与对照组小鼠的旷场实验结果
在体外实验中,已经证实LRP1依赖的信号通路可以促进神经突的生长,接下来想揭示LRP1激动剂是否会促进脊髓损伤后的功能恢复,通过旷场试验及步态分析分别对两组术后小鼠的功能修复进行检测,结果显示,损伤后14 d RBD注射组运动功能恢复较对照组明显提高(P<0.05)(图3)。
讨论
低密度脂蛋白受体相关蛋白1(LRP1)是LDL受体超家族成员,最初是作为ApoE和淀粉样蛋白Aβ的内吞受体被发现的,现在被认为是组织型纤溶酶原激活剂(tPA)、基质金属蛋白酶-9(MMP-9)和活化的α2巨球蛋白等多种配体的细胞信号受体[8-10]。LRP1激活剂通过NPXY的酪氨酸磷酸化激活细胞信号通路[11]。在施旺细胞中,LRP1激活PI3K/Akt介导细胞存活信号通路和抵抗胞浆内质网应激[12]。LRP1也可以和其它受体相互作用,包括结合素类,PDGF受体和uPAR[13]。总之,LRP1在细胞的信号通路、代谢、迁徙和血脑屏障的完整性中都发挥着重要作用。
LRP1广泛表达于未损伤的中枢及外周神经系统,近年来报道显示,LRP1可能在神经的功能和生长中有重要的作用[14-15]:(1)外周神经损伤后LRP1在施旺细胞中发挥促生存及迁徙受体功能。(2)在对多发性硬化模型研究中证实LRP1转导信号可以吞噬降解的髓磷脂。(3)LRP1调节淀粉样前蛋白的加工。(4)最近研究证实LRP1激动剂在SFK依赖的通路中可以反式激活TrkA,促进PC12细胞神经轴突生长[16-17]。
本研究为促进轴突损伤后修复与再生提供了一个新的方向,并初步探讨了其促进轴突再生的分子机制。LDL基因家族受体的激动剂,诱导Trk信号通路激活,导致ERK和Akt活化,结果明显促进神经突的生长,并且鞘内注射LRP1激动剂后亦显著促进小鼠脊髓损伤后的功能修复。这些结果显示脂蛋白受体靶点能激活与轴突相关的细胞信号通路。此外本研究中通过鞘内注射LRP1激动剂明显促进脊髓损伤后的运动功能恢复,但是研究中使用的为条件性脊髓损伤,其与临床病例相关但仍有其局限性。
[1]Gotthardt M,Trommsdorff M,Nevitt MF.Interactions of thelow density lipoprotein receptor gene family with cytosolic adaptor and scaffold proteins suggest diverse biological functions in cellular communication and signal transduction[J].J Biol Chem,2000,275(33):25616-25624.
[2]Gonias SL,Wu L,Salicioni AM,et al.Low density lipoprote in receptor related protein:regulation of the plasma membrane proteome[J].Thromb Haemost,2004,91(6):1056-1064.
[3]Bacskai BJ,Xia MQ,Strickland DK,et al.The endocytic receptor protein LRP also mediates neuronal calcium signaling via N-methyl-D-aspartate receptors[J].Proc Natl Acad Sci, 2000,97(21):11551-11556.
[4]Herz J,Clouthier DE,Hammer RE et al.LDL receptor-related protein internalizes and degrades uPA-PAI-1 complexes and is essential for embryo implantation[J].Cell,1992,71(3):411-421.
[5]Hussaini IM,LaMarre J,Lysiak JJ,et al.Transcriptional regulation of LDL receptor-related protein by IFN-gamma and the antagonistic activity of TGF-beta(1)in the RAW 264.7 macrophage-like cell line[J].J Leukoc Biol,1996,59(5):733-739.
[6]Salicioni AM,Gaultier A,Brownlee C,et al.Low density lipoprotein receptor-related protein-1 promotes beta1 integrin maturation and transport to the cell surface[J].J Biol Chem, 2011,279(1):10005-10012.
[7]Muratoglu SC,Mikhailenko I,Newton C,et al.Low density lipoprotein receptor-related protein 1(LRP1)forms a signaling complex with platelet-derived growth factor receptor-beta in endosomes and regulates activation of the MAPK pathway[J].J Biol Chem,2010,285(19):14308-14317.
[8]Gonias SL,Gaultier A,Jo M.Regulation of the urokinase receptor(uPAR)by LDL receptor-related protein-1(LRP1)[J]. Curr Pharma Des,2000,17(19):1962-1969.
[9]Mantuano E,Jo M,Gonias SL.Low density lipoprotein receptorrelated protein(LRP1)regulates Rac1 and RhoA reciprocally to control Schwann cell adhesion and migration[J]. J Biol Chem,2010,285(19):14259-14266.
[10]Gaultier A,Wu X,Le Moan,et al.Lowdensity lipoprotein receptor-related protein 1 is an essential receptor for myelin phagocytosis[J].J Cell Sci,2009,122(Pt8):155-162.
[11]Shi Y,Mantuano E,Inoue G,et al.Ligand binding to LRP1 transactivates Trk receptors by a Src family kinase-dependent pathway[J].Sci Signal,2009,2(68):8.
[12]Blesch A,Lu P,Tsukada S,et al.Conditioning lesions before or after spinal cord injury recruit broad genetic mechanisms that sustain axonal regeneration:superiority to camp-mediated effects[J].Exp Neurol,2012,235(1):162-173.
[13]Grimmer T,Goldhardt O,Guo LH,et al.LRP-1 polymorphism is associated with global and regional amyloid load in Alzheimer's disease in humans in-vivo[J].Neuroimage Clin, 2014,4(2):411-416.
[14]Tuszynski MH,Steward O.Concepts and methods for the study of axonal regeneration in the CNS[J].Neuron,2012,74(4):777-791.
[15]Liu Q,Trotter J,Zhang J,et al.Neuronal LRP1 knockout in adult mice leads to impaired brain lipid metabolism andprogresive age dependent synapse loss and neurodegeneration[J].J Neurosci,2010,30(50):17068-17078.
[16]Thevenard J,Verzeaux L,Devy J,et al.Low-density lipoprotein receptor-related protein-1 mediates endocytic clearance of tissue inhibitor of metalloproteinases-1 and promotes its cytokine-like activities[J].PLoS One,2014,9(7):30.
[17]Campana WM,Li X,Dragojlovic.The lowdensity lipoprotein receptor-related protein is a pro-survival receptor in Schwann cells:possible implications in peripheral nerve injury[J].J Neurosci,2006,26(43):11197-11207.
The activation of low density lipoprotein receptor related protein-1 dependent cell signaling pathway promotes axon growth and repair of nerve injury
Li Chao1,Ou Yangjia2,Zhu Jun1.
1North China University of Science and Technology,Tangshan 063009,China;2Faculty of Basic Medical Science Nanchang University,Nanchang 330031,China
Corresponding author:Zhu Jun,Email:zhujun@126.com
ObjectiveTo investigate the effects of the low density lipoprotein receptors-1 (LRP1)dependent signal pathway in axonal growth and nerve regeneration after injury.MethodsAdding RBD,LRP1 agonist,when culture the cortical neurons of fetal rats,observing whether it can promote the growth of synapses and what the signal mechanism it is compared with the control group. In addition,observing the effects of RBD on the repair of nerve injury through building the spinal cord injury model of rats up and intrathecal inject the RBD.ResultsThe activation of neurotrophic factor receptor TrkC,Akt signal transduction pathway and extracellular regulated protein kinase(ERK) which were induced after add RBD in cortical neuron in vitro.The results of quantitative analysis of expression between the intervention group and the control group were significantly increased (P<0.05),the growth of neurite were promoted.The recovery of motor function after spinal cord injury scores were significantly improved after the intrathecal injection of RBD in mice.ConclusionThe activation of signal pathway dependented by LRP1 can obviously promote the growth of axon and repair functions of rats after the spinal injury.
Low density lipoprotein receptor-related protein-1;Spinal cord injuries; Ethology;Wound healing
2015-03-13)
(本文编辑:杨艺)
10.3877/cma.j.issn.2095-9141.2015.02.010
063009唐山,华北理工大学医学院1;330031,南昌大学基础医学院2
朱军,Email:zhujun@126.com
李超,欧阳佳,朱军.激活低密度脂蛋白受体相关蛋白-1依赖的细胞信号通路可促进轴突生长及神经损伤修复[J/CD].中华神经创伤外科电子杂志,2015,1(2):95-99.
