创伤性脑损伤后大鼠脑线粒体功能的变化
2015-06-13王娟程岗王亚明方丹东李志超张剑宁
王娟 程岗 王亚明 方丹东 李志超 张剑宁
·基础研究·
创伤性脑损伤后大鼠脑线粒体功能的变化
王娟 程岗 王亚明 方丹东 李志超 张剑宁
目的通过改进型Feeney自由落体脑损伤装置制作大鼠重型颅脑损伤模型,检测损伤后不同时间点脑皮质组织线粒体功能的变化。方法雄性SD大鼠30只,按随机数字表法分为假手术组(n=5)和创伤性脑损伤(TBI)组(n=25),TBI组按伤后不同时间点(12 h、1 d、3 d、5 d、7 d)又分为5个亚组,每组分别5只动物。采用尼氏染色观察神经细胞损伤;采用多功能酶标仪检测线粒体膜电位(MMP)、H+-ATPase活性、三磷酸腺苷(ATP)含量,观察TBI后脑皮质线粒体功能的变化。结果TBI后尼氏染色结果显示,脑皮质神经元染色12 h组较假手术组神经元减少,1 d组更少,3 d组染色最少。MMP、H+-ATPase活性、ATP含量在伤后均下降,且3 d组最低,相较于假手术组有显著性差异(P<0.05)。结论TBI后脑皮质线粒体功能呈现先下降、后上升的趋势,尚可恢复部分功能,这对TBI后脑保护的机制研究提供了一定的实验基础,对脑损伤者进行有效的保护至关重要。
线粒体;大鼠;颅脑创伤
创伤性脑损伤(traumatic brain injury,TBI)是指由外伤因素而引起的脑组织损伤。它是神经外科最常见的疾病,也是导致创伤患者伤残及死亡的主要原因。TBI引起一系列复杂的病理机制,包括兴奋性氨基酸的神经毒作用、线粒体功能障碍、氧自由基堆积、炎性因子刺激等[1]。众多的研究显示,线粒体能量代谢障碍在TBI的继发性脑损伤中发挥着重要作用,而观察不同时期线粒体的功能的变化趋势对研究能量代谢障碍至关重要。本研究针对创伤性脑损伤后大鼠脑线粒体的改变进行分析,以期发现其中的规律和意义。
材料与方法
一、实验材料
1.动物:成年健康雄性Sprague-Dawley大鼠(SPF级),3~4个月龄,体质量220~250 g,由北京维通利华实验动物技术有限公司提供。
2.试剂及仪器:罗丹明123、二磷酸腺苷(adenosine diphosphate,ADP)购于Sigma公司(美国);三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒、蛋白浓度测定试剂盒均购于碧云天生物技术研究所。其余化学试剂均为国产分析纯。多功能酶标仪varioskan购于Thermo公司;台式冷冻离心机CR22G购于HITACHI公司;TLL-C台式高速冷冻离心机购于北京四环科学仪器厂有限公司。以上仪器均由军事医学科学院基础研究所应激医学教研室提供。
二、实验方法
1.动物分组:选择雄性SD大鼠30只,按随机数字表法分为假手术组(n=5)和TBI组(n=25),TBI组按伤后不同时间点(12 h、1 d、3 d、5 d、7 d)又分为5个亚组,每组分别5只动物。各组动物实验期间均处于相同饲养环境,并给予充足的饲料和饮用水。
2.动物模型:所有动物注射麻醉剂后固定于脑立体定位仪,头部备皮并常规消毒。沿中线切开顶部头皮,人字缝及冠状缝中线旁开左侧顶骨3 mm,用牙科钻打开一直径5 mm的骨窗。单纯TBI组参照Feeney自由落体脑损伤装置[2],制作改进型Feeney自由落体脑损伤装置[3],打击强度为20 g× 35 cm,致轻至中度脑损伤模型。假手术组仅钻开骨窗,而不打击致伤,同1 d组处死。
2.组织切片制备及尼氏染色:动物麻醉后开胸腔经心快速注入250 ml生理盐水,再4%多聚甲醛灌注。断头取脑,后固定2 h,常规脱水、透明、石蜡包埋、冠状切片,切片厚度6 μm。制备焦油紫工作液,切片放入,37℃6 h后取出洗去浮色,70%酒精洗涤,分色液去底色。逐级酒精脱水、透明、封片。相邻切片行HE染色。
3.线粒体提取及测定:动物达致伤时间点后迅速断头取脑,4℃的生理盐水中洗涤数次,取损伤侧大脑半球去除脑干和小脑,皮层称重后立即剪碎(0.1 mm3)、匀浆,加入12 ml悬浮缓冲液,冰浴下匀浆,梯度差速离心后,所得沉淀物即为线粒体。使用2 ml悬浮缓冲液轻轻吹打致所有沉淀悬浮待用。
检测线粒体膜电位(mitochondrial membrane potential,MMP):参照Clark等[4]方法,线粒体悬液使用Bradford法蛋白定量。检测板中加入200 μl反应液,再加入0.2 mmol/L罗丹明123 1 μl,混匀后测定基础荧光值F1(激发波长为507 nm,发射波长为530 nm)。加入线粒体200 μg,混匀后室温避光下孵育20 min,再次测定荧光值F2。ΔΨm(ΔΨm=F1-F2)反应线粒体膜电位的大小。
检测线粒体H+-ATPase活性:稀释液按1:100的比例配适量的ATP检测工作液。检测板中加入工作液100 μl,室温避光放置。加入10 μl稀释后的线粒体悬液及1 μl ADP溶液(1 mmol/L),混匀。检测发光强度,设定为15 s/次,共测10次。绘制的曲线,以斜率表示线粒体H+-ATPase活性。
4.ATP提取及含量检测:取30 mg皮层组织称重后立即剪碎(0.1 mm3),电动匀浆器中加入ATP裂解液冰浴匀浆。12 000×g,4℃离心15 min后,取全部上清液。配置梯度ATP标准液、ATP检测试剂工作液。检测板中加入工作液100 μl,每孔加入6个浓度梯度的ATP标准液及样品100 μl混匀,检测发光强度,根据标准曲线计算各组ATP的总含量A (nmol)。用BCA法测定各组的蛋白总量B(mg)。ATP的含量用A/B来表示。
三、统计分析
采用SPSSl7.0软件对数据进行分析。MMP、H+-ATPase、ATP含量符合正态分布,以均数±标准差(x±s)表示,组间比较应用方差分析,组内比较应用单因素方差分析,P<0.05为差异有统计学意义。
结果
一、伤后动物状态的改变
脑损伤组动物手术后均存活,未出现颅骨骨折。撞击伤后出现短暂的呼吸暂停(约5~10 s),随即可恢复至正常呼吸频率;伤后心率同伤前无明显变化。手术后3~4 h动物苏醒,当天活动少,步态紊乱,刺激反应稍减弱。伤后1~3 d动物均可自由进食、饮水,较伤前饮食减少,无肢体瘫痪或活动受限。假手术组动物麻醉苏醒后,全身状态良好,饮食状况较好,反射活动正常,后肢协调性良好。实验过程中无动物死亡。
二、病理改变
取材时可见相较于假手术组,伤后12 h左侧顶叶受撞击处皮质呈紫红色,明显肿胀;伤后1 d受撞击处皮质呈紫红色且肿胀,但是较12 h组稍浅。两组镜下观察,挫裂伤灶周围皮质及皮质下白质均有不同程度的出血,胼胝体、小脑上臂、脑干等处可见散在的点片状出血灶,符合TBI改变。伤后3 d,出血基本吸收。伤后5 d、7 d,肉眼可见已无出血灶,镜下可见坏死空洞被类似纤维肉芽组织物所填充。
尼氏染色结果显示,TBI组脑皮质神经元染色显示先减少后稍增多。12 h组较假手术组神经元减少,细胞轮廓清楚;1 d组更少;3 d组染色最少,仅显示与底色相似的浅蓝色胞质结构,增生胶质细胞核染色明显;5 d神经元可见较3 d时增多,但仍比假手术组少;7 d组较5 d组增多,但仍比假手术组少。
三、线粒体MMP检测结果
TBI组较假手术组线粒体膜电势呈现先下降、后上升。伤后12 h时线粒体膜电位较假手术组稍有升高;1 d、3 d、5 d组的下降均较假手术组有显著性差异(P<0.05),3 d组最低;各组间线粒体功能无显著变化。这说明TBI后大鼠脑组织线粒体功能先一过性升高,再下降(P<0.05),一定时间后逐渐恢复线粒体功能,却不能达到未损伤前水平(图1)。
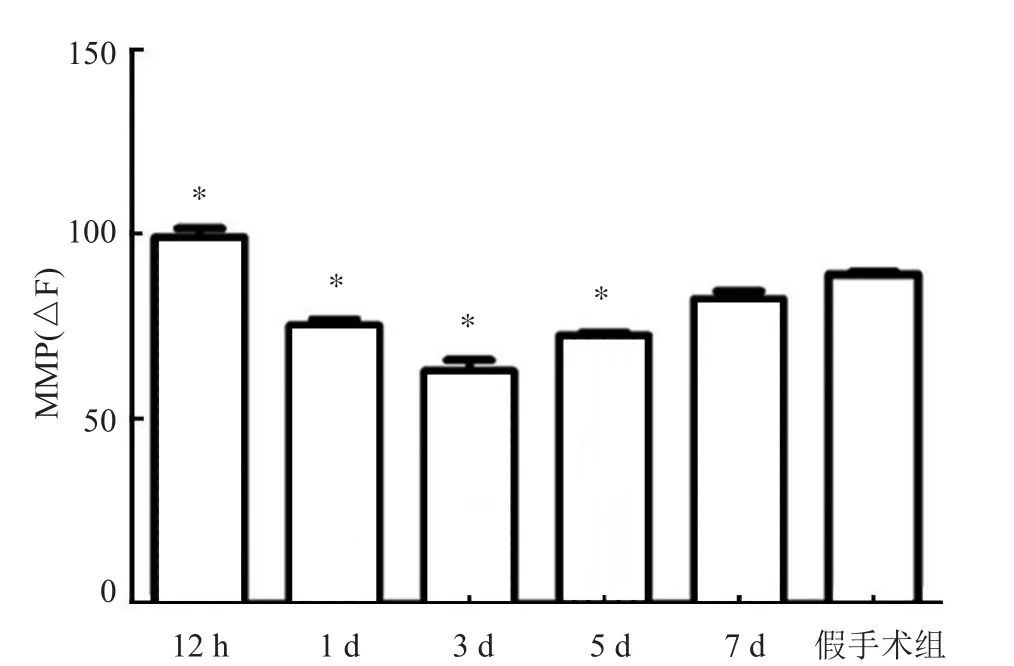
图1 TBI后大鼠脑组织中线粒体膜电位的变化
四、线粒体H+-ATPase活性的改变
TBI组较假手术组大鼠脑线粒体H+-ATPase活性呈现先下降、后上升的趋势。1 d、3 d组的下降均相较于假手术组有显著性差异(P<0.05),3 d组最低;各组组间线粒体功能无显著变化。TBI后大鼠脑组织线粒体功能显著下降,一定时间后可逐渐恢复线粒体功能,却不能达到未损伤前水平(图2)。
五、线粒体ATP含量测定
TBI组较假手术组线粒体ATP含量呈现先下降、后上升的趋势。1 d、3 d、5 d、7 d组的下降均相较于假手术组有显著性差异,且3 d组最低;各组组间线粒体功能无显著变化。这说明TBI后大鼠脑组织线粒体功能呈现显著下降,差异有统计学意义(P<0.05),但在一定时间后可逐渐恢复线粒体功能,却不能达到未损伤时水平(图3)。

图2 TBI后大鼠脑组织中线粒体H+-ATPase活性的变化
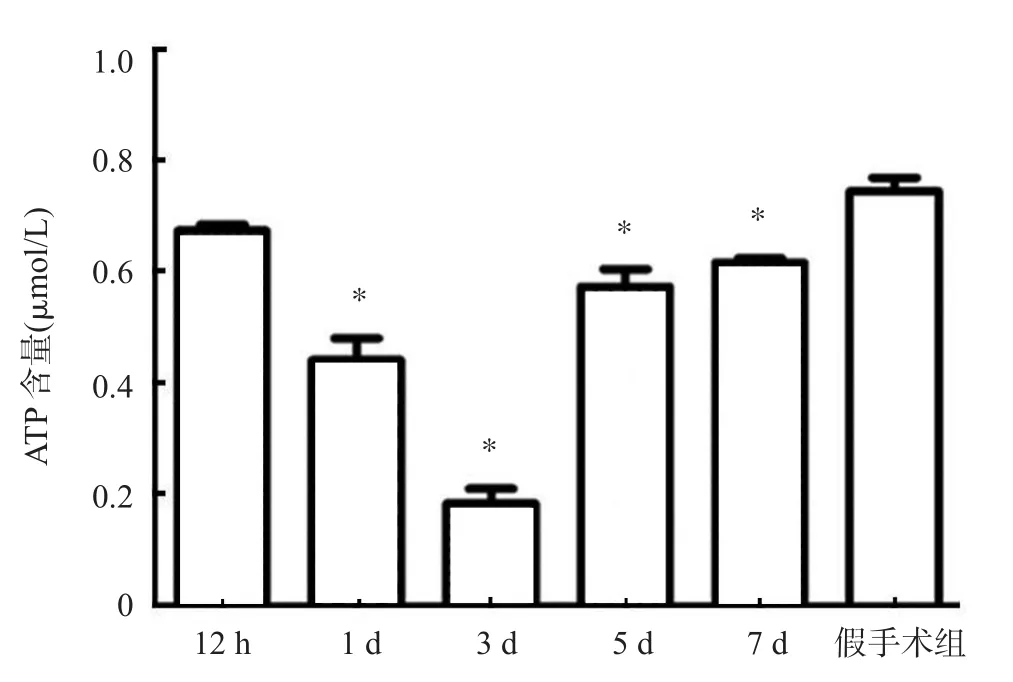
图3 TBI后大鼠脑组织中ATP含量的变化
讨论
TBI发生率及致死、致残率之高成为了当今威胁人类生命健康的重要疾患之一[5]。TBI也是最常见的创伤类型,其发生率明显高于其他部位的创伤,且以开放性颅脑外伤为主[6]。TBI后一系列复杂的病理机制相继发生,包括兴奋性氨基酸的神经毒作用、氧自由基堆积、炎性因子刺激、线粒体功能障碍等。继发性脑损伤表现为伤后一系列复杂的病理生理学过程,是脑损害发生、发展的重要原因。
线粒体中的一系列代谢过程与细胞凋亡密切相关,如呼吸链中氧自由基的过度生成、线粒体膜通透性转运孔异常开放、凋亡诱导因子与线粒体细胞色素C释放等。TBI后继发性损伤中,细胞兴奋毒性、Ca2+超载、活性氧、Bcl-2家族及凋亡诱导因子均参与以线粒体为中心的细胞损伤过程。脑线粒体缺氧在早期主要是由于创伤后脑水肿、脑肿胀、颅内压升高、脑血管舒缩功能障碍以及伤后呼吸暂停窒息等原因造成的急性缺氧,此后由于细胞代谢产物积聚加重缺氧而出现慢性缺氧。越来越多的临床研究证实脑线粒体的功能障碍与许多神经退行性疾病相关[8]。近期有研究发现在凋亡过程中线粒体的裂解数量增加,抑制线粒体的裂解在大脑皮层缺血后再灌注情况下能保护皮层神经元[9]。另有研究表明,抑制线粒体Ca2+单向转运体可以保护大脑免受缺血后再灌注损伤,减少梗死面积、自由基的生产和线粒体肿胀[10]。故而,在继发性脑损伤后这一阶段研究神经细胞,特别是细胞功能障碍方面,如线粒体功能变化,对于保护TBI后损伤的神经元细胞并且修复、治疗有重要的实际意义。
本实验中建立了轻至中度脑损伤动物模型,选择多个时间点来观察TBI后皮质组织中细胞线粒体的功能变化,观察到不同时间点的表达变化。本实验着重对线粒体功能的几个重要指标进行观测,相较以往的实验研究,能更直观地反映线粒体功能。随着损伤时间的延续,发现线粒体MMP、ATP含量以及线粒体H+-ATPase活性都反映出相同的变化趋势。结果说明TBI后由于一定的应激性反应,大鼠脑组织线粒体功能先一过性升高,再显著下降,但在一定时间后可逐渐恢复线粒体功能,却不能达到未损伤前水平。
综上所述,观察到损伤后不同时间点的线粒体功能变化,这对于进一步研究损伤区域神经元细胞的修复有重要的意义。其中,损伤后3 d的线粒体各项功能最低点是采取保护性措施的重要依据。有研究报道,在蛛网膜下腔出血后,若能早期阻滞继发性脑损伤,患者的预后会得到极大地改善[11]。这也对进一步损伤后脑保护的治疗提供一定的实验基础,为今后能在损伤早期采取治疗措施有着重要的意义。
[1]Yokobori S,Mazzeo AT,Gajavelli S,et al.Mitochondrial neuroprotection in traumatic brain injury:rationale and therapeutic strategies[J].CNS Neurol Disord Drug Targets, 2014,13(4):606-619.
[2]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:I.Methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):67-77.
[3]王清华,徐如祥,李良平,等.大鼠不同程度脑损伤模型的建立[J].创伤外科杂志,2000,2(1):42-44.
[4]Clark JB,Nicklas WJ.The metabolism of rat brain mitochondria.Preparation and characterization[J].J Biol Chem, 1970,245(18):472-473.
[5]张剑宁,程岗.我国海上颅脑战创伤研究现状[J].中华神经外科杂,2012,28(2):211-213.
[6]McCarthy ML,Dikmen SS,Langlois JA,et al.Self-reported psychosocial health among adults with traumatic brain injury [J].Arch Phys Med Rehabil,2006,87(7):953-961.
[7]Cheng G,Kong RH,Zhang LM,et al.Mitochondria in traumatic brain injury and mitochondria-targeted multipotential therapeutic strategies[J].Br J Pharmacol,2012,167(4):699-719.
[8]Reddy PH,Reddy TP.Mitochondria as a therapeutic target for aging and neurodegenerative diseases[J].Curr Alzheimer Res, 2011,8(17):393-409.
[9]Zhao Q,Wang S,Li Y,et al.The role of the mitochondrial calcium uniporter in cerebral ischemia/reperfusion injury in rats involves regulation of mitochondrial energy metabolism[J]. Mol Med Rep,2013,7(4):1073-1080.
[10]Yu N,Wang S,Wang P,et al.The calcium uniporter regulates the permeability transition pore in isolated cortical mitochondria [J].Neural Regen Res,2012,7(2):109-113.
[11]Sehba FA,Hou J,Pluta RM,et al.The importance of early brain injury after subarachnoid hemorrhage[J].Prog Neurobiol, 2012,97(1):14-37.
Changes of mitochondrial function in rat brain after traumatic brain injury
Wang Juan, Cheng Gang,Wang Yaming,Fang Dandong,Li Zhichao,Zhang Jianning.
Department of Neurosurgery,NavyGeneral Hospital,Beijing 100048,China
Corresponding author:Zhang Jianning,Email:zhangjianning@163.com
ObjectiveTo set up severe rats traumatic brain injury(TBI)model through modified Feeney free fall brain injury device and investigate the pathogenesis on brain cortical tissue mitochondrial function changes in different time.MethodsThirty adult male Sprague-Dawley(SD) rats were used in the study and randomly divided into 2 groups,sham operation group(n=5)and TBI group(n=25).TBI group was divided into five subgroups at different time points after injury(12 h,1 d, 3 d,5 d,7 d)and five rats in each subgroup.The damage of neuron was observed by Nepal's staining. Mitochondrial membrane potential(MMP),H+-ATPase activity and adenosine triphosphate(ATP) content were tested by multifunctional enzyme-labeled instrument to observe the changes of cerebral cortex mitochondria after TBI.ResultsThe post-TBI Nissl staining showed that compared with the sham group,the cortical neurons reduced in staining 12 h group,1 d group more less,and 3 d group was the least.The MMP,activity of H+-ATPase and the content of ATP all decreased after injury,and 3 d group was the least,which had a significant difference compared to the sham operation group(P<0.05).ConclusionsThe post-TBI mitochondrial function in cerebral cortex first decreased and then increased,which can restore some function.This has provide a certain experimental basis on the research of post-TBI brain protection mechanism,and showed an importance to effective protection on brain injury patients.
Mitochondia;Rats;Craniocerebral trauma
2015-02-13)
(本文编辑:杨艺)
10.3877/cma.j.issn.2095-9141.2015.02.009
国家自然科学基金资助项目(81372128)
100048北京,海军总医院神经外科
张剑宁,Email:zhangjianning@163.com
王娟,程岗,王亚明,等.创伤性脑损伤后大鼠脑线粒体功能的变化[J/CD].中华神经创伤外科电子杂志,2015,1(2):91-94.
