蚯蚓与菌根提高玉米生长和氮磷吸收的互补效应
2015-06-12汪顺义
李 欢, 王 冲, 汪顺义
(1 青岛农业大学资源与环境学院, 山东青岛 266109; 2 中国农业大学资源与环境学院, 北京 100193)
蚯蚓与菌根提高玉米生长和氮磷吸收的互补效应
李 欢1, 2, 王 冲2*, 汪顺义1
(1 青岛农业大学资源与环境学院, 山东青岛 266109; 2 中国农业大学资源与环境学院, 北京 100193)
【目的】蚯蚓和丛枝菌根真菌处于不同的营养级,但在促进植物生长和提高土壤肥力等方面却都发挥着积极作用。研究蚯蚓菌根互作及其对玉米吸收土壤中的氮、磷养分的影响,可为提升土壤生物肥力及促进农业的可持续发展提供理论依据。【方法】本研究采用田间盆栽方式,以玉米为供试作物,研究蚯蚓(Eiseniafetida)与丛枝菌根真菌(Glomusintraradices)互作及其对玉米养分吸收的影响。试验设置P 25和175 mg/kg两个水平。每个磷水平进行接种与不接种菌根真菌以及添加与不添加蚯蚓,共8个处理。调查了玉米生长、养分吸收以及真菌浸染和土壤养分的有效性。【结果】两个磷水平下,蚯蚓和菌根在增加玉米地上部和根系生物量方面有显著正交互作用(P<0.05)。接种菌根真菌的各处理显著增加了玉米的侵染率及泡囊丰度、根内菌丝丰度等菌根指标。同时添加蚯蚓和接种菌根真菌的处理 (AM+E) 显著提高了菌根的侵染率、菌丝密度、丛枝丰度和根内菌丝丰度但是泡囊丰度有所下降。两种磷水平下,AM+E处理玉米地上部和地下部含氮量和含磷量均显著高于其他三个处理。在低磷条件下,地上部氮磷总量的增加分别是添加蚯蚓和接菌的作用;而地下部磷总量的增加主要是菌根真菌的作用。在高磷条件下,单加蚯蚓显著增加玉米氮磷的总量,而接种菌根真菌对玉米氮磷吸收的影响未达显著性水平。在高磷条件下,单加蚯蚓的处理显著提高玉米地上地下部生物量 (P<0.05),而单接菌的处理效应不显著,蚯蚓菌根互作通过提高土壤微生物量碳、氮实现对玉米生长和养分吸收的调控。在低磷条件下,单接菌显著提高了玉米的生物量 (P<0.05),单加蚯蚓的处理具有增加玉米生物量的趋势。菌根真菌主要促进玉米对磷的吸收,蚯蚓主要矿化秸秆和土壤中的氮磷养分增加土壤养分的有效性,蚯蚓菌根互作促进了玉米根系对土壤养分的吸收并形成氮磷互补效应。【结论】无论在高磷还是低磷水平下,蚯蚓菌根相互作用都提高了玉米地上地下部生物量、氮磷吸收量同时提高了土壤微生物量碳、氮。蚯蚓菌根相互作用对植物生长的影响取决于土壤养分条件。在高磷条件下 (氮相对不足),蚯蚓菌根互作通过调控土壤微生物量碳、氮调控玉米生长和养分吸收。低磷条件下,菌根主要发挥解磷作用,蚯蚓主要矿化秸秆和土壤中的氮素,蚯蚓和菌根互补调控土壤中氮、磷,从而促进植物的生长和养分吸收。
丛枝菌根真菌; 蚯蚓; 交互作用; 氮磷互补
土壤生物是地下生态系统的核心,在土壤有机质分解、矿质营养循环、维持及提高土壤肥力方面发挥着关键作用[1]。蚯蚓通过取食、消化、排泄(蚯蚓粪)、分泌(粘液)和掘穴等活动影响土壤过程的物质循环和能量传递,被称为“生态系统工程师”[2]。丛枝菌根真菌(AM真菌)与植物形成同生体,一方面从植物那里获得光合产物供其自身生长,另一方面为植物提供养分,促进植物生长[3]。因此研究植物根系、蚯蚓和AM菌根之间的相互作用对土壤肥力的影响,对于提高作物对土壤养分的吸收与利用、促进土壤健康具有重要意义。
蚯蚓和AM 真菌处于不同的营养级并且不存在直接的捕食与被捕食关系,但是在促进植物生长、提高土壤肥力等方面都发挥着积极的作用[4]。在贫瘠的土壤上,蚯蚓可以通过增加养分的有效性而对AM侵染产生积极作用。在没有施肥(低碳、低氮、低磷)的土壤上,添加热带蚯蚓Pontoscolexcorethrurus能够显著提高菌根侵染率[5]。Gormsen等[6]研究表明,蚯蚓能够促进植物的生长,植物生物量的增加为菌根真菌提供更多的碳源,从而利于根外菌丝的发育。此外,蚯蚓活化土壤中的无机氮以及土壤中的有机氮都会促进菌丝的生长[7-8]。蚯蚓和菌根能够通过互补的途径影响植物的生长和养分吸收[9]。
蚯蚓菌根互作大多是在室内盆栽条件下进行的,这就忽略了气候、土壤养分等影响因素[10]。另外,土壤微生物量不仅影响土壤有机碳而且影响土壤养分的有效性[11]。土壤微生物量碳、氮常常作为土壤理化性状改变的早期预警指标[12]。因此,本试验充分模拟自然环境采用田间盆栽的方法研究蚯蚓 (Eiseniafetida) 和菌根真菌 (Glomusintraradices) 交互作用对玉米生长和土壤微生物量的影响,探讨了土壤养分有效性、土壤微生物量碳氮的改变对玉米养分吸收的影响。
1 材料与方法
1.1 试验地概况

1.2 试验材料与试验设计
试验所用塑料盆的规格为220 mm × 250 mm,并将盆子埋入事先挖好的土穴中,盆子的边缘高出地平面3 cm。每个盆子装入4.5 kg过2 mm筛的灭菌土并混合8 g小麦秸秆 (相当于每公顷8 t的秸秆还田量)。盆子底部平铺设30 μm尼龙网便于水分下渗,同时防止蚯蚓逃逸和植物根系长出。另外用孔径为2 mm的尼龙网蒙住整个盆口同时在正中间开一个直径3 cm的小孔,以便于玉米的正常生长。
试验包括3个因子,各设2个水平,其中供磷水平设P 25 和175 mg/kg、菌根真菌设接种与不接种、蚯蚓设添加不添加,共8个处理组合。菌种为根内球囊霉(Glomusintraradices,BEG141),该菌种引自法国农业科学院。以局部接种的方式接种,接种量为5% (W/W)。赤子爱胜蚓(Eiseniafetida)取自当地蚯蚓养殖场。添加蚯蚓前先对蚯蚓进行清肠。具体方法是:将蚯蚓洗净,放于一底部铺有吸水纸并有少量水分的培养箱内培养24 h,次日取出并洗净擦干备用。待玉米长到三叶期后,每盆放入三条大小和活性相同的蚯蚓。

1.3 样品测定

1.4 数据分析
用SPSS (10.0) (SPSS Institute, Inc., Cary, NC, USA) 进行数据统计分析,方差分析检验处理效应的显著性,LSD法比较平均数间的差异显著程度。
2 结果与分析
2.1 不同磷水平下菌根侵染率的变化
不接种菌根真菌 (CK和E) 的处理菌根侵染率都在10%以下,这可能是由于土著AM真菌随风传播的影响。无论在高磷 (175 mg/kg) 还是低磷 (25 mg/kg) 条件下,接种菌根真菌的各个处理显著提高了玉米的侵染率及泡囊丰度、根内菌丝丰度(P<0.05)。同时添加蚯蚓和接种菌根真菌的处理 (AM+E) 显著提高了菌根的侵染率、菌丝密度、丛枝丰度和根内菌丝丰度,但泡囊丰度有所下降 (表1)。蚯蚓菌根互作在低磷条件下差异显著,但在高磷条件下丛枝丰度和菌丝丰度没有达到统计学上的差异。在高磷条件下,接种菌根真菌处理的丛枝丰度、根内菌丝丰度和菌丝密度在添加蚯蚓后没有显著性的变化。而在低磷条件下添加蚯蚓后接种菌根真菌的处理侵染率平均增加了17%,菌丝密度增加了70% (表1)。
2.2 蚯蚓菌根互作对玉米生物量和养分吸收的影响
在低磷条件下,单接菌的处理与对照相比显著提高了玉米地上部和地下部的生物量(P<0.05)。单加蚯蚓的处理与对照相比具有提高玉米生物量的趋势 (表2)。在高磷条件下,单加蚯蚓的处理显著提高了玉米地上部和地下部的生物量 (P<0.05)。无论高磷还是低磷条件下,同时添加蚯蚓和菌根的处理,玉米的生物量均显著高于单接种和对照处理 (P<0.05)。此外,在两种磷水平下同时添加蚯蚓和菌根处理玉米地上部和地下部含氮量和含磷量均显著高于其他三个处理 (P<0.05)。在低磷条件下,地上部氮、 磷总量的增加分别是添加蚯蚓、 菌根真菌的作用,而地下部磷总量的增加主要是菌根真菌的作用 (P<0.05)。在高磷条件下,与对照处理相比,单加蚯蚓显著增加玉米氮、 磷的总量,而在高磷条件下接种菌根真菌对玉米氮、 磷吸收的影响未达显著性水平。
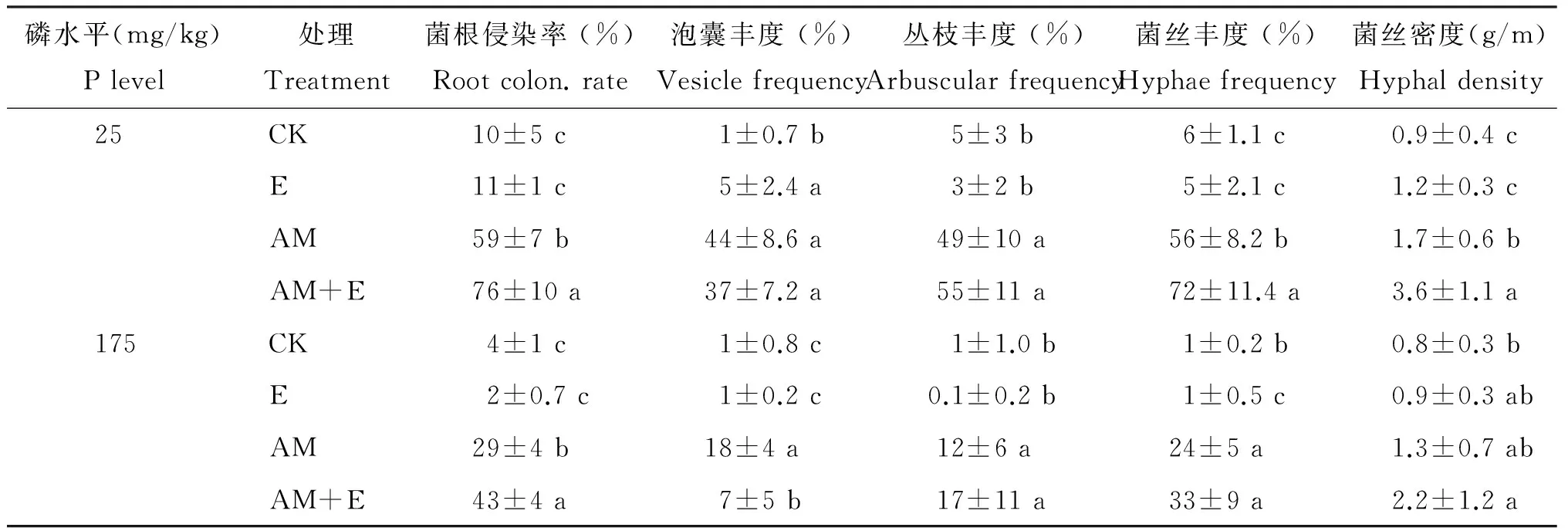
表1 不同磷水平下菌根侵染率、泡囊丰度、丛枝丰度和菌丝密度Table 1 Root colonization rate, vesicle frequency, arbuscular frequency, hyphae and hyphal density at low and high P level
注(Note): CK—不加蚯蚓和菌根No earthworm and mycorrhizae addition; E—只加蚯蚓Earthworm addition; AM—只接种菌根 Mycorrhizal addition; AM+E—同时添加蚯蚓和菌根 Earthworm and mycorrhizae addition. 同列数值后不同小写字母表示处理间差异显著 Values followed by different small letters in a column are significantly different among treatments at 5% level.

表2 不同磷水平下添加蚯蚓和菌根对玉米地上部和根系生长及养分吸收的影响Table 2 Effect of interaction of earthworms and mycorrhiza on shoot and root dry biomass, N, P content and N/P ratio in maize at low and high P level
注(Note): CK—不加蚯蚓和菌根No earthworm and mycorrhizae addition; E—只加蚯蚓Earthworm addition; AM—只接种菌根 Mycorrhizal addition; AM+E—同时添加蚯蚓和菌根 Earthworm and mycorrhizae addition. 同列数值后不同小写字母表示处理间差异显著 Values followed by different small letters in a column are significantly different among treatments at 5% level.
2.3 蚯蚓和菌根互作对土壤有效磷、无机氮和土壤微生物量碳、氮的影响
无论在高磷还是低磷条件下,同时添加蚯蚓和菌根的处理与对照相比降低了土壤有效磷含量。在两种磷水平下,单接菌的处理显著加速了土壤有效磷的耗竭 (P<0.05)。在高磷条件下单加蚯蚓降低土壤有效磷含量,但是在低磷条件下这种影响不显著 (表3)。在两种磷水平下,蚯蚓、菌根及同时添加蚯蚓和菌根的处理均显著降低了土壤硝态氮含量 (P<0.05)。但各个处理对铵态氮含量的影响不显著 (表3)。
与对照相比,其他处理均显著增加了土壤微生物量碳、氮 (表4)。在高磷条件下,同时添加蚯蚓和菌根真菌的处理土壤微生物量碳、氮最高 (P<0.05)。单加蚯蚓处理土壤微生物量碳、氮显著高于单接菌的处理 (P<0.05)。而在低磷条件下蚯蚓处理与菌根处理之间对土壤微生物量碳、氮含量无显著性差异 (表4)。
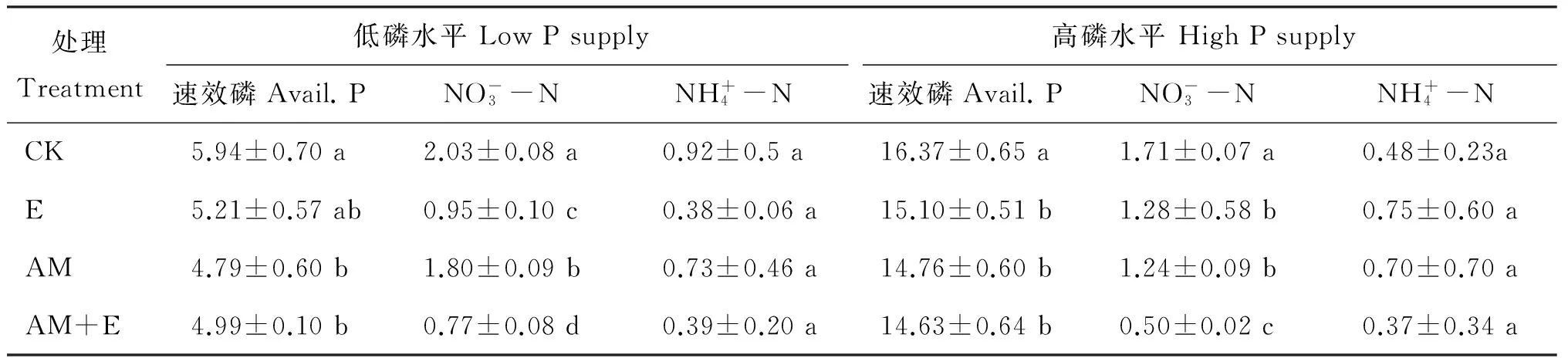
表3 不同磷水平接种蚯蚓、菌根后土壤速效磷和矿质态氮含量 (mg/kg)Table 3 Soil available P and N concentrations after addition of earthworms and AM fungi under low P and high P supply
注(Note): CK—不加蚯蚓和菌根No earthworm and mycorrhizae addition; E—只加蚯蚓Earthworm addition; AM—只接种菌根 Mycorrhizal addition; AM+E—同时添加蚯蚓和菌根 Earthworm and mycorrhizae addition. 同列数值后不同小写字母表示处理间差异显著 Values followed by different small letters in a column are significantly different among treatments at 5% level.

表4 不同磷水平下添加蚯蚓、菌根后土壤微生物量碳氮含量 (mg/kg)Table 4 Soil microbial biomass carbon and nitrogen after addition of earthworms and AM fungi under low P and high P supply
注(Note): CK—不加蚯蚓和菌根No earthworm and mycorrhizae addition; E—只加蚯蚓Earthworm addition; AM—只接种菌根 Mycorrhizal addition; AM+E—同时添加蚯蚓和菌根 Earthworm and mycorrhizae addition; SMBC—微生物量碳Soil Microbiomass C; SMBN—微生物量氮Soil microbiomass N. 同列数值后不同小写字母表示处理间差异显著 Values followed by different small letters in a column are significantly different among treatments at 5% level.
3 讨论
3.1 蚯蚓对菌根侵染的影响
蚯蚓对土壤养分有效性以及对作物生长的影响取决于土壤中蚯蚓食物来源的数量和质量[15-16]。以往的结果表明,蚯蚓的掘穴、取食活动会扰动土壤中的菌根菌丝网络[17], 并且不利于菌根对植物的侵染[18-19]。本试验中,添加的秸秆为蚯蚓提供了充足的食物来源,最大限度的降低了蚯蚓对菌根产生的负效应。Ortiz-Ceballos等[20]的研究也表明,在没有添加秸秆的情况下,蚯蚓显著降低了AM的侵染率,但是当加入秸秆后这种影响便消失。这说明蚯蚓会优先选择有机物质为食物来源。另外,菌根侵染率的提高可能与土壤中微生物和蚯蚓的共同作用产生的植物激素有关[21],植物激素能明显地刺激菌根侵染。
3.2 蚯蚓菌根互作对玉米生长和养分吸收影响
本试验尝试着在自然条件下进行的蚯蚓菌根互作试验,布置了不同于室内盆栽试验也区别于大田试验的田间盆栽试验。在两种磷水平下,同时添加蚯蚓和菌根的处理与单接种相比,都显著提高了玉米的生物量。单接菌的处理显著增加了植株地上部含磷量 (表2),同时导致土壤中磷的耗竭 (表3)。这表明,在缺磷的条件下,尽管菌根真菌本身会与植物竞争氮素,但是菌根的吸磷作用仍然促进了玉米的生长[22]。在低磷条件下,蚯蚓通过矿化土壤中硝态氮从而增加了玉米植株的吸氮量 (表2、 表3)。研究表明在低磷条件下,蚯蚓活化的氮素可以降低菌根真菌与植物之间氮素的竞争。因此,蚯蚓菌根增加了土壤中氮磷的有效性同时对玉米生长和养分吸收具有互补效应。通过相关性分析发现,根系生物量和土壤硝态氮 (P<0.01)、土壤有效磷 (P<0.05 低磷;P<0.01高磷)、土壤微生物量碳 (P<0.01)、氮 (P<0.05 低磷;P<0.01高磷) 具有显著的正相关关系。蚯蚓菌根互作通过调控土壤养分和微生物量碳氮从而促进地上地下部生长。蚯蚓菌根互作的机理有待于进一步研究,利用15N、33P 等同位素示踪技术可能会明确蚯蚓菌根互作机制和途径。
植物体中的N/P比可作为判断植物生长的养分供应状况指标,如判断植物是受氮限制还是受磷限制。Koerselman 和 Meuleman[23]通过研究,发现当N/P >16时,这个系统是受磷限制的,而当N/P<14时,这个系统是受氮限制的。在氮素缺乏的土壤上蚯蚓能够大量活化土壤氮[24]。本试验中单加蚯蚓分别增加了玉米地上部38%和地下部46%的氮含量,而在单接菌的处理中却没有显著差异。在高磷条件下,蚯蚓增加了植物对氮的吸收;双接种的处理中,蚯蚓通过调节土壤的N/P,从而平衡氮磷养分促进玉米的生长。需要进一步调查了解土壤的过程,比如碳循环、 氮循环、 磷循环,有待于进一步挖掘蚯蚓菌根相互作用在高磷条件下对玉米生长的促进作用。
3.3 蚯蚓菌根互作对土壤微生物量碳、氮的影响
土壤微生物量既是土壤有机质和土壤养分转化与循环的动力,又可作为土壤中植物有效养分的储备库,其在土壤肥力和植物营养中具有重要作用[25]。土壤微生物量的变化对指示土壤肥力、土壤养分转化、循环过程具有重要意义[26]。土壤微生物量碳、氮受土壤水分、温度和土壤养分状况等的影响[27]。菌根真菌增加土壤微生物生物量主要是由于侵染菌根的寄主植物增加根系分泌物所导致,另外也跟植物生长和土壤结构的变化有关[28]。Van Aarle[29]等研究发现,石灰性土壤中菌根真菌菌丝促进了细菌活性及微生物量。蚯蚓通过取食和肠道的消化作用对总微生物量产生影响[30]。
蚯蚓和菌根真菌的相互作用通过改变土壤速效磷和土壤硝态氮浓度与植物地上部和根系生物量来影响土壤微生物生物量碳和氮。本试验中无论在高磷还是低磷条件下,蚯蚓菌根互作显著增加了土壤微生物量碳、氮。另一方面,土壤硝态氮与土壤微生物量碳、氮 (P<0.01) 具有负相关关系;土壤有效磷也与土壤微生物量碳 (P<0.01)、氮 (P<0.05 低磷;P<0.01高磷) 负相关。在高磷条件下 (氮是限制因子),单加蚯蚓的处理土壤微生物量碳、氮显著高于单接菌的处理,并且土壤微生物量碳、氮和玉米地上地下部生物量呈正相关关系 (P<0.01)。这表明,在氮缺乏时蚯蚓通过增加土壤生物量碳、氮来提高植物生物量。在低磷条件下,玉米地上和地下部生物量和土壤微生物量碳呈正相关 (P<0.01),与对照相比单接菌促进了玉米生长和微生物量碳。这可能是因为菌根通过释放富含丰富碳源的化合物来调控土壤微生物量碳[31]。土壤微生物C/N 常常用来指示微生物群落的结构和生理状态。在低磷条件下,双接种显著提高了土壤微生物C/N。
4 结论
无论在高磷还是低磷水平下,蚯蚓菌根相互作用都提高了玉米地上地下部生物量、氮磷吸收量同时提高了土壤微生物量碳、氮。蚯蚓菌根相互作用对植物生长的影响取决于土壤养分条件。在高磷条件下 (氮相对不足),蚯蚓菌根互作通过调控土壤微生物量碳、氮调控玉米生长和养分吸收。低磷条件下,菌根主要发挥吸磷作用,蚯蚓主要矿化秸秆和土壤中的氮素,蚯蚓菌根互补调控土壤中氮磷从而影响植物的生长和养分吸收。因此,蚯蚓菌根互作在实际生产特别是在低投入和有机农业生产体系中能够发挥积极作用。
[1] Wardle D A. The influence of biotic interactions on soil biodiversity[J]. Ecology Letters, 2006, 9: 870-886.
[2] 张卫信, 陈迪马, 赵灿灿. 蚯蚓在生态系统中的作用[J]. 生物多样性, 2007, 15(2): 142-153. Zhang W X, Chen D M, Zhao C C. Functions of earthworm in ecosystem[J]. Biodiversity Science, 2007, 15(2): 142-153.
[3] Hawkins H J, Johansen A, George E. Uptake and transport of organic and inorganic nitrogen by arbuscular mycorrhizal fungi[J]. Plant and Soil, 2000, 226: 175-185.
[4] Wurst S, Dugassa-Gobena D, Langel Retal. Combined effects of earthworms and vesicular-arbuscular mycorrhizas on plant and aphid performance[J]. New Phytologist, 2004, 163: 169-173.
[5] Patron J C, Sanchez P, Brown G Getal. Phosphorus in soil and Brachialis decumbens plants as affected by the geophagous earthworm Pontoscolex corethrurus and P fertilization[J]. Pedobiologia, 1999, 43: 547-556.
[6] Gormsen D, Olsson P A, Hedlund K. The influence of collembolans and earthworms on AM fungal mycelium[J]. Applied Soil Ecology, 2004, 27: 211-220.
[7] Johansen A, Jakobsen I, Jensen E S. Hyphal N transport by a vesicular-arbuscular mycorrhizal fungus associated with cucumber grown at three nitrogen levels[J]. Plant and Soil, 1994, 160: 1-9.
[8] Ravnskov S, Larsen J, Olsson P Aetal. Effects of various organic compounds on growth and phosphorous uptake of an arbuscular mycorrhizal fungus[J]. New Phytologist, 1999, 141: 517-524.
[9] Eisenhauer N, König S, Alexander C Wetal. Impacts of earthworms and arbuscular mycorrhizal fungi (Glomusintraradices) on plant performance are not interrelated[J]. Soil Biology and Biochemistry, 2009, 41: 561-567.
[10] Curry J P, Schmidt O. The feeding ecology of earthworms-a review[J]. Pedobiologia, 2007, 50: 463-477.
[11] Magdoff F, Weil R R. Soil organic matter in sustainable agriculture[M]. Boca Raton: CRC Press, 2004, 15-21.
[12] Jordan D, Kremer R J, Bergfield W Aetal. Evaluation of microbial methods as potential indicators of soil quality in historical agricultural fields[J]. Biology and Fertility of Soils, 1995, 19: 297-302.
[13] Johansen A, Jakobsen I, Jensen E S. Hyphal N transport by a vesicular-arbuscular mycorrhizal fungus associated with cucumber grown at three nitrogen levels[J]. Plant and Soil, 1994, 160: 1-9.
[14] Wangn L G, LI W J, Qiu J Jetal. Effects of biological organic fertilizer on crops growth soil fertility and yield[J].Soil and Fertilizers,2004, (5): 12-16.
[15] Eisenhauer N, Scheu S. Earthworms as drivers of the competition between grasses and legumes[J]. Soil Biology and Biochemistry, 2008, 40: 2650-2659.
[16] Milcu A, Partsch S, Scherber Cetal. Earthworms and legumes control litter decomposition in a plant diversity gradient[J]. Ecology, 2008, 89: 1872-1882.
[17] Tiunov A V, Dobrovolskaya T G. Fungal and bacterial communities inLumbricusterrestrisburrow walls: a laboratory experiment[J]. Pedobiologia, 2002, 46: 595-605.
[18] Tuffen F, Eason W R, Scullion J. The effect of earthworms and arbuscular mycorrhizal fungi on growth of and32P transfer betweenAlliumporrumplants[J]. Soil Biology and Biochemistry, 2002, 34: 1027-1036.
[19] Lawrence B, Fisk M C, Fahey T J. Influence of nonnative earthworms on mycorrhizal colonization of sugar maple (Acersaccharum)[J]. New Phytologist, 2003, 157: 145-153.
[20] Ortiz-Ceballos A I, Fragoso C, Brown G G. Mycorrhizal colonization and nitrogen uptake by maize: combined effect of tropical earthworms and velvetbean mulch[J]. Biology and Fertility of Soils, 2007, 44: 181-186.
[21] Azcón R, Azcon-Aguilar C, Barea J M. Effect of plant hormones present in bacterial cultures on the formation and responses to VA endomycorrhiza[J]. New Phytologist, 1978, 80: 359-364.
[22] Wurst S, Dugassa-Gobena D, Langel Retal. Combined effects of earthworms and vesicular-arbuscular mycorrhizas on plant and aphid performance[J]. New Phytologist, 2004, 163: 169-173.
[23] Koerselman W, Meuleman A F W. The vegetation N: P ratio: a new tool to detect the nature of nutrient limitation[J]. Journal of Applied Ecology, 1996, 33: 1441-1450.
[24] Scheu S. Effects of earthworms on plant growth: patterns and perspectives[J]. Pedobiologia, 2003, 47: 846-856.
[25] Abbott L K, Murphy D V. Soil biological fertility: A key to sustainable land use in agriculture[M]. New York, US: Springer-Verlag New York Inc., 2003. 99-102.
[26] Singh J S, Singh D P, Kashyap A K. A comparative account of the microbial biomass-N and N-mineralization of soils under natural forest, grassland and crop field from dry tropical region, India[J]. Plant Soil and Environment, 2009, 55: 223-230.
[27] Campbell C A, Biederbeck V O, Wen Getal. Seasonal trends in soil biochemical attributes: effects of crop rotations in the semi-arid prairie. Canadian Journal of Soil Science, 1999, 79: 73-84.
[28] Johansson J F, Paul L R, Finlay R D. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture[J]. FEMS Microbiology Ecology, 2004, 48: 1-13.
[29] Van Aarle I M, Soderstrom B, Olsson P A. Growth and interactions of arbuscula rmycorrhizal fungi in soils from limestone and acid rock habitats[J]. Soil Biology and Biochemistry, 2003, 35: 1557-1564.
[30] Svensson K, Friberg H. Changes in active microbial biomass by earthworms and grass amendments in agricultural soil[J]. Biology and Fertility of Soils, 2007, 44: 223-228.
[31] Zarea M J, Ghalavand A, Goltapeh E M. Effects of mixed cropping, earthworms (Pheretimasp.), and arbuscular mycorrhizal fungi (Glomusmosseae) on plant yield, mycorrhizal colonization rate, soil microbial biomass, and nitrogenase activity of free-living rhizosphere bacteria[J]. Pedobiologia, 2009, 4: 223-235.
Interaction of earthworms and amfungi on maize growth, and nutrogen and phosphorus uptake
LI Huan1,2, WANG Chong2*, WANG Shun-yi1
(1CollegeofResourcesandEnvironment,ShandongAgriculturalUniversity,Qingdao,Shandong266109,China;2CollegeofResourcesandEnvironmentalSciences,ChinaAgriculturalUniversity,Beijing100193,China)
【Objectives】Earthworms and arbuscular mycorrhizal fungi(AMF) are in different trophic levels, both play same roles in promoting plant growth and soil biological fertility. This research on the effect of interaction of earthworms and amfungi improving plant nutrient uptake could explore the potential for soil biological fertility in the sustainable agricultural system. 【Methods】 A soil buried pot experiment was carried out with maize as tested crop. Two P levels of 25 mg/kg (low) and 175 mg/kg (high) were setup using KH2PO4as P source. With each P level, inoculation of AMF or not, and added earthworms or not were setup. The growth and nutrient uptake by maize were investigated, the availability of soil nutrients were measured. 【Results】 AMF and earthworms interactively increased maize shoot and root biomass at harvest. The AMF treatment significantly enhanced colonization and vesicle frequency, hyphae frequency. The earthworm×AMF treatment clearly improved maize root colonization rate as well as arbuscular frequency, hyphae frequency, and hyphal length density except for vesicle frequency which was reduced. At both P rates, shoot and root N and P contents in the earthworm×AMF treatment were significantly higher than those in other treatments. At low P rate, the increase of shoot N and P contents were by addition of both AMF and earthworms, while that in root P content was mainly by addition of AMF, root N content was not affected by AMF or earthworm treatment. At high P rate, earthworm treatment significantly increased shoot and root N and P contents AMF treatment did not. At high P rate, earthworm and AMF interaction also increased soil microbial biomass C, which possibly improved root N and P contents and indirectly increased the shoot N and P uptake. At low P rate, soil N mobilization by earthworms might have reduced potential N competition by arbuscular mycorrhizal hyphae, resulting in greater plant shoot and root biomass. Earthworms and AMF interactively enhanced soil N and P availability, leading to greater nutrient uptake and plant growth.【Conclusions】 In both high and low P supply levels, the earthworms and AMF have positive interactions on improving the biomass and the N and P uptake of maize, and the soil micro biomass carbon and nitrogen contents. In high P supply (175 mg/kg), the interaction of earthworms and AMF is able to adjust the soil microbiomass C and N content for the growth of maize. In low P supply (25 mg/kg), the AMF mainly involves in the release of P, while earthworms in the mineralization of straw and soil organic N, both the work help each other for the supply of maize growth.
arbuscular mycorrhizal fungi; earthworm; interaction; complementary effect of N and P
2014-06-11 接受日期: 2014-08-19 网络出版日期: 2015-06-01
国家自然基金项目(31172037);国家青年科学基金项目(31301854);青岛农业大学博士启动基金(6631314)资助。
李欢(1983—),男,山东青岛人,副教授,主要从事土壤生物肥力的研究。E-mail:lihuancomcomcom@163.com * 通信作者 E-mail: wangchong@cau.edu.cn
S154.1
A
1008-505X(2015)04-0920-07
