二甲双胍对糖尿病非酒精性脂肪性肝病大鼠肝脏内脏脂肪素表达的作用
2015-06-12张安星
廖 鑫,张安星,高 琳,张 晗,阳 琰
(贵州省遵义医学院附属医院内分泌科,贵州 遵义 563000)
技术与方法
二甲双胍对糖尿病非酒精性脂肪性肝病大鼠肝脏内脏脂肪素表达的作用
廖 鑫1,张安星1,高 琳1,张 晗1,阳 琰1
(贵州省遵义医学院附属医院内分泌科,贵州 遵义 563000)
目的 观察二甲双胍对糖尿病合并非酒精性脂肪肝病大鼠肝脏内脏脂肪素表达的影响。方法 雄性SD大鼠,分为正常对照(NC)组,肥胖组(OB组),糖尿病(DM)组和二甲双胍(MET)组。所有大鼠均测FBG、TG、TC、HDL-C、LCL-C、FFA、FIns,计算HOMA-IR指数。采用RT-PCR测定肝脏内脂素 mRNA表达,Western blotting测定蛋白表达,H.E.染色后观察肝脏病理变化。结果 OB组及DM组FBG、TG、TC、HDL-C 、LCL-C、FFA、FIns、HOMA-IR均增高(P<0.05),ISI显著减低(P<0.01),肝脏发生脂肪变性。MET组上述指标均显著下降。DM组大鼠肝脏内脂素mRNA及蛋白表达较NC组及OB组均显著增高(P<0.05),MET组较糖尿病组显著降低(P<0.01),肝脏脂肪变性程度减轻。结论 二甲双胍能减轻糖尿病大鼠肝脏脂肪变性,可能与降低了肝脏visfatin的表达有关。
二甲双胍;糖尿病;非酒精性脂肪性肝病;大鼠;内脏脂肪素
众多资料显示,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的形成由多个因素参与,如胰岛素抵抗(insulin resist IR)、脂代谢异常、氧化应激,以及脂肪因子的作用等[1]。内脏脂肪素(visfatin)是目前研究较多的脏脂肪因子,其与IR密切相关。本研究测定了糖尿病(DM)合并NAFLD大鼠肝脏内脂visfatin mRNA的表达,并用二甲双胍干预后观察大鼠肝脏的病理变化,从而探讨二甲双胍对DM合并NAFLD大鼠visfatin mRNA表达的影响。
1 材料与方法
1.1 实验动物、仪器与试剂
雄性SD大鼠(SPF级),体重185-220g,大鼠及喂养饲料均购买于第三军医大学附属大坪医院动物实验中心。老鼠房间室温保持于20-26 ℃之间,12小时光照,自由饮水。胰岛素放免试剂盒(美国LINCO公司),链脲佐菌素(STZ)(美国sigma公司);Visfatin抗体(美国Biovision公司),Trizol Reagent、焦碳酸二乙酯、逆转录试剂盒、SYBR® GREEN PCRMaster Mix(大连宝生物公司)。visfatin及β-actin引物的设计、合成(大连宝生物公司)。β-actin抗体(北京中杉金桥公司)。RIPA蛋白裂解液、BCA蛋白浓度定量试剂盒、彩色预染marker及ECL显色试剂盒(碧云天生物技术有限公司)。盐酸二甲双胍(施贵宝制药公司)。
1.2 模型的建立 雄性SD大鼠60,适应性喂养一周后,随机分为正常对照组(NC组)10只,普通饲料喂养;肥胖组(DIO组),高糖高脂饲料喂养,以体重>A组平均体重的20%为肥胖组大鼠成模标准,10只成模。糖尿病模型组(DM组),高糖高脂饲料喂养,给予腹腔注射链脲佐菌素(40 mg/kg),以2次血糖≥16.7 mmol/L,做为糖尿病大鼠成模标准,共成模20只。糖尿病成模后,其中10只作为糖尿病组,另10只用盐酸二甲双胍100 mg/kg.d灌胃,作为二甲双胍组(MET),将空腹血糖控制<11.1 mmol/L,共成模9只。
1.3 标本的采集
1.3.1 12周后各组大鼠禁食称重,10%水合氯醛麻醉,取血离心后留取血清,用于测定TC、TG、LDL-C、FFA、FIns。迅速取出肝脏,用滤纸吸干水分,称重。将肝脏置于1 mL Trizol中,-80 ℃冰箱冻存,用于visfatin mRNA及蛋白的测定。
1.3.2 RT-PCR法测定肝脏visfatin mRNA的表达:按照氯仿-异丙醇-乙醇法提取肝脏总RNA,将RNA逆转录为cDNA。再予RT-PCR测定visfatin mRNA的表达,使用美国BIO-RAD公司icycler 荧光定量PCR进行检测。
1.3.3 Western blot 法测定肝脏蛋白的表达:将冻存肝脏组织取出,使用预冷PBS洗涤后剪碎,加入RIPA强效裂解液,冰上超声震碎,裂解,4 ℃离心30 min后取上清。按BCA法测定蛋白浓度。蛋白变性(100 ℃,5 min)后上样电泳,转膜,封闭,加入visfatin一抗孵育过夜。第二日洗膜后加入二抗摇床中孵育1 h,ECL显影成像。
1.4 肝脏病理学观察 取出小块肝组织,流水洗净,石蜡包埋,行H,E.染色,并在光镜下观察肝脏组织形态,病理诊断依据非酒精性脂肪肝病诊疗指南[2]。
1.5 统计学分析 数据采用SPSS13.0软件统计分析,(±S)表示。多组间比较采用方差分析,P<0.05认为有统计学意义。
2 结果
2.1 与NC组相比,DIO组及DM组FBG、TG、TC、LDL-C、FFA、FIns、HOMA-IR均增高(P<0.05),ISI显著减低(P<0.01)。与DIO组大鼠相比,DM组FBG、TG、TC、LDL-C、FFA、FIns、HOMA-IR也显著增高,ISI显著降低(P<0.01)。MET组上述指标显著下降(见表1)。
表1

GroupNC组(n=10)DIO组(n=10)DM组(n=10)MET组(n=9)体重(g)412.60±41.24621.90±30.12△403.78±45.52●422.67±29.27●◇内脏脂肪重量(g)8.46±2.2926.59±6.70△8.59±3.78●11.22±5.44●◇内脂重/体重(%)2.07±0.524.29±1.04△2.03±0.81●2.62±1.23●◇空腹血糖(mmol/L)4.32±1.025.21±0.4321.43±2.67△●6.97±1.35★总胆固醇(mmol/L)1.11±0.321.59±0.416.71±3.27∗1.80±0.33△低密度脂蛋白胆固醇(mmol/L)0.37±0.130.44±0.223.66±1.57∗#0.47±0.19☆游离脂肪酸(mmol/L)368.50±135.73480.45±147.511301.30±453.58△#646.56±192.97∗空腹胰岛素(uIU/L)10.40±3.2524.45±8.77△38.18±9.11△●-HOMA-IR2.01±0.755.61±2.24△43.21±10.71△●-ISI0.03±0.010.01±0.005△0.001±0.0001△●-
HOMA-IR:稳态模型评估法-胰岛素抵抗指数;ISI:胰岛素敏感指数; 与NC组比较 ,*P<0.05, △P<0.01;与DIO组比较,#P<0.05,●P<0.01;vs. 与 DM组比较, ☆P<0.05,★P<0.01。
2.2 DM组大鼠肝组织visfatin mRNA、蛋白表达较NC组、DIO组显著增高(P<0.05),MET组较DM组显著降低(P<0.01,表2、图1)。
表2 各组间肝脏visfatin mRNA及visfatin蛋白表达
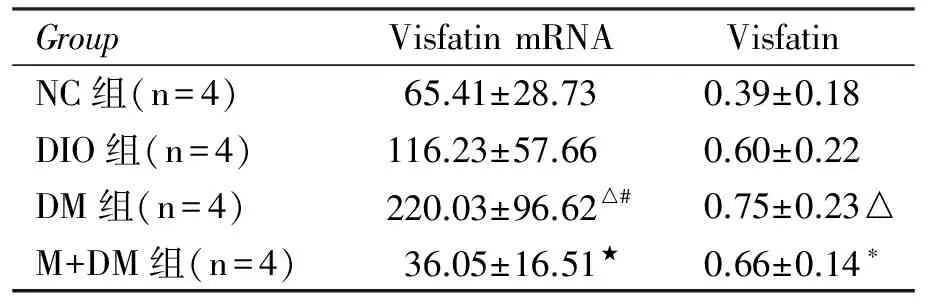
GroupVisfatinmRNAVisfatinNC组(n=4)65.41±28.730.39±0.18DIO组(n=4)116.23±57.660.60±0.22DM组(n=4)220.03±96.62△#0.75±0.23△M+DM组(n=4)36.05±16.51★0.66±0.14∗
与NC组比较,*P<0.05,△P<0.01;与DIO组比较,#P<0.05,●P<0.01; 与DM组比较,☆P<0.05,★P<0.01。

图1 大鼠肝脏visfatin的蛋白表达(western bolt)
2.3 各组间肝脏病理学变化 NC组肝细胞结构完整、细胞质无脂滴,细胞核处于中心,大而圆;DIO组肝细胞肿胀明显,部分可见脂肪变性,肝小叶形态完整,无明显炎性细胞浸润;DM组肝细胞弥漫性肿胀,广泛肝细胞脂肪变性,可见大量脂肪空泡及汇管区慢性炎细胞浸润,纤维组织增生。MET组肝细胞轻度肿胀,部分脂肪变性及脂肪空泡。(图2)
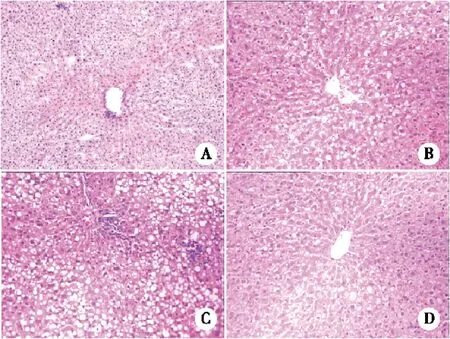
A:NC组;B:OB组;C:DM组;D:MET组。
3 讨论
NAFLD是近年来较常见的肝脏疾病,主要以肝细胞脂肪变性和脂肪贮积为特征,它的病理学改变与酒精性脂肪肝相似,但这类患者通常无长期大量饮酒史,而与肥胖、高血糖、高血脂、高胰岛素等代谢紊乱疾病相关。在2型糖尿病(T2DM)及高脂血症患者中,NAFLD的患病率分别是28%-55%,27%-92%。所以,随着DM等疾病的发病率增长,NAFLD的患病率也逐渐上升[3-4]。DM(特别是T2DM)及NAFLD均是由于体内糖脂代谢紊乱所致,目前认为与IR密切相关,相关研究已证实IR不仅能引起骨骼肌、脂肪对葡萄糖的代谢障碍,而且还参与了NAFLD发病整个过程,此外,在骨骼肌、脂肪及肝脏发生的IR与NAFLD具有直接的相关性[5-6]。而在NAFLD患者中,T2DM及糖尿病前期的风险亦相对较大,NAFLD是能预测糖尿病发生的一个因素[7]。本研究中的相关结果显示,DM组血脂谱、FIns、HOMA-IR显著增高,ISI显著降低,且病理学变化也显示,DM组大鼠肝脏发生了明显的脂肪变性,符合NAFLD的相关肝脏病理改变,同时也证明了DM、NAFLD与IR密切相关。
DM及NAFLD之间关系密切,相互影响,均与高血糖、高血脂密切相关,且两者均存在腹型肥胖,会导致大量的内脏脂肪聚集。visfatin已被证实是一种在内脏脂肪中大量表达的脂肪因子,故在DM合并NAFLD体内,可能会出现visfatin的高表达。多数研究认为visfatin能调节胰岛素的分泌、使胰岛素受体的磷酸化,从而发挥类似胰岛素的作用,这是通过β细胞功能相关的基因表达来实现的。且有研究发现,visfatin在肥胖者的大网膜脂肪细胞中的表达高于皮下脂肪[8],表明其参与了内脏脂肪的合成。本实验中,DIO组及DM合并NAFLD大鼠肝组织visfatin mRNA及蛋白表达水平显著增高,内脏脂肪组织聚集可能导致visfatin的表达上升,由于DM合并NAFLD大鼠存在明显的IR,这些都提示visfatin与IR相关。而肝脏visfatin的表达增加可能也促进了脂肪的形成,并参与了大鼠脂肪性肝病的发生发展。
二甲双胍是传统的经典降糖药物,它能促进胰岛素与受体的结合,并通过降低肝糖原的异生、抑制肝糖原输出,增加骨骼、肌肉等胰岛素靶器官对葡萄糖的摄取和利用,发挥降糖作用。在其降糖作用中,一个重要的途径是AMPK通道的激活,有研究表明,AMPK能够直接参与机体葡萄糖的调节[9]。AMPK由α亚基、β亚基及γ亚基所组成,α亚基在骨骼肌、肝脏等高表达,一旦α亚基上的苏氨酸残基被磷酸化,其即被活化并激活AMPK通道[10]。而其活性的降低,能使糖酵解减少和脂肪酸氧化,引起胆固醇、脂肪酸、蛋白质的合成,并增加糖异生。二甲双胍可以通过激活骨骼肌、肝脏等组织的AMPK,使AMPK活化,从而实现降糖作用。
目前已经发现多种脂肪因子能够通过调节AMPK而发挥不同作用,有研究[11]发现肥胖大鼠内脏脂肪组织visfatin蛋白的表达与AMPK的活化程度负相关,认为visfatin可能是下调AMPK活性的重要因子,这可能与二甲双胍的降糖机制有一定关联。近来有研究表明,在T2DM合并慢性牙周病患者中,visfatin的水平也是明显增高的[12],而经过内科治疗3月后,visfatin水平又会显著下降[13]。而本研究显示,DM组大鼠的肝脏visfatin mRNA和蛋白表达与NC组及DIO组比较,呈显著增高趋势。我们考虑可能是由于DM大鼠血糖的升高,代偿性的使肝脏visfatin表达增高,从而模拟胰岛素的降血糖作用,以弥补胰岛素的相对不足。从我们的实验结果可以看出,DM合并NAFLD大鼠体内,visfatin呈增高趋势,而其表达也与IR相关,故可能可以认为糖尿病合并NAFLD与visfatin的表达呈正相关,考虑均由于体内IR所致。而MET组大鼠visfatin mRNA及蛋白表达均较DM组下降,可能是二甲双胍通过上述机制,达到改善胰岛素抵抗、治疗NAFLD,从而最终下调肝脏visfatin的表达所引起,这与近来对T2DM合并慢性牙周病的研究结果有其相似之处。
本研究中,经过二甲双胍干预后大鼠肝脏脂肪变性减轻,与相关研究结果类似[14]。同时visfatin的mRNA和蛋白表达均较DM组相应下降,我们推测,二甲双胍可能有降低DM合并NAFLD大鼠visfatin的表达的作用,但具体途径及通路如何,还有待我们的进一步研究。
[1] 李明珍,姜春燕,孙丽荣.高分子量脂联素与非酒精性脂肪性肝病.国际内分泌代谢杂志,2012,4: 273-275.
[2] Jian Gao Fan,Ji Dong Jia,et al.Guidelines for the diagnosis and management of nonalcoholic fatty liver disease: Update 2010.Journal of Digestive Disease. 2011;12;38-44.
[3] Tuyama A C,Chang C Y,et al.Non alcohol fatty liver disease. Diabetes.2012 Sep;4(3):266-80.
[4] Elisa Fabbrini, Shelby Sullivan, and Samuel Klein. Obesity and Nonalcoholic Fatty Liver Disease: Biochemical, Metabolic and Clinical Implications.Hepatology. 2010 Feb; 51(2): 679-689.
[5] Korenblat KM,Fabbrini E,Mohammed BS,et al.Liver,Muscle,and Adipose Tissue Insulin Action Is Directly Related to Intra hepatic Triglyceride Content in Obese Subjects.Gastroenterology.2008 May; 134(5):1369-75.
[6] Bugianesi E, Gastaldelli A, Vanni E, et al. Insulin resistance in non-diabetic patients with non-alcoholic fatty liver disease: sites and mechanisms.?Diabetologia.?2005;48:634-642.
[7] Ming J,Xu S,Gao B et al. Non-alcoholic fatty liver disease?predicts type 2 diabetes mellitus, but not pre-diabetes, in Xi'an, China: a 5-year cohort study. Liver?Int.?2015,4(16). doi: 10.1111/liv.12851.
[8] 林刚,叶小龙,王长江等,肥胖者腹部皮下和网膜脂肪中visfatin mRNA表达及相关因素的研究.中国综合临床.2007,23:503-506.
[9] Wang M R, Li R et al. Recent progress in the relationship of AMPK and type 2 diabetes. J Endocrine Surg, 2007, 1 (2) : 132 - 134.
[10] Kim Y D, Park K G, Lee Y S, et al. Metformin inhibits hepatic gluconeogenesis through AMPK activated protein kinase dependent regulation of the orphan nuclear recep tor SHP. Diabetes, 2008, 57: 306-314.
[11] 肖海涛,裴晓萌,李显等. 高脂饲料诱导的肥胖倾向和肥胖抵抗倾向大鼠内脏脂肪visfatin和AMPK表达及其相互关系.中国运动医学杂志,2008,27(2):170-173.
[12] Ghallab N A,Amr E M,Shaker O G. Expression of Leptin and Visfatin in Gingival Tissues of Chronic Periodontitis With and Without Type 2 Diabetes Mellitus: A Study Utilizing Enzyme Linked Immunosorbent Assay and Real-time Polymerase Chain Reaction. J Periodontol,2015,3(26):1-13.
[13] Wu Y,Chen L,Wei B,et al. Effect of Non-Surgical Periodontal Treatment on Serum and Gingival Crevicular Fluid Visfatin Concentration in Chronic Periodontitis Patients With Type 2 Diabetes Mellitus. J Periodontol,2015,3(19):1-9.
[14] 黄琦,吴芹,李菲等.二甲双胍对糖尿病大鼠肝脏脂肪变性的干预作用.遵义医学院学报,2013,36(3):207-209.
[收稿2015-02-11;修回2015-03-10]
(编辑:王福军)
Effects of metformin on liver visfatin expression of diabetic rats with non-alcoholic fatty liver disease
LiaoXin1,ZhangAnxing1,GaoLin1,ZhangHan1,YangYan
(Department of Endocrinology, the Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou 563003, China)
Objective To observe the effects of metformin on liver visfatin expression of diabetic rats with non-alcoholic fatty liver disease. Methods Male SD rats were randomly divided into four group: normal group (NC), diet-induced obesity group (OB), diabetes mellitus group (DM) and metformin treated group (MET). FBG, TG, TC, LCL-C, FFA and FIns were detected and HOMA-IR index was calculated. Liver visfatin mRNA and protein expressions were measured by real time fluorescence quantitative PCR and western blotting assay. The changes of liver were observed by light microscopy analyzed with Hematoxylin-Eosin (H.E.) staining.Results FBG, TG, TC, LCL-C, FFA, FIns and aHOMA-IR were significantly higher (P<0.05) and ISI was significantly lower than those in NC group (P<0.01). Liver fatty degeneration in rats was observed after H.E. staining. Visfatin mRNA and protein expression of liver were significantly higher in DM group than those in NC and OB groups and lower in MET Group than those in DM group (P<0.05). Liver fatty degeneration was attenuated in MET Group compared with DM group.Conclusion Metformin could significantly relieve liver fatty degeneration and these effects might be relative to the decreased visfatin expression of diabetic rats with non-alcoholic fatty liver disease.
Metformin; diabetes; non-alcoholic fatty liver disease; rats; visfatin
贵州省科技合作项目(黔科合区域合 (2010) 7004号);贵州省科技支撑计划项目社会发展攻关项目(黔科合SY字合(2013) 3033号)。
高琳,E-mail:lgzymc@sina.com。
[文献标志码] A [文章编号] 1000-2715(2015)02-0 -0
