百可利对6-羟多巴胺不同注射位点帕金森病模型大鼠的治疗作用
2015-06-09何国荣李晓秀王月华方莲花杜冠华
何国荣,穆 鑫,李晓秀,王月华,方莲花,孙 岚,吕 扬,杜冠华,3
(中国医学科学院北京协和医学院药物研究所1.“药物靶点研究与新药筛选”北京市重点实验室、2.“晶型药物研究”北京市重点实验室、3.“天然药物活性物质与功能”国家重点实验室,北京 100050)
◇论 著◇
百可利对6-羟多巴胺不同注射位点帕金森病模型大鼠的治疗作用
何国荣1,穆 鑫1,李晓秀1,王月华1,方莲花1,孙 岚1,吕 扬2,3,杜冠华1,3
(中国医学科学院北京协和医学院药物研究所1.“药物靶点研究与新药筛选”北京市重点实验室、2.“晶型药物研究”北京市重点实验室、3.“天然药物活性物质与功能”国家重点实验室,北京 100050)
目的 观察百可利对6-羟多巴胺(6-OHDA)内侧前脑束(MFB)和纹状体尾壳核(CPu)两个不同注射位点帕金森病(PD)模型大鼠的治疗作用,两个注射位点模型分别记为:MFB-M,CPu-M。方法 运用6-OHDA两点注射法,损毁大鼠左侧中脑多巴胺能神经元,制备PD模型。记录大鼠后肢肌电(EMG)信号频率观察肌肉震颤;测定大鼠自主活动;电化学法检测纹状体内多巴胺(DA)及其代谢产物含量;免疫组化法检测大鼠脑内酪氨酸羟化酶(TH)、OX-42表达;观察神经元超微结构变化。结果 给药3周后,两个注射位点的模型组行为改变趋势一致,百可利在两个注射位点的模型动物上药效表现不同,在CPu-M组可明显提高PD大鼠自主活动数(P<0.05)。EMG信号分析显示,在MFB-M组,给予百可利,肌电频率降低55%;在CPu-M组,给予百可利,肌电频率降低60%。EMG时效研究表明,在CPu-M组,百可利药效持续420 min以上。纹状体递质水平显示,两个注射位点的模型组DA递质水平差异很大,在CPu-M组,百可利能够明显升高DA水平(P<0.05)。两个注射位点的模型组免疫组织化学结果趋势一致,在CPu-M组,百可利有更明显神经元保护作用(P<0.05),在MFB-M组,百可利抑制小胶质细胞过度激活作用更强(P<0.01)。结论 不同注射位点制备的PD模型能够反映不同时期PD的病理变化,百可利可通过抑制炎性介质生成和释放、保护残存神经元、恢复神经元功能等机制改善PD不同发病时期模型动物的行为学症状。
百可利;帕金森病;6-羟多巴胺;黑质纹状体通路;内侧前脑束;纹状体尾壳核;神经保护
帕金森病(Parkinson’s disease, PD)是严重危害中老年人健康的神经退行性疾病,目前现有的治疗药物有很大的局限性和副作用,因此建立能够反映PD临床病因、病理过程的动物模型,寻找新的有效防治PD的药物具有重要意义。6-羟基多巴胺(6-hydroxydopamine, 6-OHDA)是制备PD 大鼠模型的常用神经毒性化合物,动物脑内注射该化合物后可以诱导PD动物模型,具有明显的PD 临床特征。实验证明,制备PD 模型的注射位点为黑质纹状体通路,但不同注射位点对动物模型的病理特征影响很大。
黑质纹状体通路的多巴胺(dopamine, DA)能神经元位于黑质致密部(pars compacta of substantia nigra, SNc),其轴突通过内侧前脑束(medial forebrain bundle, MFB),终止于纹状体尾壳核(caudate putamen, CPu),由于这些部位的DA 能神经元丢失,导致纹状体DA 含量下降,最终导致运动功能受损,出现PD 的典型症状[1-2]。在黑质纹状体通路的3个位点中,SNc 结构微小,精确注射6-OHDA 到这个位点非常困难,而且该部位主要是神经元胞体,对6-OHDA 毒性作用不敏感,以SNc 作为注射位点制备PD 模型成功率较低。通常制备PD 模型选用的注射位点为MFB 与CPu。单侧损毁MFB 与单侧损毁CPu 的病理表现有所不同,前者会造成大多数神经元坏死,研究重症PD 具有较高价值,而后者神经元退化速率缓慢,与自发性PD 较为相似,在研究轻症PD 时价值较高。本研究分别采用在黑质纹状体通路MFB 和CPu 两个位点注射6-OHDA 诱发PD 大鼠模型的方法,观察了百可利在这两种损伤模型中的作用特点。
百可利(baicalein)是从唇形科植物黄芩(ScutellariabaicalensisGeorgi)干燥根中分离得到的黄酮类化合物,化学名称为5,6,7-三羟基黄酮,别名:黄芩素、黄芩苷元,国家药典委员会将其正式命名为百可利。文献报道,百可利具有抗炎、抗菌、抗过敏、抗氧化等广泛的药理活性[3]。本实验室前期围绕PD的发病机制和治疗靶点,建立了6-OHDA 损伤SH-SY5Y细胞模型和PC12细胞模型,采用高通量药物筛选技术,发现百可利有效地减轻6-OHDA致SH-SY5Y细胞和PC12细胞活力的下降、减轻6-OHDA致SH-SY5Y细胞凋亡、促进正常和6-OHDA损伤情况下的PC12细胞分化和轴突生长。进一步实验表明,百可利在不同的PD动物模型均具有抗PD 相关的药理作用[4-7]。本文采用大脑不同部位注射 6-OHDA 诱导大鼠PD 模型,观察了百可利的治疗作用及作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 Sprague Dawley (SD)大鼠,♂,2~3月龄,体质量180~200 g,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2007-0001。动物饲养在温度(22±1)℃,相对湿度55%~65%,12 h光照周期的环境中。
1.1.2 仪器 脑立体定位仪(MP8001, 深圳瑞沃德生命科技有限公司),大鼠自主活动程序自动控制仪(DZIL-2, 中国医学科学院药物研究所),生物机能实验系统(BL-420E+, 成都泰盟科技有限公司),STRONG牙钻(型号: 202N-110LN), 高速低温离心机(5810R, 美国Eppendorf公司),高效液相色谱库仑电化学分析系统(HPLC-ECD Coulchem Ⅲ, ESA, 美国),冰冻切片机(SM900, 美国Leica公司),透射电子显微镜(H-7650, Hitachi 公司, 日本)。
1.1.3 试剂与药品 百可利由中国医学科学院药物研究所“晶型药物研究”北京市重点实验室提供。美多芭片(上海罗氏制药有限公司生产, 批号: SH 0502)。6-OHDA、DA、二羟基苯乙酸(dihydroxyphenylacetic acid, DOPAC)、高香草酸(homovanilic acid, HVA)、阿朴吗啡(apomorphine, APO)购自Sigma-Aldrich公司;酪氨酸羟化酶(trysine hydroxylase, TH)抗体购自Chemicon公司;OX-42抗体购自Santa Cruz公司;卵白素-生物素过氧化物酶复合物(avidin biotin-peroxidase complex, ABC)试剂盒、3,3′-二氨基联苯胺(3,3′-diaminobenzidine, DAB)显色剂,购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 模型建立 大鼠以3% 戊巴比妥钠(50 mg·kg-1, ip)麻醉,常规皮肤消毒后,将大鼠头部固定在立体定位仪上,沿正中线切开大鼠颅顶皮肤,剥离骨膜,暴露前囟,以前囟为准,分别确定左侧MFB和CPu位点。MFB损伤位点坐标为:(1)TB:-2.3 mm, AP:-4.4 mm, ML:1.2 mm, V:-7.8 mm;(2)TB:+3.4 mm, AP:-4.0 mm, ML:0.8 mm, V:-8.0 mm。该组标记为MFB-M。CPu损伤位点坐标为:(1)TB:-3.3 mm, AP:-0.7 mm, ML:2.5 mm, V:-5.5 mm;(2)TB:-3.3 mm, AP:-0.3 mm, ML:3.5 mm, V:-5.5 mm。该组标记为CPu-M。用牙科钻在上述手术位点钻直径约2.5 mm的孔,用微量进样器将6-OHDA(2 g·L-1)溶液5 μL缓慢注入(1 μL·min-1),注射后留针10 min缓慢出针。假手术组大鼠注射等量的生理盐水。
1.2.2 模型评价 于术后d 14、d 21分别注射APO(0.5 mg·kg-1, sc)诱导大鼠旋转。取30 min内转速≥210 r的大鼠作为成功PD模型大鼠。
1.2.3 分组与给药 将造模成功的大鼠,随机分为模型组、美多芭组(madopar, 50 mg·kg-1, ig)、百可利(200 mg·kg-1, ig)组,每组12只;另取相应注射生理盐水经检测无旋转运动的大鼠各12只为假手术组。分组后灌胃给予美多芭和百可利,假手术组与模型组大鼠灌胃给予蒸馏水2 mL,每日1次,连续3周。
1.2.4 旋转行为学检测 模型动物分组后每隔7天于给药后30 min进行旋转行为检测。(方法同“1.2.2”)
1.2.5 自主活动检测 给药后30 min 将大鼠放入自主活动箱中,自动记录仪记录10 min 内大鼠自主活动次数。
1.2.6 大鼠肌电测定 将电极固定于大鼠后肢肌肉,使用 BL-420E+ 生物信号采集器对清醒大鼠后肢进行肌电(electromyography, EMG)测定,评价其震颤频率。检测条件为:0.015 毫秒(ms),扫描速度为0.01 秒(s),10 kHz 滤波。分别测定各组大鼠在给药后0、10、30、60、90、120、180、240、300、420 min 时的震颤频率。每个时间点记录1 min,统计每时间点5 s 的震颤频率。
1.2.7 神经递质检测 末次行为学实验结束后,每组取6 只大鼠断头取脑,冰上迅速分离出损伤侧纹状体,放入液氮中。纹状体称重后加入200 μL匀浆液,经超声破碎(200 W,50 s),离心(12 000 r·min-1,4 ℃,30 min),上清液用0.22 μm 滤膜过滤,取50 μL 用于测定。
色谱条件为:色谱柱:CAPCELL PAK C18 MG (3 μm,3 mm I.D.×75 mm),检测柱温35 ℃,流速1.0 mL·min-1;流动相:0.1 mol·L-1磷酸二氢钠(NaH2PO4) 水溶液含0.85 mmol·L-1辛基硫酸钠(octyl sulfate sodium salt,OSA)、0.5 mmol·L-1乙二胺四乙酸二钠(EDTA·Na2)和11%甲醇,用浓磷酸调pH 至3.25。
1.2.8 免疫组织化学检测 每组取4 只大鼠,麻醉、灌流固定后,断头取脑,置固定液中固定4 h,以含30% 蔗糖的多聚甲醛固定液内脱水。作连续冰冻冠状切片,片厚为20 μm。切片与一抗稀释液(TH 1 ∶500; OX-42 1 ∶100)4 ℃ 孵育过夜;然后分别与生物素标记的二抗(1 ∶300)反应1 h以及卵白素-生物素复合物反应2 h,最后用含有DAB 的缓冲液呈色。计数方法:随机选取每只大鼠脑切片5张,分别在黑质和纹状体阳性细胞密集区中央部分取4个互不重叠的高倍视野,计数视野内TH、OX-42免疫反应阳性细胞数目。
1.2.9 电镜样品制备及观察 假手术组、模型组和百可利组各取2只大鼠(脑组织前固定方法同“1.2.8”)。分离黑质与纹状体,用锋利刀片将组织修成约1 mm3的小块,并置于4℃ 预冷的5% 戊二醛中固定2 h。4℃ 的PBS缓冲液冲洗,4℃ 1% 锇酸后固定约1 h,4℃ 条件下乙醇梯度常规脱水,Epon812包埋,切片染色后,H-7650型透射电镜观察并拍片。

2 结果
2.1 百可利对大鼠旋转行为学的影响动物注射APO 后,假手术组大鼠均无异常表现。MFB-M与CPu-M模型组大鼠给予APO 后,大鼠旋转圈数均在270 r·(30 min)-1左右,给予百可利治疗后大鼠旋转次数无明显差异(Fig 1)。
2.2 百可利对大鼠自主活动的影响两个注射位点模型组大鼠均出现活动明显减少、反应迟钝、肢体震颤、嗅探、偏斜、弓背、尾僵直、竖毛、后肢搔挠、撕咬尾部、躁动不安及激惹等异常行为。与假手术组相比,MFB-M与CPu-M模型组的自主活动次数明显下降(P<0.05);给予百可利治疗后,MFB-M组大鼠自主活动无明显变化,CPu-M组大鼠自主活动数明显增加(P<0.05)(Fig 2)。
2.3 大鼠震颤频率的表现假手术组大鼠静息状态EMG 无明显可检测信号,模型组大鼠后肢肌电可见连续的阵发性簇状电信号出现(P<0.01),表现出模型大鼠的特殊症状特征。MFB-M 组动物在给予美多芭和百可利后,肌电频率分别比模型组降低37% 和55%,CPu-M 组动物给予美多芭和百可利后肌电频率分别比模型组降低31% 和60%(Fig 3)。

Fig 1 Effect of baicalein on rotational behavior in 6-OHDA unilaterally lesioned rats ±s, n=12)
A: 6-OHDA-MFB lesioned rats; B: 6-OHDA-CPu lesioned rats.**P<0.01vssham group

Fig 2 Effect of baicalein on spontaneous activity in 6-OHDA unilaterally lesioned rats ±s, n=12)
#P<0.05vs6-OHDA group;*P<0.05vssham group
MFB-M组与CPu-M组大鼠给予百可利治疗后,药物降低大鼠震颤频率的最大作用出现在约90 min,随后药物作用逐渐减弱。MFB-M 组,大鼠在给药后300 min 基本恢复给药前水平,而CPu-M组,大鼠给药后约在420 min 作用消失(Fig 4)。

Fig 3 Effect of baicalein on tremor in 6-OHDA unilaterally lesioned rats ±s, n=12)
A: Segments of tremor monitor activity profiles; B: Tremor frequency.#P<0.05vs6-OHDA group
2.4 百可利对大鼠纹状体神经递质水平的影响MFB-M组,模型组纹状体中的DA、DOPAC和HVA的含量明显降低,分别为假手术组2%、4% 和48% (P<0.01),各给药组对这种损伤的改善不明显;CPu-M组,模型组纹状体中的DA、DOPAC和HVA的含量降低程度略轻,分别为假手术组33%、47%、53%(P<0.05),各给药组对DA含量有明显的升高作用(P<0.05),但对其代谢产物无明显作用。美多芭组仅对DA代谢产物HVA有升高作用(Fig 5)。

Fig 4 Time-response of baicalein on tremor in 6-OHDA unilaterally lesioned rats ±s, n=8)
A: MFB model; B: MFB madopar (50 mg·kg-1); C: MFB baicalein (200 mg·kg-1); D: CPu model; E: CPu madopar (50 mg·kg-1); F: CPu baicalein (200 mg·kg-1)
2.5 免疫组织化学分析
2.5.1 大鼠损毁侧黑质TH 表达 假手术组大鼠黑质TH 免疫阳性神经元形态清晰,细胞胞体和纤维染色较深,有明显可见的免疫阳性突起。模型大鼠毁损侧黑质TH 免疫阳性神经元变性、坏死,胞质着色淡,细胞轮廓显示不清晰。
MFB-M组,模型组神经元数量为假手术组8%(P<0.01),给予美多芭和百可利治疗后,对TH 神经元数目的严重下降均有一定的改善趋势,分别为假手术组的16%和18%,但差异均无显著性。CPu-M组,模型组神经元数量为假手术组26%(P<0.05),给予美多芭和百可利治疗后,可明显提高TH 神经元数目,分别为假手术组的50%和57%(P<0.05)(Fig 6A、6B)。
2.5.2 大鼠损毁侧纹状体OX-42 表达 在假手术组大鼠纹状体中,OX-42 免疫阳性小胶质细胞少见。MFB-M组,损毁侧纹状体OX-42 免疫阳性小胶质细
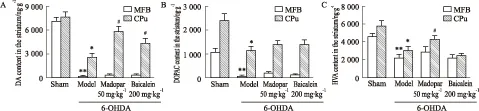

#P<0.05vs6-OHDA group;*P<0.05,**P<0.01vssham group

Fig 6 Effect of baicalein on TH and OX-42 immunostaining in substantia nigra and striatum of rat brain

胞数量明显增加,为假手术组的3.84倍(P<0.01),用美多芭和百可利治疗均可明显降低OX-42 免疫阳性小胶质细胞数量,分别下降到模型组49%、38% (P<0.01)。CPu-M组,损毁侧纹状体OX-42 免疫阳性小胶质细胞数量明显增加,为假手术组的3.69倍 (P<0.05),用美多芭和百可利治疗均可明显降低OX-42 免疫阳性小胶质细胞的数量,分别下降到模型组41%、56%(P<0.05)(Fig 6A、6C)。
2.6 神经元超微结构分析未注射6-OHDA 的大鼠神经元结构正常,核染色质均匀,无固缩,胞膜完整;细胞器,如:粗面内质网、核糖体、线粒体的超微结构均正常(Fig 7A、D)。MFB-M组中,可见明显固缩的神经元,核染色质成簇,细胞胞质电子密度增高,粗面内质网扩张呈空泡状,核糖体解聚,线粒体肿胀,嵴断裂,CPu-M 组黑质纹状体通路的损伤程度较MFB-M组略轻(Fig 7B、E)。给予百可利进行治疗后,神经元超微结构损伤情况均有不同程度的改善,表现为固缩神经元的数目减少,核与胞质电子密度降低,细胞器情况明显改善,空泡减少(Fig 7C、F)。
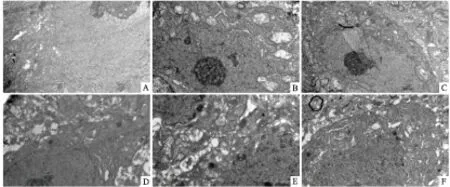
Fig 7 Effect of baicalein on changes of neurons
A~C: 6-OHDA-MFB lesioned rats. D~F: 6-OHDA-CPu lesioned rats. A, D: Sham. B, E: 6-OHDA. C, F: 6-OHDA + baicalein (200 mg·kg-1). Scale bars: 0.5μm
3 讨论
黑质纹状体通路注射6-OHDA 制备的PD 大鼠模型,均可出现肌电的震颤性信号,是PD的特异性行为学表现。本研究发现,黑质纹状体通路不同位点注射6-OHDA 后,其行为学表现和病理检查结果有一定的差异,动物自主活性状态、脑内DA 递质水平、残存神经元数量和神经元超微结构损伤程度均不同,说明不同注射位点制备的PD 模型能够反映PD 不同时期的病理变化,对于观察药物作用具有重要意义。皮下注射APO 诱导大鼠旋转是评价6-OHDA 损伤程度和模型是否成功的标准,但在考察药物的作用时不能仅仅参考这一个标准,还应结合更多与临床症状接近的指标进行全面评价。
百可利是本实验室采用高通量药物筛选技术,围绕PD 的发病机制和治疗药物靶点,经过系统筛选发现的对PD 具有治疗作用的化合物,经动物模型研究和综合评价,证明了百可利对PD 症状,尤其是对PD 引起的震颤有明显的改善[8-9]。本研究结果表明,百可利对单侧 MFB 位点与CPu 位点注射6-OHDA 后致PD 大鼠模型的震颤活动有明显抑制作用,但是在CPu-M组,百可利抑制震颤频率的效果更好,药效持续时间更长。
自主活动反映了动物的运动能力和中枢神经系统的兴奋程度,本实验结果显示,百可利对CPu位点注射6-OHDA 所致自主活动次数下降具有明显提高作用,这可能与百可利增加脑内DA水平有关。另外,给予百可利治疗后,在DA水平明显提高的情况下,其代谢产物DOPAC 和HVA 水平没有明显变化,说明百可利可能通过抑制单胺氧化酶B活性,影响DA 降解代谢过程,从而改善DA 失衡造成的PD 模型动物运动障碍和静止性震颤。而百可利对MFB 位点注射6-OHDA 所致自主活动降低仅有升高的趋势,与此相对应的是百可利对脑内DA水平表现出一定的升高作用,但差异无统计学意义。
McGeer等[10]于1988年在PD 患者的中脑黑质中发现了激活的小胶质细胞,激活的小胶质细胞产生超氧化物和免疫炎性因子损伤DA 能神经元,抑制小胶质细胞过度激活成为治疗PD 的手段之一[11-13]。本研究的结果显示,百可利在MFB-M组 和CPu-M 组中均显示出较强的抑制小胶质细胞过度激活的作用,这与早期文献报道的研究结果一致[14-15],提示百可利可通过抑制炎性介质的生成和释放,发挥其对DA 能神经元的保护作用。另外,由于MFB-M 组对DA能神经元损伤更严重,因此百可利在此模型中并未显示出明显增加DA能阳性神经元的作用。而在损伤较轻的CPu-M组,百可利则表现出明显的保护神经元的作用,并与递质检测和超微结构分析结果一致。
综上所述,黑质纹状体通路是PD 患者重要的生化和病理改变部位,不同位点的损伤可模拟PD发展的不同阶段,并在病理程度方面存在一定差异,表现为神经元丢失和残存神经元功能减退程度不同。本研究表明,连续给药3 周,百可利能够改善PD 不同发病时期模型动物的行为学症状,并通过抑制炎性介质生成和释放、保护残存神经元、恢复神经元功能而发挥对PD 的治疗作用。此外,由于百可利在模拟PD 早期损伤的模型中的疗效更突出,提示临床上对PD 的治疗应尽早用药,延缓疾病的进展。
[1] Deumens R, Blokland A, Prickaerts J. Modeling Parkinson′s disease in rats: an evaluation of 6-OHDA lesions of the nigrostriatal pathway[J].ExpNeurol, 2002, 175 (2): 303-17.
[2] Gaillard A, Decressac M, Frappé I, et al. Anatomical and functional reconstruction of the nigrostriatal pathway by intranigral transplants[J].NeurobiolDis, 2009, 35 (3): 477-88.
[3] 辛文妤, 宋俊科, 何国荣, 杜冠华. 黄芩素和黄芩苷的药理作用及机制研究进展[J]. 中国新药杂志, 2013, 22 (6): 647-53, 59.
[3] Xin W Y,Song J K,He G R,Du G H. Progress in pharmacological study and the underlying mechanism of baicalein and baicalin[J].ChinNewDrugJ, 2013, 22 (6): 647-53, 59.
[4] Gao L, Fang J S, Bai X Y, et al. In silico target fishing for the potential targets and molecular mechanisms of baicalein as an antiparkinsonian agent discovery of the protective effects on NMDA receptor-mediated neurotoxicity[J].ChemBiolDrugDes, 2013, 81 (6): 675-87.
[5] Li X X, He G R, Mu X, et al. Protective effects of baicalein against rotenone-induced neurotoxicity in PC12 cells and isolated rat brain mitochondria[J].EurJPharmacol, 2012, 674 (2-3): 227-33.
[6] Wang Y H, Yu H T, Pu X P, Du G H. Baicalein prevents 6-hydroxydopamine-induced mitochondrial dysfunction in SH-SY5Y cells via inhibition of mitochondrial oxidation and up-regulation of DJ-1 protein expression[J].Molecules, 2013, 18 (12): 14726-38.
[7] Mu X, He G R, Yuan X, et al. Baicalein protects the brain against neuron impairments induced by MPTP in C57BL/6 mice[J].PharmacolBiochemBehav, 2011, 98 (2): 486-91.
[8] Mu X, He G R, Cheng Y X, et al. Baicalein exerts neuroprotective effects in 6-hydroxydopamine-induced experimental parkinsonisminvivoandinvitro[J].PharmacolBiochemBehav, 2009, 92(4): 642-8.
[9] Yu X, He G R, Sun L, et al. Assessment of the treatment effects of baicalein on the parkinsonian tremor in rats[J].LifeSci, 2012, 91 (1-2): 5-13.
[10] McGeer P L, Itagaki S, Boyes B E, et al. Reactive microglia are positive for HLA-DR in the substantia nigra of Parkinson′s and Alzheimer′s disease brains[J].SeecommentinPubMedCommonsbelowNeurol, 1988, 38 (8):1285-91.
[11] 孙 斌, 罗 毅. 帕金森病的现代药物治疗[J]. 医药导报, 2005, 24 (2): 85-90.
[11] Sun B, Luo Y.Advance in medicine treatment for Parkinson′s disease[J].HerMed, 2005, 24 (2): 85-90.
[12] Luo X G, Chen S D. The changing phenotype of microglia from homeostasis to disease[J].TranslNeurodegener, 2012, 1 (1): 9.
[13] Vivekanantham S, Shah S, Dewji R, et al. Neuroinflammation in Parkinson′s disease: role in neurodegeneration and tissue repair[J].IntJNeurosci, 2014, 124 (11): 1-17
[14] 沈 琮, 张 兰, 李 林. 以α-synuclein为靶点的抗帕金森病药物研究进展[J]. 中国药理学通报, 2014, 30 (2): 149-53.
[14] Shen C, Zhang L, Li L. Advance in research on anti-Parkinson′s disease drugs targeting α-synuclein[J].ChinPharmacolBull, 2014, 30 (2): 149-53.
[15] Li F Q, Wang T, Pei Z, et al. Inhibition of microglial activation by the herbal flavonoid baicalein attenuates inflammation-mediated degeneration of dopam inergic neurons[J].JNeuralTransm, 2005, 112 (3): 331-47.
Effect of baicalein on brain injury induced by 6-hydroxydopamine at different sites in rats
HE Guo-rong1, MU Xin1, LI Xiao-xiu1, WANG Yue-hua1, FANG Lian-hua1,SUN Lan1, LYU Yang2,3, DU Guan-hua1,3
(1.BeijingKeyLaboratoryofDrugTargetsIdentificationandDrugScreening, 2.BeijingKeyLaboratoryofPolymorphicDrug,3.StateKeyLaboratoryofBioactiveSubstanceandFunctionofNaturalMedicines,InstituteofMateriaMedica,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100050,China)
Aim To explore the therapeutical effect and mechanism of baicalein on two 6-hydroxydopamine (6-OHDA) induced Parkinson′s disease (PD) rat models, which
unilateral lesions of the left medial forebrain bundle (MFB) or caudate putamen (CPu) made by stereotaxic injection of 6-OHDA (MFB-M, CPu-M). Methods PD rat models were established by microinjection of 6-OHDA into MFB or CPu. The anti-tremor effect of baicalein on PD rat models was examined. Spontaneous activity was recorded. Dopamine (DA), dihydroxyphenylacetic acid (DOPAC) and homovanilic acid (HVA) in striatum were quantified by HPLC-ECD. The tyrosine hydroxy-lase (TH) and OX-42 positive cells were detected by immunohistochemical method. The morphological variation of the neurons was confirmed by analysis at an ultrastructural level. Results Baicalein significantly increased the spontaneous activity in CPu-M. The electromyography (EMG) recordings revealed that compared with 6-OHDA group, the tremor frequency in baicalein group was decreased by 55% in MFB-M, and by 60% in CPu-M. 6-OHDA treatment decreased DA levels in the striatum, while treatment with baicalein attenuated the DA decreases in CPu-M. Moreover, baicalein treatment could increase TH-positive neurons and decrease OX-42-postive microglia compared with 6-OHDA group in both MFB-M and CPu-M. Conclusions In the present study, it is illustrated that ① microinjection of 6-OHDA into the MFB and the CPu could cause different pathological changes of PD, which is important for efficacy evaluation; ② baicalein showed the ability to alleviate the behavior symptoms in PD-rats at different stages by improving motor function and attenuating muscle tremor; ③ therapeutic effect of baicalein was produced by inhibiting the inflammatory medium production and release, anti-apoptosis, changing dopamine catabolism, and inhibiting dopamine turnover.
baicalein; Parkinson′s disease; 6-hydroxydopamine; nigrostriatal pathway; medial forebrain bundle; caudate putamen; neuroprotective
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.009.html
2015-02-07,
2015-03-02
国家科技部“重大新药创制”科技重大专项“(No 2013ZX09102106,2013ZX09508104,2012ZX09301002001 001,2013ZX09103001-008,2012ZX09103101-078);国家自然科学基金资助项目(No 81473383)
何国荣(1974-),女,博士,助理研究员,研究方向:新药发现与神经药理学,Tel/Fax:010-63165184,E-mail: hegr@imm.ac.cn; 杜冠华(1956-),男,博士,研究员,博士生导师,研究方向:新药发现与神经药理学,通讯作者,Tel/Fax:010-63165184,E-mail: dugh@imm.ac.cn
10.3969/j.issn.1001-1978.2015.05.008
A
1001-1978(2015)05-0623-08
R-332;R322.81;R282.71;R745.705.31
