血清IL-8、IgE、TNF-α和外周血EOS水平在儿童哮喘中的表达及意义
2015-06-09曾静靳蓉陈敏邱杰
曾静,靳蓉,陈敏,邱杰
论著·临床
血清IL-8、IgE、TNF-α和外周血EOS水平在儿童哮喘中的表达及意义
曾静,靳蓉,陈敏,邱杰
目的 观察哮喘患儿血清白介素-8(IL-8)、免疫球蛋白E(IgE)、肿瘤坏死因子-α(TNF-α)和外周血嗜酸性粒细胞(EOS)水平的变化,并探讨其临床意义。方法 对2013年8月—2014年8月收治的52例儿童哮喘患者(哮喘组)的血清IL-8、IgE、TNF-α和外周血EOS水平进行检测,同时选择52例健康儿童(健康对照组)进行同期检测,比较哮喘组患儿治疗前、治疗3个月后及与健康对照组血清IL-8、IgE、TNF-α水平及外周血EOS计数,并分析不同病理阶段、不同病程血清IL-8、IgE、TNF-α水平和外周血EOS计数差异。结果 哮喘组治疗前血清IL-8、IgE、TNF-α水平和外周血EOS计数均明显高于健康对照组,差异有统计学意义(t=3.027、2.896、2.273、2.196,P<0.05);哮喘组治疗后血清IL-8、IgE、TNF-α水平和外周血EOS计数均明显低于治疗前,差异有统计学意义(t=2.992、2.735、2.254、2.201,P<0.05);哮喘发作组的IL-8、IgE、TNF-α水平和EOS计数均高于哮喘缓解组(t=2.886、2.205、2.153、2.124,P均<0.05);哮喘持续发作组IL-8、IgE、TNF-α、EOS计数等指标均明显高于其他哮喘发作组和哮喘缓解组,且差异均有统计学意义(其他哮喘发作组:t=2.836、3.124、2.995、2.854;哮喘缓解组:t=3.735、4.002、3.834、3.656,P均<0.05);且其他哮喘发作组患儿的IL-8、IgE、TNF-α、EOS水平也均高于哮喘缓解组,差异具有统计学意义(t=2.267、2.894、2.241、2.207,P均<0.05);病程>1年组IL-8、IgE、TNF-α、EOS计数水平均明显高于病程≤1年组,且差异均有统计学意义(t=2.349、3.122、2.126、2.858,P<0.05)。结论 血清IL-8、TNF-α、IgE和外周血EOS水平在支气管哮喘发病中起着重要作用。
哮喘,儿童;白介素-8;肿瘤坏死因子-α;免疫球蛋白E;嗜酸性粒细胞
哮喘是儿童时期最常见的慢性疾病,以反复发作性的呼吸困难为主要临床表现。虽经有效的积极治疗后绝大多数患者预后良好,但临床上常出现急性加重的情况,如不及时处理可在短时间内迅速恶化,甚至威胁患儿生命[1]。据估计,全世界每年因哮喘死亡的患者高达10万之多,既往研究发现,哮喘患儿血嗜酸性粒细胞(EOS)显著升高,EOS 阳离子蛋白(ECP) 作为EOS 活性和转归标志,已经广泛用于与EOS 密切相关疾病(如哮喘、变应性鼻炎) 的诊断和疗效判定[2]。另外,临床普遍认为肿瘤坏死因子(TNF-α)与IgE在哮喘的发生中发挥着重要的作用[3]。所以,本文探讨儿童哮喘患者血清白介素-8(IL-8)、TNF-α、免疫球蛋白E(IgE)和外周血EOS水平变化的临床意义,现报道如下。
1 资料与方法
1.1 一般资料 2013年8月—2014年8月在我院进行治疗的52例儿童哮喘患者作为哮喘组,所有患者均符合中华医学会儿科学分会呼吸学组2008 年修订的“儿童哮喘诊断标准”[4],其中男29例,女23例,年龄2~13 (7.2±2.1)岁;均为首次发病,急性发作者40例,缓解期者12例;病程≤1年者41例,>1年者11例。选择门诊体检的健康儿童52例作为健康对照组,其中男28例,女24例,年龄2~13 (6.9±3.0)岁。2组患儿的性别、年龄等资料比较差异无统计学意义(P>0.05),具有可比性。患儿家属均知情同意并签署同意书。
1.2 纳入与排除标准 纳入标准:(1)符合“儿童哮喘诊断标准”;(2)年龄2~13岁,男女均可,为以往未经规范治疗的初诊哮喘患儿,病情评价为轻、中度; (3)家长同意配合;(4)随访1 年。排除标准:(1)其他疾病所引起的喘息、咳嗽;(2)既往诊断过敏性疾病者;(3)既往有哮喘病史或服用过抗哮喘药物者;(4)近期使用过抗白三烯及糖皮质激素类药物者;(5)年龄<2岁。
1.3 治疗方法 常规应用氨茶碱、激素、β2受体激动剂、抗过敏药等药物,并加用孟鲁司特钠(顺尔宁,杭州默沙东公司生产)口服,用法为2~5岁4 mg,5~13岁5 mg,每晚1 次,疗程2 周。自试验第1天始皮下注射胸腺肽治疗,每次肌肉注射0.05~0.1 mg/kg,每周2次,一般经3~6个月病情稳定后改为每周1次。
1.4 观察指标与方法 观察哮喘组患儿治疗前、治疗3个月后血清IgE、IL-8、TNF-α及外周血EOS水平,并分析不同病理阶段、不同病程血清IgE、IL-8与TNF-α水平差异。与健康对照组进行比较:(1)血清IgE、IL-8与TNF-α水平测定:采集外周静脉血2~3 ml 于普通玻璃管中,以3 000 r/min 离心10 min,取上清加于小离心管中,置-20 ℃保存( 凝血不良或溶血标本除外),采用酶联免疫吸附试验(ELISA),试剂盒由海南华美生化有限公司提供,MRm型酶标仪测定由美国Hyperion生产,测量器采用EJ-2003型全自动6-免疫计数器(由西安262厂生产提供),严格按产品说明书操作,每项实验每次均同步制作标准曲线。(2)外周血EOS测算:各采清晨空腹肘静脉血5 ml,测定外周血白细胞计数及分类,从而计算出外周血EOS 绝对和相对计数( 正常参考值:相对范围0.5%~5.0%,绝对值< 0.5×109/L)。

2 结 果
2.1 治疗前后血清IL-8、IgE、TNF-α水平和外周血EOS的水平变化 哮喘组治疗前血清IL-8、IgE、TNF-α水平和外周血EOS计数均明显高于健康对照组,差异有统计学意义(t=3.027、2.896、2.273、2.196,P>0.05);哮喘组治疗后血清IL-8、IgE、TNF-α水平和外周血EOS计数均明显低于治疗前,差异有统计学意义(t=2.992、2.735、2.254、2.201,P<0.05)。见表1。
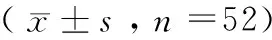
表1 2组血清IL-8、IgE、TNF-α水平和外周血EOS计数变化
注:与健康对照组比较,aP<0.05;与哮喘组治疗前比较,bP<0.05
2.2 哮喘发作组、缓解组血清IL-8、IgE、TNF-α水平和外周血EOS计数的比较 哮喘发作组的IL-8、IgE、TNF-α水平和EOS计数均高于缓解组 (t=2.886、2.205、2.153、2.124,P均<0.05)。见表2。
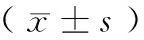
表2 哮喘发作组、缓解组血清IL-8、IgE、TNF-α水平和外周血EOS计数比较
2.3 哮喘持续状态者与其他哮喘发作者、哮喘缓解组IL-8、IgE、TNF-α、EOS计数等指标的比较 哮喘持续状态组IL-8、IgE、TNF-α、EOS计数等指标均明显高于其他哮喘发作组和哮喘缓解组,且差异均有统计学意义(其他哮喘发作组:t=2.836、3.124、2.995、2.854;哮喘缓解组:t=3.735、4.002、3.834、3.656,P均<0.05);而且其他哮喘发作组患儿的IL-8、IgE、TNF-α、EOS水平也均高于哮喘缓解组,差异具有统计学意义(t=2.267、2.894、2.241、2.207,P均<0.05)。见表3。
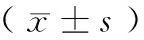
表3 哮喘持续状态组与其他哮喘发作组、哮喘缓解组各指标水平的比较
注:与哮喘持续状态组比较,aP<0.05;与哮喘缓解组比较,bP<0.05
2.4 不同病程哮喘血清IL-8、IgE、TNF-α、EOS计数比较 病程>1年组IL-8、IgE、TNF-α、EOS计数水平均明显高于病程≤1年组,且差异均有统计学意义(P<0.05)。见表4。
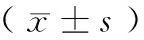
表4 儿童哮喘不同病程血清各指标水平比较
3 讨 论
1 胡亚美,江载芳,诸福棠.实用儿科学[M].北京:人民卫生出版社,2002:1204-1205.
2 沈华浩.哮喘手册[M].北京:人民卫生出版社,2004:6-7.
3 翁艳.102例支原体感染患儿血嗜酸性粒细胞和IgE分析[J].浙江临床医学,2006,8(2):172-173.
4 龙振洲.医学免疫学[M].北京,人民卫生出版社,1995:154.
5 乔红梅,庞焕香,张云峰,等.肺炎支原体肺炎患儿IL-6、IL-10、TNF-α的变化[J].临床儿科杂志,2012,30(1):59-61.
6 陶绍华.嗜酸性粒细胞阳离子蛋白在支气管哮喘中的研究[J].四川解剖学杂志,2012,20(1):39-42.
7 尹嘉宁,刘丽,成焕吉,等.半胱氨酰白三烯、白介素10和肿瘤坏死因子α在肺炎支原体肺炎发病机制中的作用[J].临床儿科杂志,2011,29(8):708-710.
8 Dorigo-Zetsma JW,Zaat SA,Vriesenm AJ,et al.Demonstration by a nested PCR for Mycoplasma pneumoniae that M.pneumoniae load in the throat is higher in patients hospitalised for Mpneumoniae infection than in nonhospitlisedsuhjects[J].J Med Miembiol,1999,48(12):1115-1122.
9 Di Lorenzo G,Pacor ML,Morici G,et al.Measurement of inflammatory mediators of eosinophils and lymphocytes in blood in acute asthma: Serum levels of ECP influence the bronchodilator response[J].Int Arch Allergy Immunol,2002,127(4):308-315.
10 徐琳玲,华雪玲,陈晓东,等.儿童哮喘血浆肿瘤坏死因子活性观察[J].中华结核和呼吸杂志,1995,18(3):135.
11 Najam FI,Giasuddin AS,Shembesh AN.Tumour necrosis factors in childhood asthma[J].Indian J Pediatr,2001,68(3):217-222.
12 周月朋,李俊杰,李晓东,等.支气管哮喘患儿外周血 IL-27、IL-35及 EBI3的表达变化及意义[J].解放军医药杂志,2014,26(7):71-74.
13 高虹,刘艳琳,陈燊,等.哮喘儿童呼出气一氧化氮与肺功能、激发试验、哮喘控制测试评分相关性研究[J].中国中西医结合儿科学,2014,6(2):119-122.
14 刘金凤.哮喘患儿嗜酸性粒细胞、IL-4及IFN-γ检测的临床意义[J].中国儿童保健杂志,2014,22(1):96-98.
15 李晓嫱,胡文芳,孙子辉,等.哮喘高危儿脐血哮喘基因和IgE检测的意义[J].中国当代医药,2014,21(6):60-61.
16 曹奇峰,张宇虹.孟鲁司特对咳嗽变异性哮喘患者超敏C反应蛋白、白介素4和肿瘤坏死因子-α水平的影响及疗效观察[J].中国医药导报,2013,10(26):87-89.
The expression of IL-8,TNF-α, IgE and peripheral blood EOS level in children with asthma
ZENGJing*,JINRong,CHENMin,QIUJie.*Grade2012PostgraduateofGuiyangMedicalCollege,Guiyang550002,China
Objective To observe the changes of serum interleukin 8 (IL-8),tumor necrosis factor-α(TNF-α), immunoglobulin E (IgE) and peripheral blood eosinophils (EOS) level in asthma children, and investigate its clinical significance.Methods From August 2013 to August 2014, 52 cases of children with asthma (asthma group) were enrolled, serum IL-8, TNF-α, IgE and peripheral blood EOS levels were detected, at the same time, selected 52 cases of healthy children as healthy control group, the same item were detected, before and three months after therapy, serum IL-8, TNF-α, IgE levels and peripheral blood EOS count were compared between asthma group and healthy control group, and analyzed the differences of serum IL-8,TNF-α,IgE levels and peripheral blood EOS count in different pathological stages, different course.Results Before treatment, asthma group’s serum IL-8, IgE, TNF-α levels and peripheral blood EOS counts were significantly higher than the control group, the difference was statistically significant (t=3.027,t=2.896,t=2.273,t=2.196,P<0.05); after treatment, asthma group’s serum IL-8, IgE, TNF-α levels and peripheral blood EOS counts were significantly lower than before treatment, the difference was statistically significant (t=2.992,t=2.735,t=2.254,t=2.201,P<0.05);IL-8,IgE,TNF-α level and EOS counts in the asthma episode group were higher than asthma release group (t=2.886,t=2.205,t=2.153,t=2.124,P<0.05); asthma persistent attack group’s IL-8, IgE, TNF-α, EOS count are significantly higher than other asthma episode groups and asthma release group, and the differences were statistically significant (other asthma episode group:t=2.836,t=3.124,t=2.995,t=2.854; asthma release group:t=3.735,t=4.002,t=3.834,t=3.656,P<0.05); and other asthma episode group’s IL-8, TNF-α levels were also higher than asthma release group, the difference was statistically significant (t=2.267,t=2.894,t=2.241,t=2.207,P<0.05);duration> 1 year group’s IL-8, IgE, TNF-α, EOS counts were significantly higher than that of the duration ≤1 year group, and the differences were statistically significant (t=2.349,t=3.122,t=2.126,t=2.858,P<0.05).Conclusion Serum IL-8, TNF-α, IgE levels and peripheral blood EOS plays an important role in the pathogenesis of asthma.
Asthma; Children;Interleukin-8;Tumor necrosis factor-α;Immunoglobulin E; Peripheral blood eosinophils
550002 贵阳医学院2012级研究生(曾静); 贵阳市妇幼保健院儿科(靳蓉、陈敏、邱杰)
10.3969 / j.issn.1671-6450.2015.06.016
2014-11-26)
