大鼠脑缺血模型致不同类型行为学特点及其与梗死体积关系的研究
2015-06-09张乾毛善平李涛周琴谭杰
张乾,毛善平,李涛,周琴,谭杰
论著·基础
大鼠脑缺血模型致不同类型行为学特点及其与梗死体积关系的研究
张乾,毛善平,李涛,周琴,谭杰
目的 分析线栓法制作大鼠大脑中动脉阻塞(MCAO)脑缺血模型不同类型的行为学特点,以及行为学表现与脑梗死体积之间的关系。方法 成年雄性SD大鼠101只,线栓法制作MCAO脑缺血模型,栓塞100 min后再灌注,术后24 h进行磁共振成像(MR)扫描确定梗死部位及梗死灶体积。根据脑梗死部位不同将大鼠分为:皮质梗死组(CIG,n=51)、皮质下梗死组(SIG,n=24)和无梗死组(NIG,n=26)。采用前肢使用不对称测试、前肢放置测试和神经功能缺损程度(NSS)评分等多种行为学评价方法,评价各组大鼠MCAO术后第2天的神经功能缺失症状。并分析不同行为学特点与梗死体积之间的关系。结果 在前肢使用不对称测试中,CIG组、SIG组分别与NIG组有统计学差异(q=3.72、3.28,P<0.05),而CIG组、SIG组之间无统计学意义(q=0.44,P>0.05);在肢体放置测试与NSS评分中,CIG组与SIG组、NIG组之间均有显著的统计学差异(q=10.28、12.02;11.48、11.98,P<0.01),而SIG组与NIG组之间均无统计学差异(q=1.74、0.50,P>0.05)。CIG组、SIG组大鼠的脑梗死体积大小与前肢使用不对称、肢体放置、NSS这3种行为学表现之间均无相关性(CIG组:r=-0.087、0.243、-0.226;SIG组:r=0.279、0.010、0.110,P>0.05)。结论 制作大鼠MCAO模型可以出现不同的梗死类型,各种类型的行为学表现特点也不完全一样,出现这种差异可能与梗死灶体积的大小无关,而与梗死类型有关。
大脑中动脉阻塞模型;大鼠;类型;行为学;脑梗死体积
制作局灶性脑缺血动物模型有许多种,其中线栓法造成短暂性大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)是研究大鼠局灶性脑缺血普遍使用的模型制作方法[1,2]。自1986年Koizumi等[3]和1989年Longa等[1]分别采用血管内线栓法可逆性地阻断大鼠大脑中动脉制成脑缺血再灌注损伤模型后,由于它的可重复性、可靠性以及与人类脑血管疾病的症状具有很大的相似性等特点,至今仍得到广泛的应用。但是由于种种原因, 包括线栓阻塞时间的长短、手术过程、动物种系以及缺血后观察时间等使制作大鼠脑缺血模型的类型存在一定差异[4],另外加上各种行为学评价方法的侧重点也不同,因而可能导致实验结果变得更加复杂难以分析,实验结果出现偏差。本实验在控制相同的实验操作、实验条件下,选择相同种系一定体质量的大鼠,在同一时间点观察鼠单侧大脑中动脉脑缺血100 min后再灌注的脑梗死类型的行为学特点与梗死灶体积之间的关系,报道如下。
1 材料与方法
1.1 材料 (1)实验动物:成年健康SPF级雄性SD大鼠101只,体质量约300 g,2.5月龄,购自武汉大学动物实验中心。大鼠术前饲养于武汉大学人民医院实验动物中心标准饲养笼里,5只/笼,饲养室通风良好,并维持23℃恒温,湿度45%~55%,光照周期12 h开/12 h关,所有大鼠饲养在干净的塑料笼具里,垫料、饮用水及食物均经过灭菌处理,自由进食、取水[5]。(2)主要试剂和仪器设备:麻醉用水合氯醛由中国医药上海化学试剂公司生产。尼龙线栓购至北京沙东生物技术有限公司。Biospec4.7/30超导磁共振成像仪由中国科学院武汉物理与数学研究所的波谱与原子分子物理国家重点实验室提供。数码摄像机DCR-SR100E由日本索尼公司生产。
1.2 实验方法及分组 (1)MCAO动物模型的制作:参照Zea Longa[1]的线栓造模方法,并进行部分改良[6]。术中及术后保持室温25℃左右,用白炽灯照射动物以维持其直肠温度在(37±1)℃,直到恢复活动[7]。(2)磁共振(MR)扫描、分组、梗死体积计算: 在MCAO术后24 h,将所有大鼠在Biospec4.7/30超导磁共振成像仪进行MR扫描。大鼠经麻醉后(5%水合氯醛,0.65 ml/100 g,腹腔注射[8])进行脑部T2加权成像(T2WI)扫描,具体参数如下:TR/TE=3 000/20 ms,6回波,FOV=3.5 cm×3.5 cm,切片厚度=0.8 mm,切片间距=0.8 mm,相邻两层中心距离=1.6 mm,矩阵=128×128,NA=1。第一张切片从嗅球起始部(前囟前5.5 mm[9])开始。
根据大鼠在MCAO后24 h进行MR扫描结果分为3组[9]:皮质和基底节区梗死(cortical-basal ganglia infarction group,CIG组)51例、皮质下基底节区梗死(subcortical infarction group,SIG组)24例,无梗死(non-infarction group,NIG组)26例。
大鼠MCAO后梗死体积利用类似微积分的方法,先在MR上测量出每个层面上的面积,再用面积之和乘以相邻2个层面的距离即可得脑梗死体积大小,其公式如下:V=∑Si×L (注:V=脑梗死体积,Si=各层梗死面积,L=相邻两层中心距离)。
1.3 观测内容
1.3.1 行为学测试(behavioral tests): 用前肢使用不对称测试、肢体放置测试评价3组大鼠的感觉运动功能。所有的行为学测试通过盲法,即由不清楚分组的其他人员在MCAO术后第2天进行。(1)前肢使用不对称测试(forelimb use asymmetry test): 用于评价大鼠在自发探索性活动中前肢使用的不对称性[10]。此项目是测试大鼠活动时前肢使用的不同比率情况,一般情况下左前肢的使用率略高于右上肢。具体方法如下:用录影机监控大鼠在一个透明圆柱体(直径20 cm、高30 cm)内活动3~10 min过程中的前肢使用状况,观察时间取决于其运动活跃度,在圆柱体旁边以一定角度放置两面镜子,当大鼠转身背对镜头时也能观察到其前肢的运动情况[11]。采用盲法,即由另1名实验者利用录影带慢放和停放功能记录大鼠的活动状况。大鼠的行为表现分为如下2种形式:①大鼠用双后肢完全直立时,单独使用左前肢或右前肢接触圆柱体壁,以完成其身体移动的动作,或通过侧移在身体直立状态下重新找回其重心;②在使用后肢完全直立时,双前肢同时接触圆柱体壁,或者沿着圆柱体壁做侧移动作,行为评分方法如下[12]:未损伤(右侧)前肢的触壁次数占双前肢触壁总数的百分比(I),损伤(左侧)前肢的触壁次数占双前肢触壁总数的百分比(C),双前肢同时(或几乎同时)触壁的次数占总触壁次数的百分比(B)。单肢使用不对称计算公式为:前肢使用不对称指数=[I / (I+C+B)]-[C / (I+C+B)]。(2)肢体放置(limb placemen test):评价大鼠前肢和后肢对触觉和本体感觉刺激的感觉运动整合能力,共包括7个测试项目[13]:①大鼠悬在桌面上方10 cm处,正常情况下,两侧前肢扑向桌面;②大鼠正对桌子,前肢放在桌缘,每侧前肢被轻轻拉下,观察其重返及放置情况。正常情况下,大鼠可将前肢重新放在桌缘;③保持大鼠头上抬45°,以防止大鼠看见或通过胡须感触到桌子,其余步骤同上;④将大鼠沿桌缘放在桌边,观察其前肢的侧放能力;⑤将大鼠沿桌缘防在桌边,观察其后肢的侧放能力;⑥大鼠正对桌子,后肢放在桌缘,每侧后肢被拉下,然后向桌缘轻推;⑦大鼠前肢放在桌缘,从后朝桌缘轻推大鼠,正常大鼠抵抗这种推力,而受伤大鼠不能保持抓握,受损前肢从桌边滑落。评分标准为:不能正常完成(0分),不完全或迟疑(>2 s)完成(1分),迅速正确完成(2分)。
1.3.2 神经功能缺损程度(neurological severity score,NSS)评分: 评价大鼠肢体的运动功能和身体的平衡感觉[14,15],其评价包括2项:(1)运动测试。大鼠提尾悬空,前肢屈曲得1分、后肢屈曲得2分、30 s内大鼠头与其身体纵轴角度>10°得3分;将大鼠放在地面,正常行走为0分、无法沿直线行走为1分、朝瘫痪侧转圈为2分、倒向瘫痪侧为3分。(2)横木平衡测试。姿势稳定保持平衡(0分);抓住横木的边缘(1分);抱住横木,一侧肢体从横木上滑落(2分);抱住横木,两侧肢体均从横木上滑落,或在横木上旋转>60 s(3分);尝试保持平衡,但从横木上跌落>40 s(4分);尝试保持平衡,但从横木上跌落>20 s(5分);未尝试在横木上保持平衡或未试图紧紧抓住横木<20 s(6分)。总共12分,分值越高表明损伤越严重。
1.4 统计学方法 采用SPSS 17.0软件进行统计学分析。计量数据以均数±标准差表示,比较采用方差分析或LSD检验,采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 行为学特点 (1)前肢使用不对称测试:发现CIG、SIG组大鼠对健侧肢体的使用率均高于NIG组。ANOVA分析发现组间比较有显著性差异(F=13.776,P<0.01);LSD法进行两两比较:CIG、SIG组分别与NIG组比较均有统计学差异(q=3.72、3.28,P<0.05),而CIG、SIG组之间比较无统计学差异(q=0.44,P>0.05),说明CIG、SIG 2组大鼠对右侧肢体的依赖性均较高,且对左侧(患侧)肢体的使用频率下降。(2)肢体放置测试发现:CIG组大鼠肢体放置测试分值明显低于其他2组,且SIG和NIG组测试分值非常接近。ANOVA分析发现组间有显著性差异(F=24.059,P<0.01);LSD法进行两两比较:CIG组与SIG、NIG组比较均有统计学差异(q=10.28、12.02,P<0.01),而SIG组与NIG组比较无统计学差异(q=1.74,P>0.05)。说明CIG组大鼠前肢和后肢对触觉和本体感觉刺激的感觉运动整合能力较差,而SIG组的这些能力在缺血再灌注后2 d内就自行恢复得与NIG组无差异。(3)NSS评分:CIG组大鼠NSS评分明显高于其他2组,且SIG和NIG组得分非常接近。ANOVA分析发现组间有显著性差异(F=34.875,P<0.01);LSD法进行两两比较: CIG组与NIG组比较差异有统计学意义(q=11.98,P<0.01),CIG与SIG组比较差异有统计学意义(q=11.48,P<0.01),而SIG组与NIG组比较无统计学意义(q=0.50,P>0.05)。说明CIG组大鼠神经功能缺损程度较严重,而SIG组大鼠的运动功能和平衡觉在缺血再灌注后2 d内可自行恢复,与NIG组差异无统计学意义。见表1。
注:与NIG比较,aP<0.05,bP<0.01,与SIG比较,cP<0.01
2.2 行为学与梗死体积的关系 CIG组为脑梗死体积(176.1±53.1)mm3,SIG组(86.0±25.2)mm3,因资料不满足双变量正态分布,采用Spearman相关分析。将CIG与SIG组大鼠的脑梗死体积大小与行为学表现进行直线回归分析(见图1)。CIG、SIG组大鼠的脑梗死体积大小与前肢不对称、肢体放置、NSS这3种行为学测试的结果之间均无相关性(CIG组:r=-0.087、0.243、-0.226;SIG组:r=0.279、0.010、0.110,P>0.05)。说明2组大鼠行为学表现可能均与脑梗死体积大小无关。见图1。
3 讨 论
3.1 影响大鼠脑缺血模型不同类型的因素 从实验结果中可以看出用线栓法建立大鼠MCAO脑缺血再灌注模型,可有皮质梗死及基底节区均梗死和仅有皮质下基底节区梗死2种类型,2005年Wegener等[16]也观察到MCAO法制作的Wistar大鼠60 min脑缺血模型在MR下表现为2种不同的类型:(1)皮质下梗死:损伤部位局限在皮质下的尾壳核;(2)皮质梗死:损伤部位包括了尾壳核以及皮质。Rosell等[17]用缺血30 min和缺血120 min分别诱导出轻症(基底节区)和重症(皮质及基底节区)的梗死,他们认为出现这些结果可能是脑梗死与距离再灌注的时间不一样造成的,时间越长,造成的脑梗死范围越广。而我国学者管玉青等[18]在大脑中动脉缺血120 min后再灌注同样也造成了不同范围的脑梗死,他们认为MCAO模型中梗死的范围并非只由血流中断时间决定,而线栓头端的位置和实验动物本身的脑血管代偿状态可能是决定梗死范围大小的关键因素。也有学者认为是由于脑血流下降的程度不同造成的,他们在造模时使用多普勒血流监测进行判断,当血流降到基础值的10%~20%即认为造模成功,但在他们的研究中,仍然发现了皮质梗死和皮质下梗死2种类型的脑梗死[19,20]。因此,多普勒血流监测似乎对避免皮质下梗死的形成没有帮助。在我们先前的研究中也发现[21],在MCAO后100 min进行再灌注,也发现了这几种不同的梗死类型,而且还发现这一结果与线栓的插入深度有关,线栓插入越深,皮质梗死的几率越大,可能造成的脑梗死的范围也越大。所以短暂MCAO法造模可以出现不同的类型,这可能是脑缺血时间、线栓插入深度及大鼠自身的血管差异等因素的综合结果。但是我们在既往的实验中还发现了仅累及皮质的梗死类型,但数量极少[9],尚不能分析其形成原因,还有待于进一步研究。
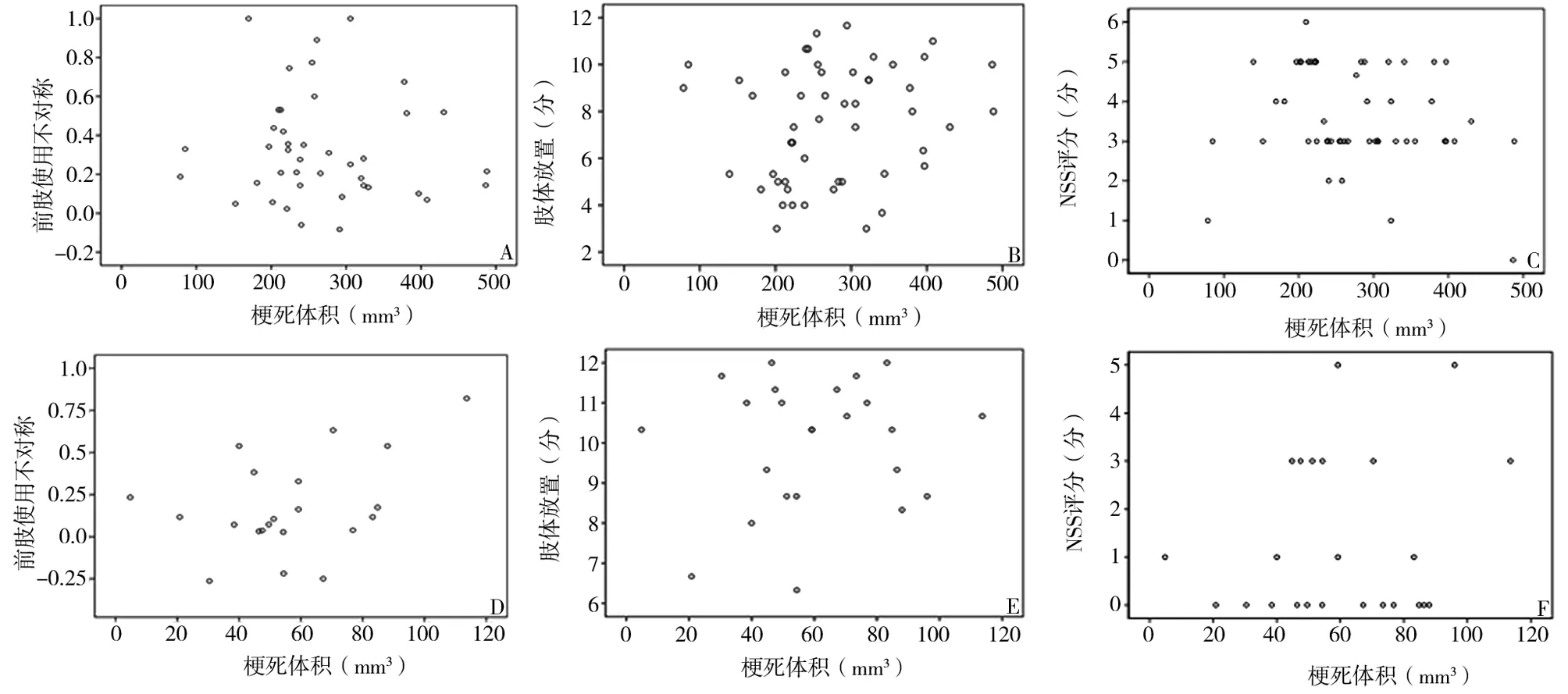
注:A、B、C为CIG组;D、E、F为SIG组
3.2 大鼠脑缺血模型不同类型的行为学特点 Wegener等[22]在实验中发现,2种不同梗死类型的行为学表现不同,皮质梗死大鼠的神经功能缺损较皮质下大鼠明显严重,在他们认为导致这种差异的原因可能是由于线栓栓塞位点的侧支循环或者残余的血流灌注,使得缺血性损伤的严重程度不足以引起神经纤维损伤,因此未出现相应的神经功能缺失症状。我们在先前的究中也发现了皮质下梗死组大鼠的神经功能缺损可以在短期内即可恢复[9],这可能是因为在MCAO后脑缺血导致皮质兴奋性丧失和皮质下区轴突传导阻滞使得锥体运动功能迅速丧失,而再灌注可以逐渐使轴索的传导功能得以恢复,而运动障碍依然存在的原因在于运动皮质区电活动衰竭后突触传导功能缺失[23]。但是这一现象的具体机制尚需进一步研究探讨。
正是因为在制作MCAO模型中存在着不同的类型,而各种类型的行为学表现也不一样,因此研究者在实验过程中的处理方式也不一样,有的研究者对MCAO模型的动物直接进行各种干预实验研究[24],这样就会因为皮质下梗死大鼠的神经功能缺损自行恢复而有可能影响实验结果;有的学者对MCAO模型进行区分后直接选取皮质梗死的动物进行实验[25],这样虽然避免了假阳性结果的出现,但实验的代价明显增高。而从我们本次的实验结果可以看出,由于行为学各种评价方法本身的侧重点不同,其实验结果也会不一样,所以在研究中可以根据自己的实验要求来区别对待。前肢使用不对称测试是评价双前肢在活动中使用前肢的不同情况,大鼠在正常情况下,左前肢的使用略多于右前肢,在造成右侧脑梗死后,左前肢的活动明显减少[10,11]。我们发现CIG、SIG 2组大鼠在梗死后均使用右侧(健侧)肢体,而对左侧(患侧)肢体的依赖较少,使用这种评价方法来测试MCAO大鼠的前肢活动情况可以不用区分造模后脑梗死的类型。肢体放置测试是评价大鼠瘫痪侧前肢和后肢对触觉和本体感觉刺激的感觉运动整合能力[13],NSS评分是评价大鼠的运动和整体平衡能力[14,15]。在这2种测试方法中,我们都发现在CIG组与NIG、SIG组之间均有统计学差异,而SIG组与NIG组之间均无统计学差异,说明CIG组大鼠神经功能缺损程度较严重,其瘫痪肢体的运动、感觉、平衡能力一直没有恢复,而SIG组大鼠的这些能力可自行恢复,与NIG组无差异。因此在实验中用2种行为学方法来评价干预措施的效果时,有必要筛选出皮质梗死的大鼠来进行,以避免皮质下梗死大鼠自身的特点对实验结果的影响。
3.3 行为学与梗死体积的关系 大多数学者认为大鼠脑梗死体积越大,导致的神经功能缺损也越严重,其行为学表现也不一样,可能会因为脑梗死体积不一样而影响实验结果。但是在本实验中的3种行为学评价方法中,我们分别对2种类型大鼠的行为学表现与其梗死体积大小之间进行相关分析,发现均没有统计学意义,说明这3种方法的行为学表现可能与梗死体积大小无关,仅与大鼠的梗死类型有关。因此,在某些实验研究中,利用这3种方法来评价干预措施对各类型脑梗死的效果时,可能不需要考虑梗死体积的大小。
综上,本实验在利用改良的MCAO模型进行研究中,发现了各种不同梗死类型的模型,并且利用3种方法对其行为学表现进行了初步评价。结果表明在肢体不对称测试中发现皮质梗死与皮质下梗死大鼠的表现一致,而在肢体放置测试与NSS评价中,二者表现出了完全不同的行为学模式;并且还发现不同类型大鼠的这3种行为学表现可能与梗死体积的大小无关,而与脑梗死的类型有关,当然这点还需要进一步研究证实。因此,在今后利用MCAO模型进行各种干预措施的研究时,应该结合实验的需要和行为学评价方法来决定是否有必要对模型的梗死类型进行区分。
1 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.2 Bedirli N,Bagriacik EU,Emmez H,et al.Sevoflurane and isoflurane preconditioning provides neuroprotection by inhibition of apoptosis-related mRNA expression in a rat model of focal cerebral ischemia[J].J Neurosurg Anesthesiol,2012,24(4):336-344.
3 Koizumi J, Yoshid Y, Nakazawa T, et al. Experimental Studies of Ischemic Brain Edema, A New Experimental Model of Cerebral Embolism in Rats in Which Recirculation Can Be Introduced in the Ischemic Area [J].Stroke, 1986,8:1-15.
4 何芳雁,韩春妮,李艳,等.制作线栓法大鼠脑缺血再灌注模型的要点及体会[J].实验动物科学,2013,30(4):46-48.
5 黄春荣.SPF级动物实验室净化空调系统运行管理和保养[J].机电信息,2012,(32):56-57.
6 石将通,赵忠,蒙息标,等.线栓法制备大鼠局灶性脑缺血模型手术操作的研究进展[J].中国比较医学杂志,2014,卷缺失(7):68-71.
7 Hill JJ,Jin KL,Mao XO,et al.Intracerebral chondroitinase ABC and heparan sulfate proteoglycan glypican improve outcome from chronic stroke in rats[J].Proc Natl Acad Sci USA,2012,109(23):9155-9160.
8 李少春,马丽娜,李峰杰,等.不同浓度水合氯醛对大鼠的麻醉作用比较[J].中国药业,2014,23(19):22-23.
9 张乾,毛善平,李涛,等.线栓法制作大鼠脑缺血模型不同类型神经功能缺损特点的研究[J].疑难病杂志,2011,10(4):282-284.
10 Urakawa S,Takamoto K,Hori E,et al.Rearing in enriched environment increases parvalbumin-positive small neurons in the amygdala and decreases anxiety-like behavior of male rats[J].BMC Neurosci,2013,14(5):184-197.
11 Hua Y,Schallert T,Keep RF,et al.Behavioral tests after intracerebral hemorrhage in the rat[J].Stroke,2002,33(10):2478-2484.
12 Zhang LY,Hu XQ,Luo J,et al.Physical exercise improves functional recovery through mitigation of autophagy, attenuation of apoptosis and enhancement of neurogenesis after MCAO in rats[J].BMC Neurosci,2013,14(5):46.
13 Zhang Q,Wu Y,Sha HY,et al.Early exercise affects mitochondrial transcription factors expression after cerebral ischemia in rats[J].Int J Mol Sci,2012,13(2):1670-1679.
14 Chen B,Gao XQ,Yang CX,et al.Neuroprotective effect of grafting GDNF gene-modified neural stem cells on cerebral ischemia in rats[J].Brain Res,2009,1284:1-11.
15 Zarruk JG,Garcia-Yebenes I,Romera VG,et al.Neurological tests for functional outcome assessment in rodent models of ischaemic stroke[J].Rev Neurol,2011,53(10):607-618.
16 Wegener S,Weber R,Ramos-Cabrer P,et al.Subcortical lesions after transient thread occlusion in the rat: T-2-weighted magnetic resonance imaging findings without corresponding sensorimotor deficits[J].J Magnet Res Imag,2005,21(4):340-346.
17 Rosell A,Agin V,Rahman M,et al.Distal occlusion of the middle cerebral artery in mice:are we ready to assess Long-Term functional outcome?[J].Transl Stroke Res,2013,4(3):297-307.
18 管玉青,陆兵勋.改良神经功能检测评价实验性脑梗死病变的范围[J].南方医科大学学报,2009,29(1):114-117.
19 Chauveau F,Cho TH,Riou A,et al.Does acute behavioral testing reflect successful ischemia in rats with transient middle cerebral artery occlusion?[J].International Journal of Stroke,2012,7(6):465-472.
20 Hein M,Zoremba N,Bleilevens C,et al.Levosimendan limits reperfusion injury in a rat middle cerebral artery occlusion (MCAO) model[J].BMC Neurol,2013,13(7):106.
21 张乾,毛善平,李涛,等.构建大脑中动脉阻塞脑缺血模型大鼠的类型分析[J].中国组织工程研究与临床康复,2011,15(24):4391-4394.
22 Wegener S,Weber R,Ramos-Cabrer P,et al.Temporal profile of T-2-weighted MRI distinguishes between pannecrosis and selective neuronal death after transient focal cerebral ischemia in the rat[J].J Cer Blood Flow Metabol,2006,26(1):38-47.
23 张婵娟,温红梅.运动功能与脑缺血后锥体束重塑的关系[J].中国康复理论与实践,2014,(1):49-52.
24 吴相春,王少卿,唐璐,等.MCAO模型大鼠中医证候研究[J].中国中医基础医学杂志,2014,20(6):734-736.
25 Jin K,Xie L,Mao X,et al.Effect of human neural precursor cell transplantation on endogenous neurogenesis after focal cerebral ischemia in the rat[J].Brain Res,2011,16(1374):56-62.
Study of behavioral characteristics of different types in the MCAO method and the relationships with the infarct volume in rats
ZHANGQian,MAOShanping,LITao,ZHOUQin,TANJie.*DepartmentofNeurology,ZhongshanHospitalofHubeiProvince,Wuhan430033,China
Correspondingauthor:TANJie,E-mail:642548152@qq.com
Objective To analyze the behavioral characteristics in the different types of cerebral ischemia in rats after middle cerebral artery occlusion (MCAO) method by inserting a nylon filament and the relationships between behavioral performance and the size of infarct volume.Methods 101 male SD rats were used in this study. The MCA were blocked by a nylon filament and reperfusion after 100 minutes. To determine the site and the volume of infarction, MRI scan were performed in each rat 24 hours after the surgery. The rats were divided to three groups that cortex basal ganglia infarction group (CIG,n=51), sub cortical infarction group (SIG,n=24) and non-infarction group (NIG,n=26) according to the MRI scan results. The behavioral tests, including forelimb use asymmetry, limb placement tests, and neurological severity score (NSS) were used to evaluate the neurologic deficits at the second day after the MCAO surgery.Results In the forelimb use asymmetry test, there was difference between CIG and NIG (q=3.72,P<0.05), and this difference also existence between SIG and NIG (q=3.28,P<0.05), but between CIG and SIG showed no difference (q=0.44,P>0.05). In the limb placement tests and the NSS tests, there was significant difference between CIG and NIG (q=12.02,q=11.98,P<0.01), also between CIG and SIG (q=10.28,q=11.48,P<0.01), at this time there was no significant difference between SIG and NIG (q=1.74,q=0.50,P>0.05). And in the CIG and SIG, there was no significant difference between the volume of infarction and the results of the three behavioral tests (r=-0.087,r=0.243,r=-0.226,r=0.279,r=0.010,r=0.110,P>0.05).Conclusion The MCAO method can appear different infarction types, and the behavioral characteristics are different in these types. This difference occurs may not be associated with the size of the infarct volume.
Middle cerebral artery occlusion;Rats; Types; Behavioral tests; Infarct volume
430033 武汉,湖北省中山医院神经内科(张乾、谭杰); 430056 武汉大学人民医院神经内科(毛善平、李涛、周琴)
谭杰,E-mail:642548152@qq.com
10.3969 / j.issn.1671-6450.2015.06.002
2015-02-24)
