纳米银和银离子对斑马鱼胚胎早期生长发育的影响及作用机制
2015-06-07辛琦章强程金平
辛琦,章强,程金平,
1.华东师范大学河口海岸学国家重点实验室,上海 200062 2.香港城市大学深圳研究院,深圳 518057
纳米银和银离子对斑马鱼胚胎早期生长发育的影响及作用机制
辛琦1,2,章强1,2,程金平1,2,
1.华东师范大学河口海岸学国家重点实验室,上海 200062 2.香港城市大学深圳研究院,深圳 518057
为探究纳米银对水生生物的毒性作用,选取斑马鱼胚胎为受试生物,考察了纳米银对斑马鱼胚胎早期生长发育的影响,同时比较了纳米银与银离子对斑马鱼胚胎的毒性作用和机理。实验将受精后4小时(4 hpf)的斑马鱼胚胎分别暴露于不同浓度的纳米银和银离子溶液中至96 hpf,观察并记录了胚胎的死亡、孵化和畸形等指标。应用吖啶橙(AO)染色实验研究了胚胎暴露之后的细胞凋亡情况,并且应用荧光定量PCR技术分析了相关基因的表达水平。研究结果表明,随着暴露浓度的增加,纳米银和银离子均能导致斑马鱼胚胎的死亡率增加和孵化率降低,并且引起孵化延迟。纳米银和银离子的96 h半数致死浓度(96 h-LC50)分别为11.75 mg·L-1和0.054 mg·L-1。银离子毒性远大于纳米银毒性。暴露的斑马鱼胚胎均表现出体长变短和卵黄囊肿大的畸形。AO染色结果表明,纳米银和银离子处理组胚胎的躯干和卵黄囊部位存在细胞凋亡信号。基因表达分析结果显示,1.93 mg·L-1纳米银显著提高了斑马鱼胚胎caspase9的表达(P<0.05),而0.006 mg·L-1的银离子就能显著上调COX-2a(P<0.01)和COX-17(P<0.05)基因的表达,同时0.036 mg·L-1银离子增加了斑马鱼体内p53基因的表达(P<0.05)。以上研究结果说明,纳米银可能通过caspase通路诱导细胞凋亡进而影响斑马鱼胚胎的生长发育;而银离子不但影响氧化系统基因通路,还能通过p53诱导凋亡进而阻滞斑马鱼胚胎的生长发育。
纳米银;银离子;斑马鱼胚胎;细胞凋亡;生长发育
纳米银(Ag NPs)是一种重要的金属纳米材料,由于抗菌特性而被广泛应用。美国Woodrow Wilson国际学者中心发布的2013年纳米产品消费清单表明目前最常用的纳米材料依次为银、二氧化钛、碳纳米管、二氧化硅和氧化锌等[1]。这些纳米材料被广泛应用在医疗领域,个人护理品,纺织品等产品中[2-3]。纳米材料在带来优越的材料性能的同时,其潜在的负面效应也不容忽视。2009年有研究报道,长期处在有纳米材料的工作环境中的工人患有严重肺部疾病,甚至有两名工人因肺部损伤而死亡,这是首次纳米材料致人死亡的报道[4-5]。由此,纳米材料对环境和生物的潜在健康影响引起了社会关注。纳米材料可以在产品的生产、使用和废弃过程中进入环境。首先在产品的生产场地以及运输过程中可能发生泄漏或者通过工厂废弃物被排放进入环境,同时工人们会通过呼吸和皮肤接触等方式暴露于纳米材料中[6-7]。而作为使用者,普通群众主要是通过使用化妆品、身体与纺织衣物的摩擦接触等暴露或接触到纳米材料。
纳米银进入环境最主要的途径就是通过污水排放和地表径流,由此水环境是纳米银重要的汇[8]。有研究表明在上海市河流沉积物中重金属银的含量在0.14~1.10 mg·kg-1之间,平均值为0.51 mg·kg-1,相较于锌、铜等其他重金属浓度低很多,但是大部分地点属于偏中度污染[9]。纳米银累积在水环境中必将对水生生物和水环境带来一定的影响。许多对水生生物的研究已经表明纳米银具有潜在的生物毒性作用,表现出呼吸毒性[10]和神经毒性[11]。然而目前所有研究均处于探索阶段,有关纳米银的毒性效应并没有统一定论。关于纳米银延迟水生生物胚胎生长发育的报道极为少见。本研究以模式生物胚胎期的斑马鱼为受试生物,通过急性暴露实验探究纳米银对水生生物早期生长发育的影响,并通过基因表达分析初步揭示纳米银阻碍斑马鱼胚胎生长发育的分子机制,同时比较了纳米银与银离子致毒机制的差异。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:超声波清洗仪(SB-520DTDN,宁波新芝公司),透射电子显微镜(transmission electron microscope,TEM)(JEM-2100,日本,JEOL公司),扫描电子显微镜(scanning electron microscope,SEM)(S-4800,日本,HITACHI公司),体视显微镜(SMZ168,中国,Motic公司),解剖镜(V8,德国,Zeiss公司),荧光体视显微镜(M165FC,德国,Leica公司),UV-vis紫外分光光度计 (SMA4000,中国,Merioton公司),荧光定量PCR仪(ABI7500,美国,Applied Biosystems公司),电感耦合等离子体质谱仪(inductively coupled plasma mass spectrometer,ICP-MS)(Neptune,德国,Thermo公司)。
试剂:硝酸银纯度为99%和麻醉剂Tricaine均购自Sigma-Aldrich公司;纳米银粉(型号CST-NP-S10)粒径(10±2) nm,平均粒径为10 nm,纯度为99.5%,包裹 10%~13%脂肪酸盐,购自苏州冷石纳米材料科技有限公司;RNeasy®Mini Kit(Cat#74104,QIAGEN,GmBH,Germany)试剂盒,PrimeScriptTMRT reagent Kitwith gDNA Eraser (Cat#DRR047A,Takara,Dalian)试剂盒,SYBR Premix Ex TaqTM(Cat#DRR420A,Takara,Dalian)试剂盒以及TaKaRa Ex Taq®Hot Start Version (Cat#DRR006A,Takara,Dalian)试剂盒均购自上海皓嘉科技发展有限公司;SanPrep柱式PCR产物纯化试剂盒(NO.SK8141,生工,上海)购自生工生物工程(上海)股份有限公司。
1.2 实验材料
市售的成年斑马鱼饲养于独立的养殖单元(上海海圣),雌雄兼有,水温(28±0.5)℃,每日光照黑暗周期为14 h:10 h,早晚定时投喂薄片斑马鱼饲料和活丰年虾卵2次,并每天清除排泄物。在收集胚胎前一晚,将1条雌鱼和2条雄鱼放入孵化盒中,第2天光照后产卵。于产卵后1 h收集鱼卵并用培养液冲洗3次,在解剖显微镜下挑选正常发育的受精卵放入24孔板进行实验。
1.3 方法
1.3.1 纳米银的表征
将纳米银粉称重后分散在去离子水中,为了便于在透射电镜下观察,首先在超声仪中40 kHz条件下分散20 min后制备成悬浮液,然后将悬浮液滴在铜网上,室温干燥后通过透射电镜观察纳米银在水中分布的形态。同时将纳米银溶液模拟暴露条件放置24 h后再次用透射电镜观察其分散和形态。为进一步观察纳米银颗粒的形貌特征,纳米银粉的形态也在扫描电镜下进行了分析。纳米银粉末用导电胶粘结法装载在样品台上然后通过扫描电镜观察样品粉末形态。根据我们先前的研究,将暴露24 h的纳米银溶液从培养板中收集后加入AmiconUltra-0.5超滤管(平均孔径2 nm)中在14 000转下离心40 min分离纳米银溶液中的银离子(粒径0.28 nm),将滤出液用10%硝酸酸化后用ICP-MS测定纳米银释放的银离子浓度。测定发现实验所用纳米银溶液在此暴露条件下24 h并未检测到银离子的释放,所以本研究所用的纳米银暴露液没有银离子的存在和干扰。
1.3.2 急性毒性实验
受精后4 h的斑马鱼胚胎置于24孔培养板中,每孔20个健康受精卵,每组设置4个平行,共80个受精卵。每孔加入2 mL空白对照液或处理组暴露液,加盖封闭后置于28 ℃恒温光照培养箱中培养至96 hpf。其中纳米银暴露浓度分别为:0.96、1.93、3.85、7.70、11.55、23.10、46.20 mg·L-1;银离子暴露浓度分别为: 0.003、0.006、0.018、0.036、0.072、0.144mg·L-1。每24 h更换暴露液,并记录胚胎的死亡,孵化和畸形情况。死亡的终点为胚胎凝结或心脏停止跳动,对于胚胎期斑马鱼发育时相的评价参照Kimmel等[12]提供的判断标准进行。死亡率=(死亡胚胎数/总胚胎数)100%,孵化率=(孵化胚胎数/总胚胎数)100%。在72 hpf时,用配备了拍照系统的蔡司显微镜给斑马鱼拍照,并用ImageJ软件测量斑马鱼的体长以及卵黄囊面积。
1.3.3 吖啶橙(acridine orange,AO)染色观察胚胎细胞凋亡
收集处理至96 hpf的斑马鱼胚胎,用胚胎培养液冲洗2次后放入含5 μg·mL-1AO染色剂的胚胎培养液中染色20 min,然后再用培养液冲洗3次,每次5 min。用0.016 mol·L-1的Tricaine麻醉剂麻醉胚胎1 min后在荧光显微镜下用515 nm激发光观察凋亡情况并拍照。
1.3.4 基因表达分析
为研究低浓度暴露下纳米银和银离子的致毒机制,基因表达分析实验选取纳米银暴露浓度为0.96、1.93、3.85 mg·L-1的斑马鱼胚胎,银离子暴露浓度为0.006、0.018、0.036 mg·L-1的斑马鱼胚胎进行实验。收集处理至96 hpf的斑马鱼胚胎,用RNeasy®Mini试剂盒提取总RNA,用紫外分光光度仪测RNA浓度,通过紫外吸收值A260/A280判断RNA有无降解。然后用PrimeScriptTMRT reagentswith gDNA Eraser试剂盒将RNA反转录为cDNA,之后用SYBR Premix Ex TaqTM试剂盒按照说明在荧光定量PCR仪中进行实时荧光定量反应。本研究所用引物均由上海生工生物工程有限公司合成,引物序列如表1所示。最终实验数据用2-ΔΔCt方法分析,以β-actin做为内参基因对结果进行标准化。本研究选取的细胞凋亡相关基因包括凋亡诱导因子(AIF)、肿瘤抑制基因p53和半胱氨酸蛋白酶caspase9,氧化相关基因包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、环氧化酶COX-2a和细胞色素c氧化酶COX-17。
1.3.5 统计学分析
实验数据采用平均值±标准偏差(mean±SD)表示,结果均用GraphPad Prism 5软件进行分析及显著性检验,P<0.05表示差异具有显著性统计学意义。

表1 荧光定量PCR引物序列Table 1 Primer sequences used for RT-PCR
2 结果(Results)
2.1 纳米银的表征
图1分别展示了纳米银的透射电镜和扫描电镜照片。从扫描电镜照片中可以看出,实验所用的纳米银粉颗粒呈现球形,除个别较大颗粒外,粒径分布范围较窄,基本无明显团聚体(图1C)。纳米银悬浮液制备1 h的透射电镜照片显示了该纳米银在去离子水中能均匀分散,无团聚现象,且性质稳定呈现球形(图1A)。模拟暴露条件24 h后纳米银在暴露介质中依然分散均匀,无明显团聚现象且粒径没有明显变化,性质稳定(图1B)。经测量统计纳米银粒径范围符合正态分布,主要介于8.27~12.42 nm之间,平均粒径为(9.18±1.99) nm。在实验条件下纳米银暴露液中没有银离子的释放。

图1 纳米银的表征图:(A)纳米银悬浮液制备1 h透射电镜照片;(B)纳米银悬浮液在模拟条件下暴露24 h后透射电镜照片;(C)扫描电镜照片

图2 (A)Ag NPs和(B) Ag+暴露96 h斑马鱼胚胎的死亡率

图3 (A)Ag NPs和(B) Ag+暴露的斑马鱼胚胎的孵化率
2.2 纳米银和银离子对斑马鱼胚胎的急性毒性
斑马鱼胚胎在纳米银和银离子的不同浓度下暴露96 h的死亡率如图2所示。斑马鱼的死亡率与纳米银和银离子的暴露浓度均呈现剂量效应关系,随着暴露浓度的增大,斑马鱼死亡率增高。当纳米银的暴露浓度为46.20 mg·L-1时,斑马鱼胚胎的死亡率高达86%(图2A),而银离子浓度达到0.144 mg·L-1时斑马鱼胚胎死亡率已经达到100%(图2B)。进一步计算得到纳米银和银离子对斑马鱼胚胎96 h的半数致死浓度分别为11.75 mg·L-1和0.054 mg·L-1。结果表明纳米银对斑马鱼胚胎或幼鱼的毒性远远低于银离子。
斑马鱼胚胎于48 hpf开始孵化出膜,空白对照组至72 hpf基本孵化完全。纳米银和银离子处理组的斑马鱼胚胎显示出随暴露浓度的增加孵化率降低的趋势,当纳米银浓度达到11.55 mg·L-1或者银离子浓度达到0.144 mg·L-1时,斑马鱼胚胎的孵化率仅有10%左右(图3)。并且纳米银和银离子暴露组与对照组相比有延迟孵化的现象。0.96和1.93 mg·L-1的纳米银暴露组的斑马鱼胚胎在52~60 hpf时与对照组相比表现出孵化延迟现象(图3A)。同样0.018 和0.036 mg·L-1的银离子暴露组斑马鱼主要在48~56 hpf显示出孵化延迟的现象(图3B)。
2.3 纳米银和银离子对斑马鱼生长发育的影响
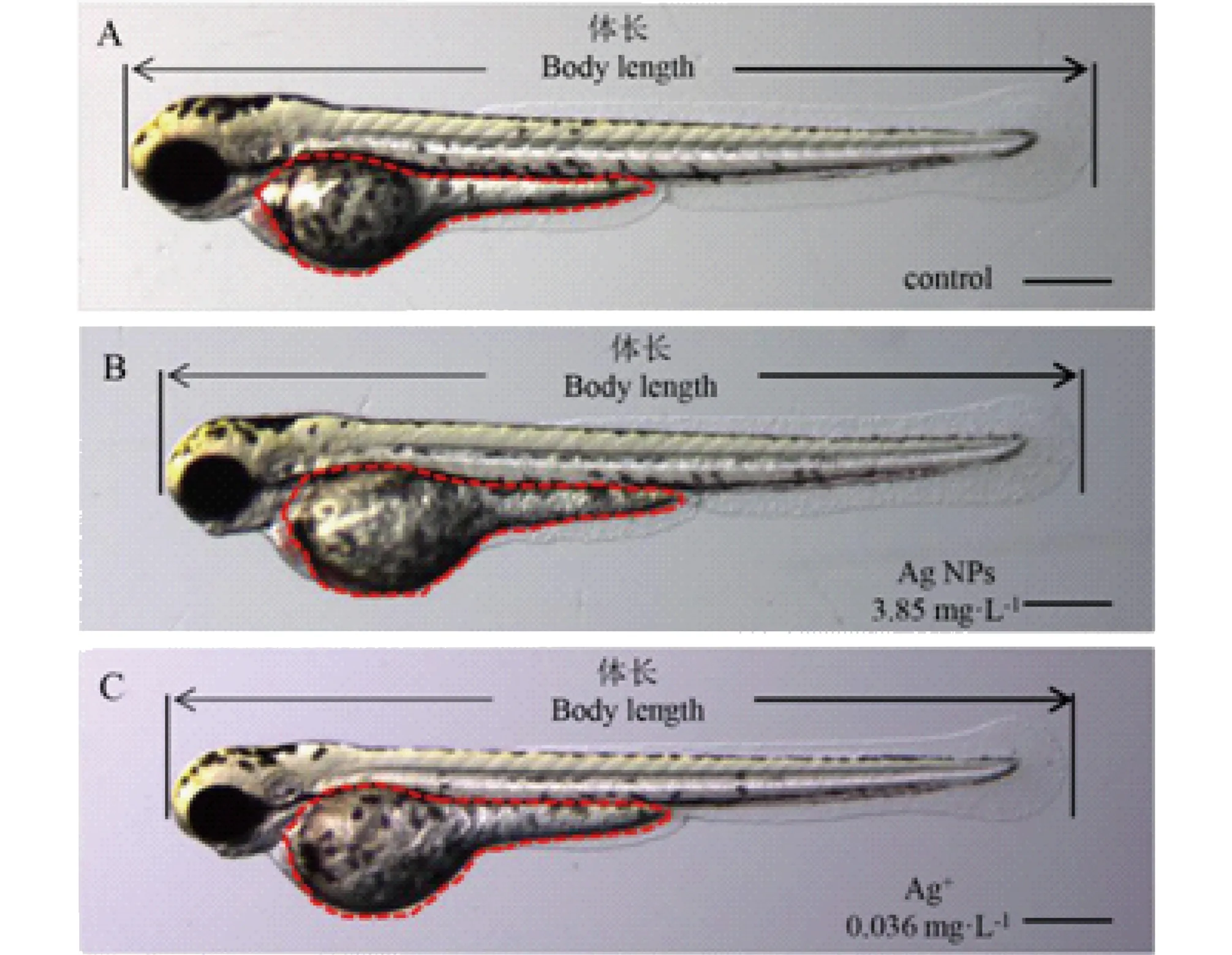
图4 纳米银和银离子暴露72 h影响斑马鱼胚胎发育的典型畸形特征
从斑马鱼胚胎72 hpf的照片可以看出,与对照组(图4A)相比,纳米银和银离子处理组的斑马鱼胚胎呈现出体长变短和卵黄囊肿的发育异常现象(图4B和C)。进一步测量统计了斑马鱼的体长后发现,纳米银和银离子暴露组的斑马鱼胚胎72 hpf的体长随暴露浓度的增加而减小(图5)。尤其是3.85 mg·L-1和7.70 mg·L-1的纳米银暴露组(图5A),以及0.072 mg·L-1的银离子暴露组(图5B)斑马鱼胚 胎的体长明显小于对照组。
卵黄囊是斑马鱼胚胎发育过程中储存营养物质的地方,72 hpf斑马鱼胚胎的卵黄囊面积如图6所示。纳米银处理组的斑马鱼胚胎卵黄囊面积随暴露浓度增加而增大,并且1.93~7.70 mg·L-1暴露组的卵黄囊面积明显大于对照组(图6A)。银离子暴露的斑马鱼胚胎的卵黄囊面积也呈现微弱的增加趋势,但是与对照组相比并没有显著性差异(图6B)。
2.4 纳米银和银离子的致毒机制
2.4.1 氧化损伤相关基因表达情况
斑马鱼体内氧化压力相关基因CAT,SOD,COX-2a and COX-17的表达情况如图7所示。纳米银暴露没有显著改变斑马鱼体内这4种基因的表达情况(图7A)。银离子上调了斑马鱼体内COX-2a基因的表达,尤其是在0.006和0.036 mg·L-1暴露浓度组,上调量显著高于对照组(图7B)。此外,0.006 mg·L-1的银离子处理组还显著增加了斑马鱼体内COX-17基因的表达(图7B)。而斑马鱼体内CAT,SOD基因的表达则没有受到银离子的显著影响(图7B)。
2.4.2 细胞凋亡
对照组和处理组的斑马鱼胚胎发育至96 hpf的AO染色结果如图8所示。空白对照组基本没有凋亡荧光信号(图8A,a,C和c)。纳米银处理组的凋亡荧光信号明显较高(图8B),并且凋亡主要集中在斑马鱼的躯干和尾部(图8b)。同样,银离子暴露组的斑马鱼胚胎凋亡荧光信号也明显高于对照组(图8D),凋亡信号主要集中在卵黄囊区域(图8d)。
纳米银和银离子不同浓度处理组斑马鱼的细胞凋亡相关基因的表达情况如图9所示。基因表达分析结果表明,纳米银处理上调了斑马鱼体内caspase9基因的表达,尤其是1.93 mg·L-1暴露组中caspase9基因的表达明显高于对照组(图9A)。而银离子暴露则上调了斑马鱼体内p53基因的表达,尤其在0.036 mg·L-1组表达量显著高于空白对照组(图9B)。斑马鱼体内AIF基因的表达则在纳米银和银离子处理组中均没有明显变化(图9A和B)。

图5 (A)Ag NPs和(B) Ag+暴露72 h斑马鱼胚胎的体长

图6 (A)Ag NPs和(B) Ag+暴露72 h斑马鱼胚胎的卵黄囊面积

图7 (A)Ag NPs和(B) Ag+暴露96 h斑马鱼胚胎的氧化压力相关基因CAT,SOD,COX-2a和COX-17的表达情况
3 讨论(Discussion)
本研究表明,斑马鱼胚胎暴露于纳米银和银离子后均表现出死亡率增高和孵化率降低,并且有延迟孵化的现象。而研究中所用纳米银溶液在暴露过程中性质稳定并且没有银离子释放,这可能是由于纳米银添加了脂肪酸盐包裹材料,包裹物降低了理化因子对纳米银团聚、沉降的影响,也使银离子难以从纳米银中释放出来。从而说明实验中纳米银产生的毒性并不能归因于银离子。斑马鱼胚胎受精后的3 d时间内胚胎发育形成的过程可分为7个主要时期,而孵化期是其中之一[12]。通常情况,在标准条件下培养的斑马鱼胚胎能够在48~72 hpf孵化出膜。而本研究中纳米银和银离子暴露的斑马鱼出现孵化率降低的现象,并且分别在52~60 hpf和48~56 hpf时与对照组相比表现出孵化延迟。为了进一步研究斑马鱼延迟孵化的影响,我们在形态学统计时又检查了斑马鱼的体长和卵黄囊这两项指标。因为体长和卵黄囊面积通常用来作为评估斑马鱼生长发育的2个重要参数[13]。我们发现纳米银和银离子暴露的斑马鱼与对照组相比体长明显变短,这恰好与延迟孵化的结果相吻合,证明了纳米银和银离子都能影响斑马鱼的生长发育。卵黄囊能够为胚胎的发育提供营养物质,随着胚胎的成长,卵黄逐渐消耗,而卵黄囊的尺寸也应该相应变小[12]。本研究中纳米银和银离子暴露的斑马鱼出现卵黄囊肿大的畸形,测量了卵黄囊面积后发现纳米银处理组的斑马鱼卵黄囊面积明显大于对照组,这进一步印证了纳米银能延迟斑马鱼胚胎的生长发育。与此类似,Wu等[14]的研究发现纳米银引起暴露的青鳉鱼胚胎最大视顶盖宽度减小,因此表明生长发育受阻滞。与纳米银不同的是,虽然碳纳米管也能引起斑马鱼胚胎孵化延迟,但是并没有影响胚胎的发育和存活[15]。

图8 纳米银和银离子对暴露96 h的斑马鱼细胞凋亡的影响

图9 (A)Ag NPs和(B) Ag+暴露96 h斑马鱼胚胎的细胞凋亡相关基因AIF,p53和caspase9的表达情况
氧化损伤是纳米材料致毒的一个重要机制[16]。过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)是生物体内2种重要的抗氧化酶并且能清除体内氧自由基。本研究中纳米银和银离子都没有显著改变斑马鱼体内CAT和SOD这2种基因的表达量。与此类似,Choi等[17]研究发现斑马鱼体内SOD基因没有明显受纳米银或银离子暴露的影响,而斑马鱼肝脏内CAT的表达量却减少。环氧化酶(cyclooxygenase,COX)COX-2a静息时不表达,一般会在激素、致癌物质等因子的诱导下表达,它可以通过抑制凋亡、促进细胞增殖等参与肿瘤的形成过程[18-19]。COX-2a一般认为参与芳香烃受体(Ahr)介导的毒性,二噁英(TCDD)能显著增加暴露的青鳉鱼内COX-2a的表达[20]。本研究中,Ag+同样显著提高了96 hpf斑马鱼体内COX-2a的表达,而纳米银却未影响COX-2a的表达。细胞色素c氧化酶(cytochrome c oxidase)亚型COX-17是线粒体铜伴侣蛋白,其蛋白异常表达量与活性氧自由基形成有关。Craig等[21]的研究表明在铜中暴露48 h的斑马鱼鳃和肝脏内COX-17基因的表达明显上调。同样的,我们的研究表明Ag+处理也能显著增加COX-17的表达。所有结果表明银离子对斑马鱼体内氧化和抗氧化系统的基因通路有显著影响,而本研究中纳米银对此通路没有明显影响。
已有研究报道氧化压力在诱导和调节细胞凋亡中的重要作用[22]。应激导致的细胞凋亡一般认为是造成胚胎发育异常的因素[23]。因此我们用AO染色实验观察了暴露的斑马鱼体内细胞凋亡的情况,结果发现纳米银暴露的斑马鱼躯干和银离子暴露的斑马鱼卵黄囊均有凋亡的荧光信号。我们进一步分析了细胞凋亡相关基因的表达情况。肿瘤抑制基因p53的激活可以导致细胞周期停滞或者细胞凋亡[24],本研究中Ag+显著上调了斑马鱼体内p53基因的表达,暗示斑马鱼体内细胞凋亡通路的激活。而纳米银处理却没有显著改变p53的表达,这与Choi等[17]的研究结果一致,他们发现纳米银暴露的斑马鱼体内p53蛋白增加但是p53基因表达水平没有变化,因此认为这可能是由于p53的表达主要在转录后水平。凋亡可通过caspase通路产生,caspase通路又包括内源性和外源性两种路径,caspase9主要参与内源性通路[25]。本研究中纳米银显著增加了斑马鱼体内caspase9的表达,表明是通过激活内源性通路引起细胞凋亡的发生。凋亡诱导因子(AIF)是一种线粒体蛋白,它可转移到细胞质及细胞核内引起细胞凋亡,主要介导与caspase无关的通路[26-27]。本研究中纳米银和银离子的暴露中AIF的表达均没有明显变化,表明凋亡主要是通过caspase通路而不是AIF通路发生的。
综上所述,本研究基于急性暴露实验研究了纳米银和银离子对斑马鱼胚胎发育的影响,结果表明银离子毒性远远大于纳米银的毒性,二者均能影响斑马鱼胚胎的孵化,并使斑马鱼的生长发育受阻滞。AO染色发现纳米银和银离子暴露的斑马鱼均有细胞凋亡的现象,进一步研究表明纳米银的致毒机制是可通过caspase的内源性通路造成细胞凋亡,而银离子不但能影响斑马鱼的氧化抗氧化相关的基因通路,而且能激活p53基因进而造成细胞凋亡。
[1] Project on Emerging Nanotechnologies (PEN).Analysis of the inventory of nanotechnology-based consumer products [DB/OL].[2014-10-15].http://www.nanotechproject.org/cpi/about/analysis/
[2] Project on Emerging Nanotechnologies (PEN).Categories of nanotechnology-based consumer products [DB/OL].[2014-10-15].http://www.nanotechproject.org/cpi/browse/categories/
[3] Navarro E,Piccapietra F,Wagner B,et al.Toxicity of silver nanoparticles to Chlamydomonas reinhardtii[J].Environmental Science & Technology,2008,42(23): 8959-8964
[4] Song Y,Li X,Du X.Exposure to nanoparticles is related to pleural effusion,pulmonary fibrosis and granuloma [J].European Respiratory Journal,2009,34(3): 559-567
[5] 王震宇,赵建,李娜,等.人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J].环境科学,2010,31(6): 1409-1418
Wang Z Y,Zhao J,Li N,et al.Review of ecotoxicity and mechanism of engineered nanoparticles to aquatic organisms [J].Environmental Science,2010,31(6): 1409-1418(in Chinese)
[6] Nowack B,Krug H F,Height M.120 years of nanosilver history: Implications for policy makers [J].Environmental Science & Technology,2011,45:1177-1183
[7] Gottschalk F,Nowack B.The release of engineered nanomaterials to the environment [J].Journal of Environmental Monitoring,2011,13(5): 1145-1155
[8] Bradford A,Handy R D,Readman J W,et al.Impact of silver nanoparticle contamination on the genetic diversity of natural bacterial assemblages in estuarine sediments [J].Environmental Science & Technology,2009,43(12): 4530-4536
[9] 贾英,方明,吴友军,等.上海河流沉积物重金属的污染特征与潜在生态风险[J].中国环境科学,2013,33(1): 147-153
Jia Y,Fang M,Wu Y J,et al.Pollution characteristics and potential ecological risk of heavy metals in river sediments of Shanghai [J].China Environmental Science,2013,33(1): 147-153 (in Chinese)
[10] Bilberg K,Hovgaard M B,Besenbacher F,et al.In vivo toxicity of silver nanoparticles and silver ions in zebrafish (Danio rerio) [J].Journal of Toxicology,2011,2012,doi 10.1155/2012/293784
[11] Powers C M,Slotkin T A,Seidler F J,et al.Silver nanoparticles alter zebrafish development and larval behavior: Distinct roles for particle size,coating and composition [J].Neurotoxicology and Teratology,2011,33(6): 708-714
[12] Kimmel C B,Ballard W W,Kimmel S R,et al.Stages of embryonic development of the zebrafish [J].Developmental Dynamics,1995,203(3): 253-310
[13] Westerfield M.The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio) [M].Eugene: Institute of Neuroscience,University of Oregon,1995
[14] Wu Y,Zhou Q,Li H,et al.Effects of silver nanoparticles on the development and histopathology biomarkers of Japanese medaka (Oryzias latipes) using the partial-life test [J].Aquatic Toxicology,2010,100(2): 160-167
[15] Cheng J,Flahaut E,Cheng S H.Effect of carbon nanotubes on developing zebrafish (Danio rerio) embryos [J].Environmental Toxicology and Chemistry,2007,26(4): 708-716
[16] Nel A,Xia T,Mädler L,et al.Toxic potential of materials at the nanolevel [J].Science,2006,311(5761): 622-627
[17] Choi J E,Kim S,Ahn J H,et al.Induction of oxidative stress and apoptosis by silver nanoparticles in the liver of adult zebrafish [J].Aquatic Toxicology,2010,100(2): 151-159
[18] Subbaramaiah K,Zakim D,Weksler B B,et al.Inhibition of cyclooxygenase: A novel approach to cancer prevention [J].Experimental Biology and Medicine,1997,216(2): 201-210
[19] 韩勇军,吴新荣.COX 基因在斑马鱼胚胎早期发育过程中的表达 [J].广东药学院学报,2010,26(6): 628-631
Han Y J,Wu X R.Expression of COX during early embryonic development in zebrafish [J].Journal of Guangdong Pharmaceutical College,2010,26(6): 628-631 (in Chinese)
[20] Dong W,Matsumura F,Kullman S W.TCDD induced pericardial edema and relative COX-2 expression in medaka (Oryzias latipes) embryos [J].Toxicological Sciences,2010,118(1): 213-223
[21] Craig P M,Wood C M,McClelland G B.Oxidative stress response and gene expression with acute copper exposure in zebrafish (Danio rerio) [J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2007,293(5): R1882-R1892
[22] Simonian N A,Coyle J T.Oxidative stress in neurodegenerative diseases [J].Annual Review of Pharmacology and Toxicology,1996,36(1): 83-106
[23] Yang S,Liu S,Ren Z,et al.Induction of oxidative stress and related transcriptional effects of perfluorononanoic acid using an in vivo assessment [J].Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2014,160: 60-65
[24] Langheinrich U,Hennen E,Stott G,et al.Zebrafish as a model organism for the identification and characterization of drugs and genes affecting p53 signaling [J].Current Biology,2002,12(23): 2023-2028
[25] Jin Z,El-Deiry W S.Review overview of cell death signaling pathways [J].Cancer Biology & Therapy,2005,4(2): 139-163
[26] Nagata S,Nagase H,Kawane K,et al.Degradation of chromosomal DNA during apoptosis[J].Cell Death & Differentiation,2003,10(1): 108-116
[27] Luzio A,Monteiro S M,Fontaínhas-Fernandes A A,et al.Copper induced upregulation of apoptosis related genes in zebrafish (Danio rerio) gill [J].Aquatic Toxicology,2013,128: 183-189
◆
Effects of Silver Nanoparticles and Silver Ions on the Early Development of Zebrafish Embryos and Toxicity Mechanisms
Xin Qi1,2,Zhang Qiang1,2,Cheng Jinping1,2,*
1.State Key Laboratory of Estuarine and Coastal Research,East China Normal University,Shanghai 200062,China 2.City University of Hong Kong Shenzhen Research Institute,Shenzhen 518057,China
16 November 2014 accepted 12 January 2015
To investigate the effects of silver nanoparticles (Ag NPs) on the early development of aquatic organisms and compare with that of silver ions,zebrafish embryos were selected and exposed to different concentrations of Ag NPs or Ag+from 4 hours post fertilization (hpf) to 96 hpf.The survival,hatching and malformations of treated zebrafish embryos were examined.The cell apoptosis in treated zebrafish embryos were observed by the acridine orange (AO) staining.Related genes and their expression profiles were analyzed with fluorescence quantitative PCR.Results showed that exposure to Ag NPs or Ag+induced increased mortality,decreased hatching rate and delayed hatching in zebrafish embryos in a concentration-dependent manner.The 96 h half lethal concentration (96 h-LC50)of Ag NPs and Ag+on zebrafish embryos were 11.75 mg·L-1and 0.054 mg·L-1respectively.The toxicity of Ag+was greater than that of Ag NPs.Exposed zebrafish embryos exhibited shorter body length and enlarged yolk sac.The AO staining results showed cell apoptosis in the trunk and yolk sac of zebrafish were observed respectively after treatment with Ag NPs and Ag+.The gene expression analysis showed that Ag NPs significantly up-regulated the expression of caspase9 in zebrafish embryos at the concentration of 1.93 mg·L-1(P<0.05).Exposure to 0.006 mg·L-1of Ag+significantly up-regulated the expressions of COX-2a (P<0.01) and COX-17 (P<0.05) in zebrafish embryos.The expression level of p53 gene were also significantly increased in zebrafish embryos after exposed to 0.036 mg·L-1Ag+(P<0.05).This study suggested Ag NPs could induce apoptosis in zebrafish embryos via the caspase-dependent pathway and thus affected the development of exposed zebrafish embryos.However,exposure to Ag+not only affected the oxidation-related gene pathway,but also induced apoptosis via p53 pathway and inhibited the development of exposed zebrafish embryos.
silver nanoparticles; silver ions; zebrafish embryos; apoptosis; development
国家自然科学基金(41101489);广东省自然科学基金(s2012010010847);教育部新世纪优秀人才计划项目(NECT-12-0181);河口海岸学国家重点实验室自主课题(2012RCDW-01)
辛琦(1989-),女,硕士研究生,研究方向为环境毒理学,E-mail: xinxin8922@126.com;
*通讯作者(Corresponding author),E-mail: jinpingcheng@gmail.com
10.7524/AJE.1673-5897.20141116002
2014-11-16 录用日期:2015-01-12
1673-5897(2015)4-055-10
X171.5
A
程金平(1978—),女,博士,研究员,主要研究方向为生态毒理学。
辛琦,章强,程金平.纳米银和银离子对斑马鱼胚胎早期生长发育的影响及作用机制[J].生态毒理学报,2015,10(4): 55-64
Xin Q,Zhang Q,Cheng J P.Effects of silver nanoparticles and silver ions on the early development of zebrafish embryos and toxicity mechanisms [J].Asian Journal of Ecotoxicology,2015,10(4): 55-64 (in Chinese)
