海冰微生物Pseudoalteromonas sp.ANT319耐盐性初步研究
2015-06-07王全富蔺一飞史永磊吴莹莹侯艳华
王全富, 蔺一飞, 苗 苗, 史永磊, 韩 涵, 吴莹莹, 杨 洋, 侯艳华
哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209
海冰微生物Pseudoalteromonassp.ANT319耐盐性初步研究
王全富§, 蔺一飞§, 苗 苗, 史永磊, 韩 涵, 吴莹莹, 杨 洋, 侯艳华*
哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209
南极海冰微生物在适应极端环境的长期进化过程中,获得了特殊的生理生化特性和基因表达调控机制。为了更多的了解南极微生物的逆境适应机制,以隶属南极海冰微生物典型菌属Pseudoalteromonas的ANT319为研究对象,探讨了该菌株在3%~12%的盐度梯度下的抗盐生长情况、蛋白质含量变化、细胞膜透性、丙二醛含量变化和不同盐度对菌株细胞内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)3种抗氧化酶活性的影响。结果表明,此菌株的最适生长盐度为9%,随着盐度的升高,细胞内蛋白质含量升高,膜透性逐渐增加,SOD和POD的酶活性呈现先升高后降低的变化趋势,在9%盐度下达到最高,CAT活性和MDA则基本上保持不变。可见,随着盐度的增加,细胞膜逐渐受到破坏,同时生物体对盐迫作出应激反应,产生较多蛋白来清除不良因素下产生的有害活性氧,包括生物体内抗氧化酶在内的蛋白含量及其活性的增加,研究结果初步揭示了海冰细菌的耐盐机制。
南极;Pseudoalteromonassp.ANT319;耐盐性;海冰
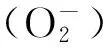
为了及时清理体内的氧自由基,细胞会启动抗氧化酶系统以清除或降低活性氧来维持细胞内正常的新陈代谢。生物体内重要的抗氧化酶有3种:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD),它们在最适生长状态下含量极少,逆境时会明显增加以清除体内的自由基,这些指标的测定对耐盐性鉴定有着重要的作用。丁燏等[4]通过对南极冰藻(Chlamydomonassp.ICE)的适冷性研究证明,膜透性、MDA和POD对南极微藻的逆境生存研究有很好的指示作用。据报道,研究人员相继从南极微生物Aliivibriosalmonicida、Pseudoalteromonashaloplanktis和Bacillussp.中分离到低温抗氧化酶SOD和CAT,这些研究进一步证实南极微生物的适应机制与其抗氧化性密切相关[5,6]。南极微生物是一个潜在的、重要的抗逆基因资源库,对其抗逆机理相关报道较少,本文从总蛋白质、膜透性、丙二醛含量及抗氧化酶等方面对南极海冰细菌Pseudoalteromonassp.(P.sp.)ANT319的高盐适应性进行了初步探讨,以期为南极微生物逆境生长的生理生化适应机制研究提供理论依据。
1 材料与方法
1.1 材料
实验用菌株P.sp.ANT319为2001年10月第18次南极科学考察采集的南极海冰(68°30′E,65°00′S)中分离纯化所得。
2216E培养基:蛋白胨5 g,酵母粉1 g,过滤海水定容至1.0 L,pH 7.5;改良发酵培养基:NaCl浓度分别为3%、6%、9%和12%的2216E培养基。2216E培养基盐度按3.3%(w/V)NaCl计算。
1.2 菌株生长情况测定
本实验对菌株生长情况的研究分为A、B两组。其中,A组是直接把菌株培养在不同盐度的发酵培养基中,160 r/min,12oC连续振荡培养4 d;B组则是先让菌株在2216E培养基中培养2 d(12℃,160 r/min),然后加入适量的NaCl使其最终盐浓度等于A组中对应的培养基的盐浓度,再继续培养2 d,测定OD600。每组设3%、6%、9%和12% 4个盐度梯度。
1.3 酶液提取
将培养4 d后的菌液离心并称量湿重。取菌体沉淀于预冷的研钵中,加入适量的二氧化硅粉末,用少量预冷的50 mmol/L的磷酸缓冲液(pH 7.8)在冰浴中研磨10 min后放入-20℃反复冻融和超声破碎处理,离心取上清液测其体积。上清液为多种酶的混合物,4℃保存,用于SOD、CAT和POD的酶活测定。
1.4 蛋白质含量测定
蛋白质含量的测定采用考马斯亮蓝法[7,8]。
1.5 细胞膜透性测定
细胞膜透性采用黄学林等[9]的电导率法测定。
1.6 MDA含量测定
MDA含量的测定采用改进后的硫代巴比妥酸法[10]。以硫代巴比妥酸溶液(浓度为0.5%)作为空白对照,紫外分光光度计测定发酵产物在450 nm、532 nm和600 nm处的吸光值。按155 mmol/cm消光系数计算MDA的含量。
1.7 SOD、POD和CAT活性测定
SOD的活性测定参照氮蓝四唑(NBT)光化还原法[11],SOD活性单位(U/g)以抑制NBT光化还原的50%为一个酶活性单位(U);POD活性参照愈创木酚显色法[10],活性单位(U/g·min)以每分钟内A470变化0.01为1个酶活单位(U);CAT活性的测定参照紫外吸收法[11]。以1 min内A240降低0.1的酶量作为CAT的1个酶活单位(U),具体反应体系见表1~3。

表1 SOD活性测定实验Table 1 Enzyme assay of SOD.
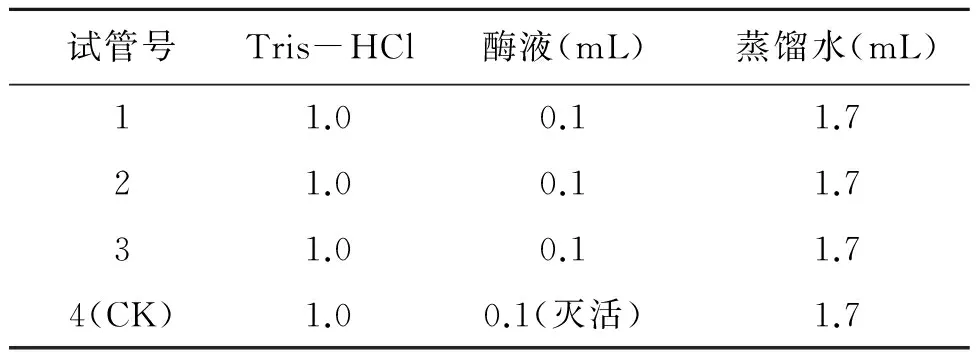
表2 紫外吸收法测定CAT活性Table 2 Enzyme assay of CAT by UV.
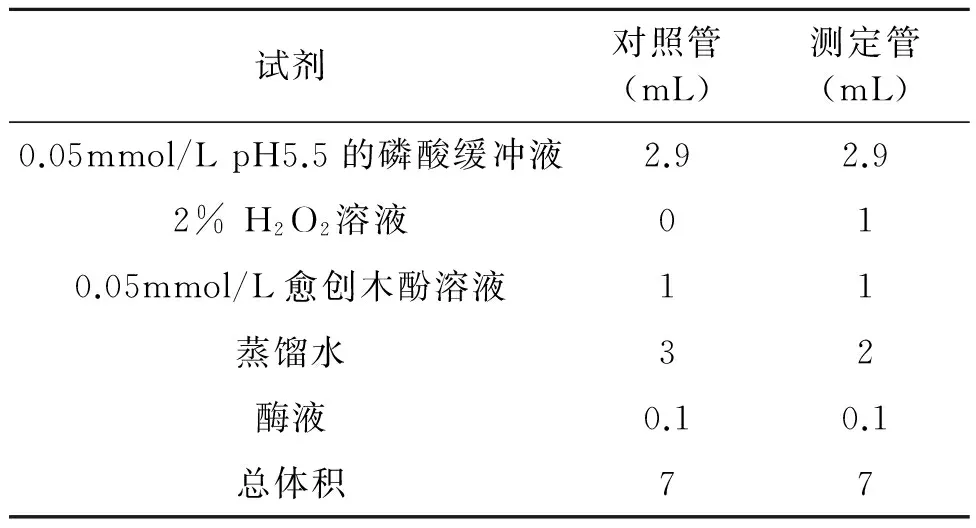
表3 愈创木酚法测定POD活性Table 3 Enzyme assay of POD by o-methoxyphenol.
2 结果与分析
2.1 不同盐度下菌株的生长情况
耐盐菌P.sp.ANT319在不同盐度下的生长情况如图1所示。可以看出:提前加盐时,6%和9%盐度下,P.sp.ANT319的生长趋势良好,OD值一直保持在较高水平,变化幅度不大;3%和12%培养时,菌体的生长符合迟缓期、对数期、稳定期和衰亡期的变化规律。说明该菌株的最适生长盐度在6%~9%之间,高于或低于此条件培养,菌体都要经历调整阶段才能开始生长,且最高生长量都不及其余两个盐度高。B组未加盐时,菌体生长一致,都经历了调整期与对数期,说明3%盐度不是其最适培养条件。增加盐浓度时,菌株受逆境因素的影响,死亡率大于生长率,菌体数量都会不同程度的减少,且6%和9%时菌体恢复生长的速率较高,进一步证明耐盐菌P.sp.ANT319在6%~9%这个盐度区间内能较好的生长,其自然生境的盐度也应该在此范围内。菌株的生长情况与海冰细菌能耐受盐度急剧变化的观点相符[12],当外界盐度骤然变化时,海冰细菌会通过自身耐盐机制的调节来适应环境使之恢复生长。
2.2 不同盐度下培养菌体的湿重
菌体的湿重能从侧面反映出菌体的生长情况。提前加盐和后加盐两组处理后,耐盐菌P.sp.ANT319在不同盐度下的湿重见图2A。从图中可以看出,无论是提前加盐还是培养2 d后加盐,6%和9%盐度时,菌体的生长情况都较其他两组较好,即P.sp.ANT319的最适生长盐度为6%~9%,与2.1所得出的结论一致。从整体来看,提前加盐较后加盐的生长情况好,证明盐度的突然增加会影响菌体的生长。
2.3 不同盐度下培养菌株的蛋白质含量
从图2B可以看出:提前加盐比后加盐蛋白质含量高。提前加盐和后加盐组,耐盐菌P.sp.ANT319在9%最适生长盐度下的蛋白含量都处于最高值,可能是因为此盐度下菌体发生应激反应,合成分泌较多与耐盐相关的活性酶,为海冰细菌适应不良生境提供保障。高于或低于此盐度,蛋白质含量都会有所下降,且以12%时下降最多,说明该菌株不能在此盐度下产生较多调节蛋白,从而使菌体生长受到活性氧的损害。
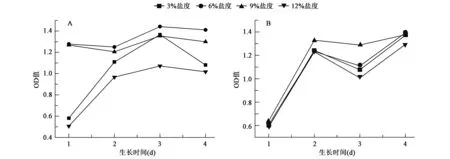
图1 菌株P.sp.ANT319在不同盐度下的生长情况Fig.1 Growth of P.sp.ANT319 in different salinity.
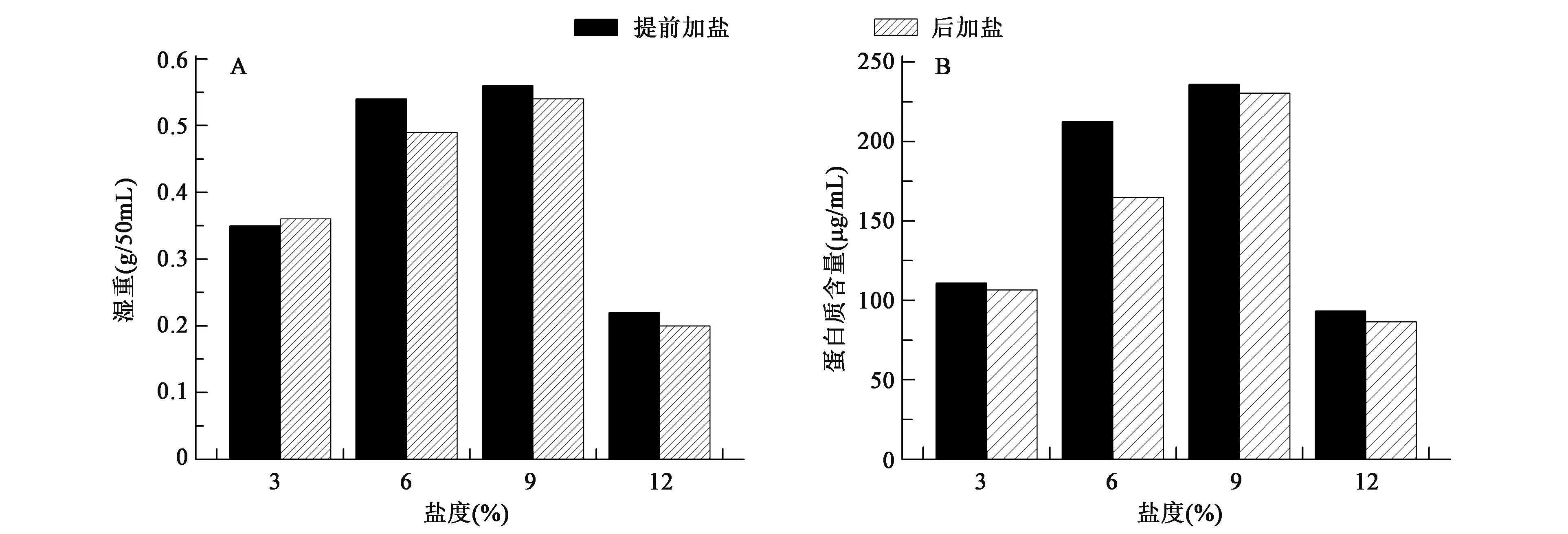
图2 菌株P.sp.ANT319在不同盐度下的湿重(A)和蛋白质含量(B)Fig.2 Wet weight (A) and proteins contents (B) of P.sp.ANT319 in different salinity.
2.4 不同盐度下培养菌株细胞膜透性
不同盐度下培养的菌株的膜透性变化见图3A。可以看出,无论是保持盐浓度恒定还是使盐浓度骤然增加,随着盐浓度的升高,细胞膜的透性都会逐渐增加。但是后加盐的渗透率变化较提前加盐明显,这是因为盐浓度骤然增加时,菌株正处于对数生长期,新合成的细胞膜对外界环境的突然变化反应较为强烈。细胞膜透性是细胞膜受伤害程度的最直接反映。
2.5 不同盐度下培养菌株的MDA含量变化
不同盐度培养下细胞内的MDA含量见图3B。可以看出,提前加盐时,MDA含量变化很小;后加盐时,在3%~9%盐度下,MDA的浓度基本上保持稳定,只有在12%较高盐度下,MDA的浓度才有所升高,但值也不是很大。说明此菌株的脂质过氧化程度较低,细胞受损程度较小,可能是由于菌体内的抗氧化酶发挥协同作用,及时地将活性氧基团转化成了对机体无害的物质。
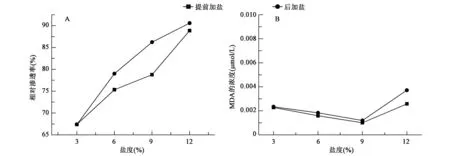
图3 不同盐度下细胞膜透性(A)和细胞内的MDA含量(B)Fig.3 Cell cytoplasm membrane permeation (A) and MDA contents (B) of P.sp.ANT319 in different salinity.
2.6 不同盐度下培养菌株的SOD活性
从图4A可以看出,两种不同培养条件下,在3%~9%范围内,随着盐度的增加,SOD的活性也在增加,9%浓度时,酶活达到最高值。当盐度为12%时,SOD酶活性下降,仅为最高值的60%左右,说明盐浓度在3%~9%之间逐渐增加时,SOD的活性也相应增加以维持体内的氧自由基在较低水平,到9%时,酶活性达到最高。当盐度高达12%时,由于细胞膜通透性变大,氧自由基大量增加,SOD酶活性较低,不能及时将其转化为无害物质,导致机体受损,生长缓慢。
2.7 不同盐度下培养菌株的CAT活性
CAT与SOD协同作用,能将SOD产生的H2O2转化为H2O和O2,降低活性氧基团对细胞膜的伤害,是细胞内重要的抗氧化物酶之一。从图4B中可以看出,两种不同条件培养时,不同盐度下,P.sp.ANT319的CAT活性基本上保持不变,全部处于0.51~0.57 U/g·min之间。对细胞内增加的活性氧基团的清除没有明显作用。
2.8 不同盐度下培养菌株的POD活性
提前加盐和后加盐的POD活性变化见图4C,可以看出,两种不同培养条件下,P.sp.ANT319的POD活性都是先升高后降低的变化趋势,活性规律与SOD一致。说明在受到外界环境突然刺激时,POD能及时的将SOD产生的H2O2转化为对机体无害的物质。

图4 不同盐度下细胞内的SOD(A)、CAT(B)和POD(C)活性Fig.4 Enzymatic activity of SOD(A),CAT(B) and POD(C) of P.sp.ANT319 in different salinity.
3 讨论
本研究结果表明,海冰细菌P.sp.ANT319的最适生长盐度为9%,随着盐度的升高,细胞所处环境的渗透压逐渐增大,细胞膜成分和结构完整性被破坏,膜透性逐渐增加,同时生物体对逆境作出应答,产生较多的调节蛋白以应对环境胁迫,继而表现为细胞内蛋白质含量升高。其他研究也指出不良因素会引起蛋白质含量升高。如Tenivi等[13]发现4种暴露于增强的UV-B辐射中的植物,其可溶性蛋白增加,可能是由于该菌合成了大量抗紫外辐射伤害的功能性蛋白。王征宏等[14]发现,在NaCl胁迫下,玉米芽和玉米根内可溶性蛋白含量分别增高了29.17%和23.33%,这是由于可溶性蛋白具有较强的亲水胶体性质,影响着细胞的保水力,细胞通过可溶性蛋白的积累来降低渗透势,从而减少由NaCl胁迫所造成的环境渗透压改变对生物体的伤害。
在一些植物的耐盐性研究中发现,随着盐度的升高,MDA的含量也随之升高,主要是因为抗氧化酶不能及时地清除氧自由基[15],如赵风斌等[16]研究发现,在0.05 mol/L盐胁迫使3种沉水植物的MDA含量提高, 而本文中MDA含量基本保持不变,说明生物体通过调节抗氧化酶系统,对盐度胁迫作出了很好的应答,保护了脂类物质免受氧化损伤。本研究中随着盐度的增加,SOD和POD的酶活性呈现先升高后降低的变化趋势,CAT活性基本上保持不变。可见在P.sp.ANT319应对氧化胁迫中,POD协同SOD发挥着主要的抵御作用,保护机体的生长。POD是否在抗氧化酶系统中占据主要的作用与物种有很大的关联。刘长仲等[17]的研究表明受到环境胁迫的细胞会通过调节自身抗氧化酶系统来增加SOD的活性从而抵御伤害;Zhang和Nan[18]的研究结果证明SOD能提高耐盐性。刘爱荣等[19]在金盏菊的研究中发现,盐浓度增加时CAT的活性减弱。这两种情况都可能是机体内其他的抗氧化酶发挥主导作用协同SOD变化所致。史雨刚[20]在对不同品种高粱幼苗盐胁迫研究中指出,高粱幼苗 21A×R208、6A×R308 随盐胁迫的加剧POD活性先升高而后下降;而7A×R301、晋杂12则随盐胁迫的加剧POD活性逐渐下降;晋杂17 POD活性则表现为先下降而后升高。这也揭示了CAT和POD共同协同SOD发挥抗氧化作用的过程中,对于不同的生物体,发挥主导作用的酶不同。这些指标变化规律初步揭示了菌株P.sp.ANT319的耐盐机制,为生物适应机制的研究提供了理论依据。
[2] Van B F,Dat J F.Reactive oxygen species in plant cell death[J].Plant Physiol.,2006,141:384-390.
[3] 杨海锋,刘 丹,杨俊花,等.高效液相色谱法测定饲料中的丙二醛含量[J].上海农业学报,2013,29 (4):14-17.
[4] 丁 燏, 缪锦来,王全富,等.温度对南极衣藻ICE-L(Chlamydomonassp.ICE-L)谷胱甘肽含量及其相关酶活性的影响[J].海洋与湖沼,2006,37(2):154-160.
[5] Tosi S,Kostadinova N,Krumova E,etal..Antioxidant enzyme activity of filamentous fungi isolated from livingston island,maritime Antarctica[J].Polar Biol.,2010,33(9):1227-1237.
[6] Merlino A,Russo K I,Castellano I,etal..Structure and flexibility in cold-adapted iron superoxide dismutases: the case of the enzyme isolated fromPseudoalteromonashaloplanktis[J].J.Struct.Biol.,2010,172(3):343-352.
[7] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal.Biochem.,1976,72:248-254.
[8] 王永刚,马建忠,马雪青,等.响应面法优化考马斯亮蓝 G-250 溶液的配制[J].药物生物技术,2013,20(1):057-062.
[9] 黄学林,陈润政.种子生理实验手册[M].北京:中国农业出版社,1990.
[10] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[11] 严万里,陈晓明,郭丽燕,等.超氧化物歧化酶活性测定的影响因素研究[J].生物学通报,2011,46(3):50-53.
[12] Mock T,Thomas D N.Recent advances in sea-ice microbiology[J].Environ.Microbiol.,2005,7(5):605-619.
[13] Tevini M,Iwanzik W,Thoma U.Some effect of enhanced UV-B irradiation on the growth and composition of plants[J].Planta,1981,153:388-394.
[14] 王征宏,戴凌峰,赵 威,等.盐胁迫对玉米根芽主要渗透调节物质的影响[J].河南农业科学,2013,426: 21-23.
[15] 向春阳,杜 锦.不同高油玉米品种耐盐性的比较研究[J].作物杂志, 2011,4:47-49.
[16] 赵风斌,王丽卿,季高华,等.盐胁迫对3种沉水植物生物学指标及叶片中丙二醛含量的影响[J].环境污染与防治,2012,34(10):40-44.
[17] 刘长仲,兰金娜.苜蓿斑蚜对三个苜蓿品种幼苗氧化酶的影响[J].草地学报,2009,17(1):32-35.
[18] Zhang Y P,Nan Z B.Growth and anti-oxidative systems changes inElymusdahuricusis affected byNeotyphodiumendophyteunder contrasting water availability[J].J.Agron.Crop Sci.,2007,193:377-386.
[19] 刘爱荣,张远兵,方圆圆,等.盐胁迫对金盏菊生长、抗氧化能力和盐胁迫蛋白的影响[J].草业学报,2011,20(6):52-59.
[20] 史雨刚,吴治国,马金虎.不同浓度NaCl胁迫对高粱幼苗SOD、POD酶活性的影响[J].山西农业科学,2007,35 (12):71-73.
Preliminary Study on Salt Tolerance of Sea-ice MicroorganismPseudoa-lteromonassp.ANT319
WANG Quan-fu§,LIN Yi-fei§,MIAO Miao,SHI Yong-lei,HAN Han,WU Ying-ying,YANG Yang,HOU Yan-hua*
SchoolofMarineScienceandTechnology,HarbinInstituteofTechnologyatWeihai,ShandongWeihai264209,China
Over long periods of evolution,Antarctic sea-ice microorganisms obtained special physiological and biochemical characterristics and gene expression regulation mechanisms to adapt extreme environment.To learn more about the adaption mechanism of the Antarctic microorganisms,the strain’s growth,total protein content,permeability of cell membrane,malondialdehyde and antioxidant enzymes system activity including SOD,POD and CAT had been studied under different salinity conditions of 3%~9% based on thePseudoalteromonassp.ANT319,which belongs to the typical genus in Antarctic bacteria.The results showed that the optimum salinity forP.sp.ANT319 was 9%.With salinity increasing,the total protein content and membrane permeability increased while SOD and POD enzymatic activities presented a trend of increasing firstly with the highest at 9% and then decreasing later,meanwhile CAT activity and MDA kept steady.Therefore,as the salinity increased,total proteins content increased as result of cell membranes damaged gradually,meanwhile,the strain produced more proteins to remove harmful reactive oxygen species caused by salt stress and the activities of antioxidant enzymes were also enhanced.These results revealed the salinity tolerance mechanism of sea-ice bacteria preliminarily.
Antarctic;Pseudoalteromonassp.ANT319; salt tolerance; sea-ice
2015-03-20; 接受日期:2015-04-13
国家自然科学基金项目(31100037);山东省自然科学基金(ZR2011CM003)资助。
王全富与蔺一飞为本文共同第一作者。王全富,副教授,博士,研究方向为海洋环境微生物学。E-mail:wangquanfu2000@126.com;蔺一飞,硕士研究生,研究方向海洋环境微生物学。E-mail: 657904059@qq.com。*通信作者:侯艳华,副教授,博士,研究方向为极端环境微生物。E-mail:marry7718@163.com
10.3969/j.issn.2095-2341.2015.03.15
