尿液有形成分全自动分析仪(UF-1000i)性能评价
2015-06-05陈丽娟罗俐莺魏权詹燕婷
陈丽娟,罗俐莺,魏权,詹燕婷
(龙岩人民医院,福建 龙岩364000)
UF-1000i应用半导体激光流式细胞/核酸荧光染料技术,对各种有形成分的细胞膜、细胞核、细胞质进行特异性的核酸荧光染色;且具有独立的双检测通道(沉渣通道和细菌通道),能快速提供 WBC、RBC、EC、CAST 和 BACT 等参数定量报告[1]。但按照CNAS:2014医学实验室认可准则,要求临床实验室在仪器投入使用前,需对分析系统进行性能验证,要达制造厂商规定的性能要求方可使用[2],以达到实验室标准化管理的要求,这样才能保证实验室检测结果的质量。因此,笔者依据美国临床实验室标准化协会(CLSI)颁布的H56-A文件[3]及UF-1000i全自动尿液有形成分析仪病例研究手册[4]和UF-1000i说明书对本院新购置待投入使用的 UF-1000i主要定量参数(RBC、WBC、EC、CAST和BACT)的批内精密度、批间精密度、准确度、携带污染率、线性范围、检测模式比对分析和生物区间参考范围进行验证实验[5-7]。现报告如下。
1 材料与方法
1.1 仪器和试剂 Sysmex UF-1000i尿液有形成分全自动分析仪及原厂配套试剂和尿液有形成分质控物。
1.2 样本来源 采用2013年9月到10月在本院住院、门诊患者和健康体检人员新鲜尿液标本,2h内完成测定[8]。
1.3 评价方法 将UF-1000i尿分析仪按使用要求调整至最佳检测状态,再进行如下各性能参数的验证实验。
1.3.1 批内精密度 选用高、中、低三个浓度水平的新鲜尿液分别于当日用UF-1000i重复测定11次,弃用第1次检测数据,计算后10次测定结果的变异系数CV值。
1.3.2 批间精密度 用高、低两个水平浓度的质控(按说明书要求混匀),连续测定20d,计算其变异系数CV值。
1.3.3 准确度 用高、低两个水平浓度的质控(按说明书要求混匀),用UF-1000i连续测定5次,计算平均值,看是否在质控范围内,质控批号:YS3017。
1.3.4 残留率 取高浓度新鲜尿液样本(约含RBC:5000 个/μl,BACT:10000 个/μl),混合均匀后连续测定三次,测定值分别为H1、H2、H3;再取低浓度尿样(约含 RBC:20 个/μl,BACT:150 个/μl),连续测定3次,测定值分别为L1、L2、L3。按以下公式计算携带污染率:(CV%)=[(L1-L3)/(H3-L3)]×100%。
1.3.5 线性范围 取富含红细胞、白细胞、细菌和上皮细胞的尿样 (RBC约10000个/μl、WBC约6000个/μl、BACT 约 10000 个/μl、EC 约 220 个/μl),以鞘液做稀释液, 进行 1:2,1:4,1:16, 1:64,1:256(EC 稀释度为 1:2,1:4,1:8,1:16,1:32;) 稀释,各稀释点均各测3次,取其均值为实测值;以稀释计算值作为理论值。各稀释尿样的实测值与理论值进行线性回归和相关分析 ,计算公式。要求a值在1±0.05 范围内,相关系数 r≥0.975。
1.3.6 检测模式比对 准备10份新鲜尿液样本,浓度覆盖生物参考区间,整个实验在样本老化之前完成。在手动模式和自动模式下检测这10份样本,每个样本在各个模式下检测3次,取其均值,计算手动模式和自动模式之间的结果偏差百分比。
1.3.7 生物参考区间验证 随机选择40例健康人群的样本(男女各20例),检测结果至少90%在拟定的参考区间内,说明实验室使用的参考区间有效。
1.4 统计软件 用EXECEL 2010进行线性回归和相关分析。
2 结果
UF-1000i各项参数 (RBC、WBC、EC、CAST 和BACT)检测及统计分析结果如下:(1)批内精密度见表 1;(2)批间精密度见表 2;(3)准确度见表 3;(4)携带污染率见表4;(5)线性分析见表5;(6)检测模式比对分析见表6;(7)生物区间参考范围验证结果见表7。

表1 批内精密度 [个/μl(CV%)]

表2 批间精密度单位:[个/μl(CV%)]
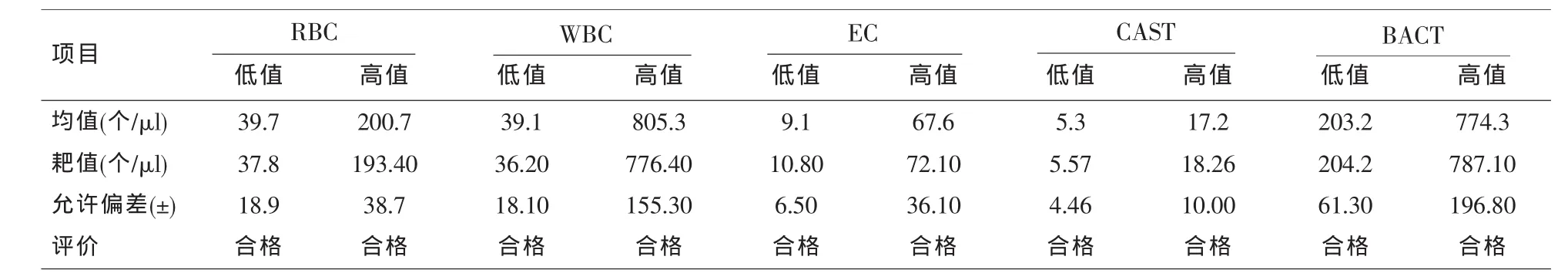
表3 准确度(n=5)
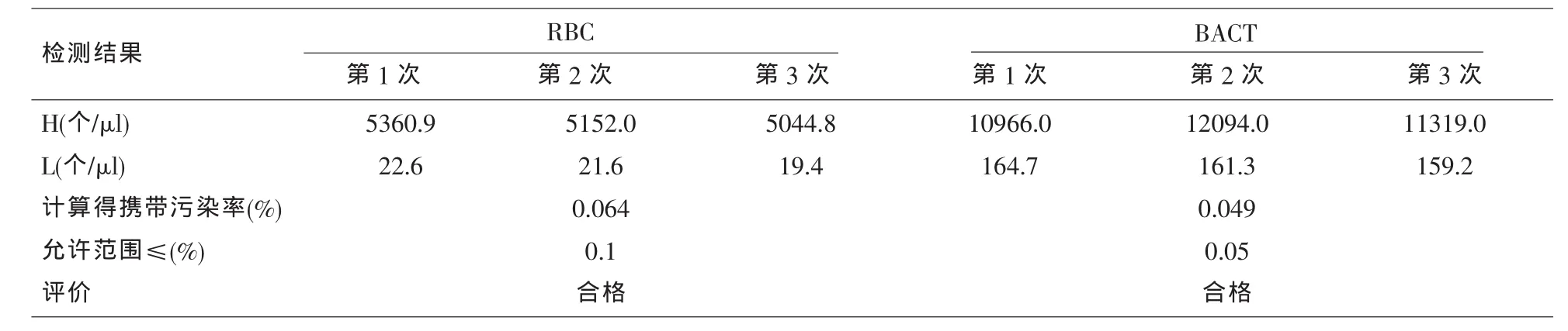
表4 携带污染率

表5 线性分析

表6 检测模式比对分析单位:(个/μl)
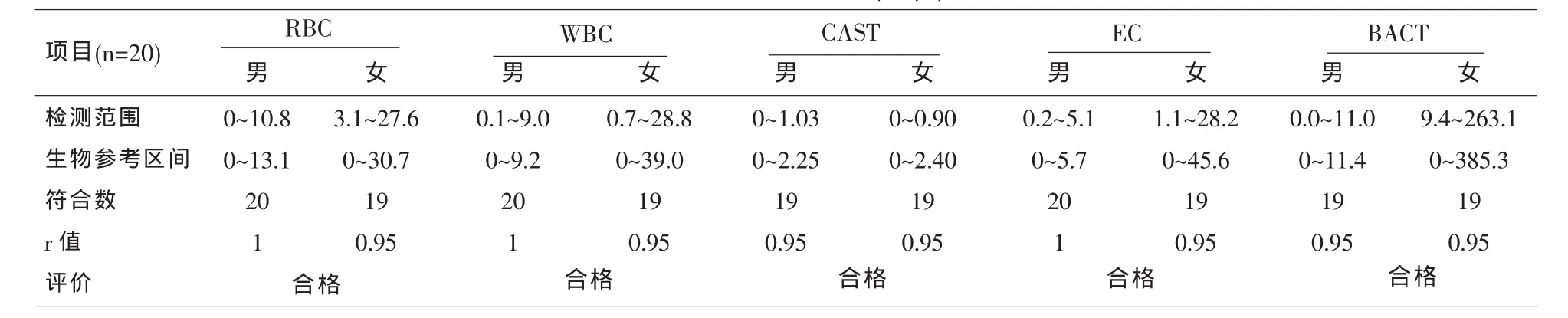
表7 生物参考区间(个/μl)
3 讨论
由以上验证结果可知,我院购进的UF-1000i 5项主要定量参数 (RBC、WBC、EC、CAST和BACT)指标的批内、批间精密度、线性、检测模式比对、残留率、准确度、检测模式比对分析的性能指标均符合厂商标示的性能参数及质控品的要求[9]。本科室还同时对Sysmex公司提供的生物参考区间进行验证, 结果 RBC 、WBC、EC、 CAST、BACT 均在要求范围内。在线性范围验证上,由于红细胞上限值的样本难于获得,我们通过在尿液样本中加入适量的EDTA-K2抗凝血作为红细胞高值样本[10,11]。在CAST方面,我院实在难以获得厂家高限值的样本,所以该项目的线性未加以验证,而是用高值的质控样做准确度等参数的验证。
虽然UF-1000i具有规范化、方便快捷、检测率高的优点,但由于其基本原理仍是根据有形成分的大小及核酸量的多寡进行非形态分析,尿沉渣成分复杂,有时受干扰物质影响,且仪器的灵敏度高易受干扰,易致假阳性率高,所以其结果只能供筛选之用[12,13],不能完全取代传统的化学检查和尿有形成份显微镜检查,比如:UF-1000i管型的假阳性率高,且不能将病理管型进一步分类,而尿管型的数量和类型对急性肾炎和某些肾外疾病[14]有重要的诊断价值[15,16]。因此,UF-1000i提供的阴性结果可以免检,但为阳性时,必须以镜检复检为准,以免引起临床不必要的误诊。
综上所述,我院新购进的UF-1000i尿液有形成分全自动分析仪其精密度良好,准确度高,线性等各项性能指标均符合要求,可应用于临床尿液分析的筛查实验。
[1]丛玉隆,马骏龙.尿液有形成分镜检与自动化检测方法学利弊和互补分析[J].中华检验医学杂志,2009,32(6):609-611.
[2]中国合格评定国家认可委员会.医学实验室质量和能力认可准则在体液学检验领域的指南[S].CNAS-CL41,CNAS,2013.
[3]Clinical Laboratory Standards Institute.Body fluid analysis for cellular composition;appmved guideline[S].H56-A,CLSI,2006.
[4]油野友二.UF-1000i clinical case study[M].Japan;SYSMEX COPR0RATION,2007:18-21.
[5]何巍巍,梁晓君,潘斌,等.Sysmex UF-1000i全自动尿沉渣分析仪的性能评价分析[J].实验与检验医学,2013,31(4):405-407.
[6]潘芸,王瑶.Sysmex UF-1000i在尿液检测中的性能评价 [J].现代检验医学杂志,2011,26(6):76-78.
[7]赵燕霞.Sysmex UF-1000i全自动尿有形成分分析仪性能评价[J].实用医技杂志,2014,21(3):290-291.
[8]丛玉隆,马俊龙,张时民.尿液细胞成分定量分析方法学研究[J].中华检验医学杂志,2006,29(3):211-214.
[9]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].第3版.南京:东南大学出版社,2006:293-294.
[10]黄震,迟秀文,束振华.UF-1000i临床检测性能评价及复检条件探讨[J].现代检验医学杂志,2011,26(1):76-78.
[11]李滔,汪永红.UF-1000i全自动尿有形成分分析仪的方法学性能评价[J].长江大学学报,2013,10(18):41-44.
[12]苏海鹏,李岩,王琳.尿液自动化检测与尿沉渣镜检法在检测管型方面的利弊和互补分析 [J].国际检验医学杂志.2012,11(22):2786-2787.
[13]顾可梁.重视尿液有形成分检查[J].国际检验医学杂志,2008,29(1):1-3,7.
[14]郑洪,梁雪冰,叶联珍.UF-1000i尿有形成分分析仪检测尿管型的评价[J].实用医学杂志,2010,26(20):3814-3815.
[15]叶小英,陆敏,段厚全,等.Sysmex UF-1000i尿沉渣分析仪检测管型的影响因素[J].实验与检验医学,2013,31(2):187-188.
[16]熊立凡,刘成玉.临床检验基础[M].第4版.北京:人民卫生出版社,2009:179-199.
