大孔树脂分离纯化洛神花花色苷的研究
2015-06-05范碧琴杜静君
范碧琴,杜静君,赵 桃
(上海工程技术大学化学化工学院,上海 201620)
大孔树脂分离纯化洛神花花色苷的研究
范碧琴,杜静君,赵 桃*
(上海工程技术大学化学化工学院,上海 201620)
比较了NAK-9,X-5,AB-8,DM130,DA201,Sp850,XAD-7型大孔树脂对洛神花花色苷的吸附纯化效果,结果表明Sp850型大孔树脂对洛神花花色苷具有较好的吸附和解吸能力,在25℃条件下的吸附特征符合Langmuir等温吸附模型(R2=0.9961)。动态吸附和解吸研究表明,Sp850树脂吸附纯化洛神花花色苷的最佳参数为:上柱液溶液pH为2.0,上样流速2BV/h,此条件下每克Sp850树脂可处理14.3mg花色苷;洗脱剂为60%乙醇,解吸流速为2BV/h。可见光谱和HPLC分析可知纯化前后花色苷性质未发生变化,纯化后的洛神花花色苷纯度增加7.4倍,由5.8%变为36.8%,回收率达到64.9%。
花色苷,大孔树脂,洛神花,纯化
花色苷是一类广泛存在于植物的花、果实、茎、叶和根器官细胞液中的天然水溶性色素,使植物呈现由红、紫红到兰等不同颜色。近年来研究发现,花色苷类色素不仅在不同溶剂条件下可呈现红、绿、棕黄、蓝紫等不同颜色,能满足不同的着色需求[1],而且安全无毒,并具有较强的抗氧化[2-5],抗炎症[6],抗癌[7-9]能力和显著的心血管保护能力[10-11]。因此,花色苷在食品、化妆品、医药领域有着巨大应用潜力,是替代合成色素的理想材料。
洛神花(HibiscussabdariffaL.)是锦葵科木槿属一年生植物,主要分布于我国台湾、福建、广东、广西、云南等省区以及东半球热带地区。洛神花花萼中色素含量高,总花色苷含量为干花萼的2.5%(w/w)[12],且色素溶出快,是难得的天然红色素资源,研究开发价值极大。
近几年,天然植物活性成分的提取分离广泛采用了大孔树脂[13]。大孔树脂的吸附作用主要是通过表面吸附、表面电性、氢键及分子筛作用等,具有应用范围广、理化性质稳定分离性能优良、使用方便、溶剂用量少等优点[14]。本研究主要对大孔树脂分离纯化洛神花花色苷的条件进行优化,确定最佳吸附树脂类型和影响因素,旨在寻找具有一定选择性、吸附容量大、易于解吸的树脂及最佳纯化工艺条件,为洛神花天然色素的开发和利用提供科学依据。
1 材料与方法
1.1 材料与仪器
洛神花 购自杭州艺福茶叶有限公司;实验所用所有试剂 均为分析纯,购自国药集团化学试剂有限公司;NAK-9,X-5,AB-8,DM130,DA201,Sp850型大孔树脂 购自北京慧德易科技有限公司;XAD-7型大孔树脂 购自美国罗门哈斯公司。树脂的基本特征如表1所示。
AB104-N型分析天平 梅特勒-托利多上海有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英峪予华仪器厂;pHS-2 pH计 上海分析仪器厂;UV-1800型紫外可见分光光度计 上海精密仪器仪表有限公司;RE52-99旋转蒸发仪 巩义市予华仪器有限责任公司;BT1-100恒流泵 上海琪特分析仪器有限公司;DHG-9023A电热恒温鼓风干燥机 上海贺德实验设备有限公司;81-2电热恒温真空干燥机 上海医疗器械七厂;SXL-70冷冻水浴恒温振荡仪 金坛市佳美仪器有限公司。
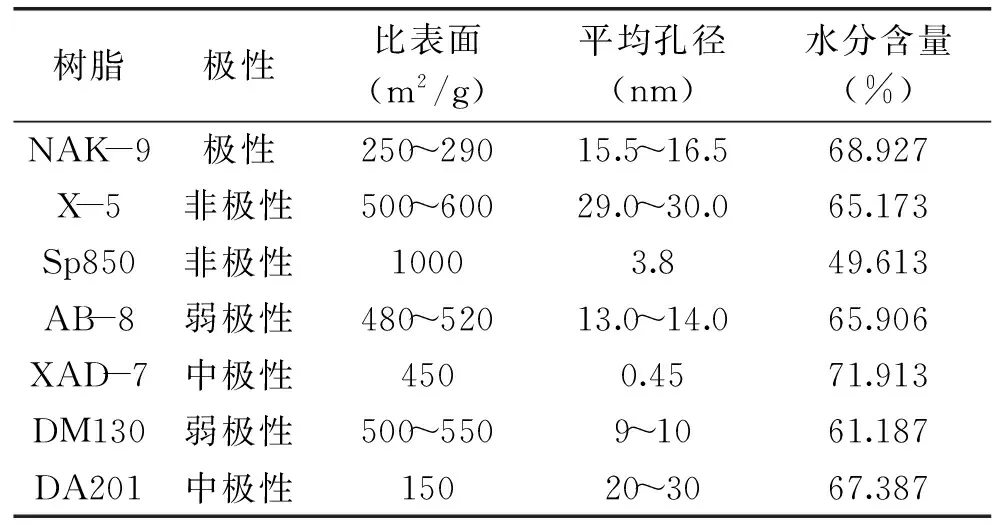
表1 实验所用大孔树脂的基本性质Table1 Physical properties of the macroporous resins used
1.2 实验方法
1.2.1 色素的提取 洛神花花萼磨碎过50目筛,以蒸馏水为溶剂,在料液比1∶6,50℃条件下水浴提取1h,在前期实验基础上,选择将提取液过滤后置于4℃冰箱中避光保存。
1.2.2 色素浓度的测定 色素浓度的测定采用pH示差法[15],含量由等量矢车菊素-3-葡萄糖苷(Cyd-3-G)表示,计算公式如下:
式(1)
式中:C为花色苷浓度(mg/L);A为pH 1.0时花色苷在520nm与700nm的吸光值之差减去pH4.5时花色苷在520nm与700nm的吸光值之差;MW为Cyd-3-G的分子量449.2g/mol;DF为稀释倍数;103为将单位由g转化为mg的倍数;ε为摩尔消光系数26900L/(mol·cm);1为比色皿宽度(cm)。
1.2.3 树脂的预处理与再生 7种大孔树脂,使用前先分别用四倍体积的无水乙醇浸泡24h,充分溶胀,去除悬浮颗粒。湿法装柱,用无水乙醇淋洗直至洗出液无白色浑浊现象,再用蒸馏水洗至无乙醇为止,然后过滤收集树脂。
大孔树脂的再生方法:把用过的大孔树脂湿法装柱,以两倍体积的5% NaOH浸泡10~24h,然后以蒸馏水洗至pH呈中性;再以两倍体积的5% HCl浸泡4~6h,以蒸馏水洗至pH呈中性;再以两倍体积的95%乙醇浸泡24h,最后用蒸馏水洗至流出液无乙醇为止。
1.2.4 树脂水分含量的测定 称取2g预处理后的树脂,放入烘箱70℃下烘24~48h,至重量不再变化,称重并计算树脂的水分含量。本研究中所涉及的树脂重量均记为换算后的干重质量。各树脂的含水量见表1。
1.2.5 静态吸附和解吸实验 洛神花色素提取物的静态吸附实验方法为:将0.1g(干重)预处理后的树脂置于50mL具塞磨口锥形瓶中,加入20mL花色苷提取液,恒温振荡器上于25℃、100r/min振荡24h,充分吸附后,过滤,用pH示差法测定滤液的花色苷含量。
静态解吸方法为:将滤出的树脂用蒸馏水冲洗后,加入20mL乙醇溶液(80%)置恒温振荡器上于25℃、120r/min振荡解吸24h,过滤,用pH示差法测定滤液的花色苷含量。
1.2.6 动态吸附和解吸实验 树脂的动态吸附和解吸实验使用玻璃交换柱进行。将1.5g(干重)Sp850树脂湿法装柱,树脂的柱体积(BV)为6mL。分别以1、2、3BV/h的流速上样,上样液浓度为22.0mg/L。每隔1BV测定流出液中花色苷的浓度,绘制泄露曲线。至流出液中花色苷的浓度增加为22.0mg/L,此时树脂已达到吸附饱和。
上样结束后用蒸馏水冲洗,以便洗下树脂中水溶性的杂质、糖、蛋白质。待水洗流出液为无色后,用80%的乙醇溶液冲洗树脂吸附柱,洗脱液分别以1、2、3BV/h的速度洗脱,收集洗脱液,每5mL测定一次流出液的花色苷含量,并绘制洗脱曲线。
1.2.7 树脂吸附、解吸能力,吸附率和解吸率的计算 树脂的吸附、解吸能力,吸附率和解吸率分别按照下列公式计算[16]。
吸附能力的测定:
式(2)
式(3)
式中:qe为吸附平衡时的吸附能力(mg/g树脂);E为吸附率,即吸附平衡时吸收的花色苷与原液中花色苷含量的比值(%);C0和Ce为吸附前和吸附平衡后溶液中花色苷的浓度(mg/L);Vi为色素样品的初体积(L);W为树脂的干重(g)。
解吸能力的测定:
式(4)
式中,D为解吸率(%);Cd为吸解吸液中花色苷含量(mg/L);Vd为解吸液的体积(L);C0,Ce和Vi与式(2)(3)中相同。
1.2.8 吸附等温线的测定 取不同初始浓度(7.7,15.4,30.9,61.9,123.8,247.5,495.0mg/L)的洛神花花色苷提取液各20mL,加入0.1g树脂,在恒温振荡器上于25℃、100r/min振荡24h,充分吸附后,测定树脂吸附平衡后溶液中花色苷的浓度(mg/L),计算吸附能力qe(mg/g树脂),绘制吸附等温线。
1.2.9 回收率的测定 在实验确定的最佳纯化条件下(上样pH2.0,上样流速2BV/h,洗脱液40%乙醇,洗脱流速2BV/h),测定Sp850树脂纯化玫瑰茄花色苷的样品的回收率,并按式(5)计算:
式(5)
式中,Y为回收率(%);C0为原液浓度(mg/L);Cd为洗脱液浓度(mg/L);Ca为流出液(即流出的上样液)中花色苷浓度(mg/L);Vd为洗脱液体积(L);Vp为上样液体积(L)。
1.2.10 富集效果测定 在最佳纯化条件下,分析了Sp850树脂对洛神花花色苷的纯化效果。分别取10mL纯化和未纯化的洛神花提取液,测定其花色苷含量,然后在100℃条件下烘干提取液,测定其干物质(粉末)重量,并计算花色苷所占干重。
1.2.11HPLC检测 分析所用色谱柱为WatersSunfireC18(2.1×150mm,5μm);流动相:A为0.1% 三氟乙酸,B为乙腈。线性梯度洗脱条件为[17]:0~5min,10%B;5~20min,10%~15%B;20~25min,15%B;25~30min,15%~18%B。流速:0.5mL/min,进样量20μL,检测波长520nm。
1.3 数据分析
所有实验均设置3次重复,文中数据取重复实验平均值。统计学分析采用SPSS11.5forWindows软件进行。
2 结果与分析
2.1 大孔树脂的筛选
从表2可以看出,7种大孔树脂吸附率大小为Sp850>DM130>AB-8>X-5>XAD-7>DA201>NKA-9。从树脂极性来看,非极性和弱极性的树脂,如Sp850、DM130、AB-8、X-5对花色苷类色素的吸附能力较强。从树脂的比表面积来看,比表面积增加,吸附量提高。Sp850的吸附能力大于树脂AB-8、DM130、X-5;XAD-7的吸附能力也大于DA201。这是由于大孔树脂的吸附原理主要为物理吸附,产生的吸附只是分子间的引力,因此表面积增加分子间作用力加强,对吸附有利。供试7种大孔树脂的解吸能力为:Sp850>DM130>AB-8>X-5>XAD-7>DA201>NKA-9,与其吸附能力一致。

表2 不同树脂的吸附和解吸性能Table 2 Results of adsorption capacities,adsorptionand desorption ratios of different resins
由于花色苷类物质在溶液中的结构受pH影响显著,选择了吸附和解吸效果最好的Sp850,DM130,AB-8三种树脂,考察不同pH下它们对洛神花色素的吸附效果,以便进一步筛选合适的树脂,实验结果如图1所示。由图可知,Sp850、DM130、AB-8在各自最佳pH下的吸附能力为Sp850>AB-8>DM130。Sp850在pH为2.0时吸附效果最佳。在不同pH的水溶液中,花色苷存在不同分子结构的平衡。在pH为1.0时主要以花鎓阳离子结构存在,在pH为2.0左右在溶液中保持分子形式,随着pH的进一步增加,花色苷分子逐步发生去质子化,并最终开环形成醌式脱水碱和查尔酮混合物[18]。因此,洛神花花色苷在pH2.0~3.0时的吸附量最大,说明实验所用三种树脂对花色苷类物质的吸附主要依靠氢键。由于Sp850树脂对洛神花花色苷具有最佳静态吸附和解吸能力,故用于进行随后的深入研究。

图1 样品pH对树脂吸附能力的影响Fig.1 Effect of pH value of sample solution on the adsorption capacities of resins
2.2 树脂的吸附饱和曲线
通过测定溶液中残留的花色苷浓度研究Sp850 树脂对洛神花花色苷的静态吸附动力曲线。由图2可知,在最初的1.5h,Sp850对洛神花花色苷的吸附速率迅速上升,随后逐渐下降,并在5h左右到平衡,因此Sp850的静态吸附饱和时间为5h。
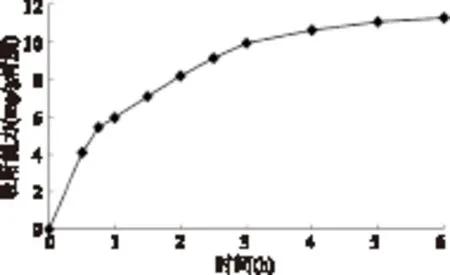
图2 Sp850吸附洛神花花色苷的动力曲线Fig.2 Adsorption kinetics curve for roselle anthocyanins on Sp850
2.3 吸附等温线
在25℃条件下Sp850对洛神花花色苷的吸附等温线如图3所示。洛神花花色苷的溶液的初始浓度分别为7.7,15.4,30.9,61.9,123.8,247.5,495.0mg/L。如图3所示,Sp850对洛神花花色苷的吸附量随初始溶液浓度上升,至247.5mg/L达到饱和。
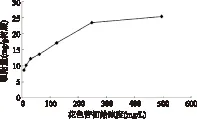
图3 25℃条件下Sp850吸附洛神花花色苷的动力曲线Fig.3 Adsorption isotherm for roselle anthocyanins on Sp850 at 25℃
采用Langmuir和 Freundlich模型研究花色苷与树脂之间的相互作用。其中,Langmuir模型适用于研究单层吸附,假定吸附能量均一地分配,吸附剂和吸附质之间没有相互作用,而Freundlich模型假定在不同的吸附位置和能量下存在非均一的吸附,被广泛用于不同的吸附体系,可研究单层以及多层吸附行为。
实验数据用Langmuir方程式(6)进行拟合:
式(6)
其中K为吸附平衡常数;q0为经验常数;qe,Ce同式(2)。
根据Ce和Ce/qe绘制线性曲线,分别从截距和斜率得到K和q0值。
实验数据同时采用Freundlich方程(7)进行拟合:
式(7)
其中:K为Freundlich常数,可用于判定吸附能力;n为经验常数,与吸附力的数量级相关[19],Ce同式(2)。
式(7)可转化为线性公式(8):
lnqe=lnK+nlnCe
式(8)
根据lnCe和lnqe绘制线性回归曲线,分别从截距和斜率得到K和n值。
如表3所示,Langmuir和Freundlich模型对实验数据进行拟合的相关系数R2均达0.9以上,其中Langmuir的相关系数R2最高,达到0.9961,说明此模型更适用于研究Sp850树脂对洛神花花色苷的吸附。一般认为当Freundlich方程中n的值在0.1~0.5范围内时吸附较易进行,当n在0.5~1范围内时吸附较难发生,该值超过1时,很难进行吸附[20]。从表3中可知,Sp850树脂吸附洛神花花色苷时的n值为0.3477,即25℃时该吸附反应较易进行。

表3 25℃条件下Sp850吸附洛神花花色苷的吸附等温参数Table 3 Langmuir and Freundlich adsorption isothermparameters for roselle anthocyanins on Sp850 at 25℃
2.4 洗脱液对静态解吸的影响
树脂的静态解吸实验按照1.2.5中的方法进行。树脂吸附平衡以后,用蒸馏水洗净树脂表面的杂质,过滤。将滤出的树脂加入20mL不同浓度(0%,20%,40%,60%,80%,95%)的酸化乙醇(含0.1% HCl)溶液进行解吸,所得结果如图4所示,使用40%~60%左右的酸化乙醇即可达到>90%以上的洗脱率,但根据随后对色素动态洗脱曲线的测定,发现在相同的流速条件下,使用60%的乙醇洗脱速度更快,且洗脱成分相对集中,有利于纯化和富集(结果另文发表),故确定最佳静态解吸乙醇浓度为60%。
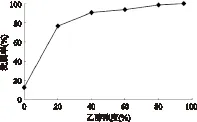
图4 乙醇浓度对静态洗脱率的影响Fig.4 Effect of ethanol concentration on the static desorption ratio
2.5 树脂动态泄露曲线的测定
大孔树脂的吸附达到泄漏点时,树脂的吸附力减弱甚至消失,溶质会从树脂中泄漏出来。因此在树脂纯化过程中,通过泄漏曲线来确定所需树脂的量,上样体积和合适的上样流速是非常必要的[16]。一般认为当流出液的浓度达到上样液浓度的10%时,树脂的吸附量已经达到饱和,此时的上样体积为最佳上样体积。
在不同的上样流速条件下检测了Sp850大孔树脂的动态泄露曲线,每6mL检测一次流出液中的花色苷含量。由图5可知,在相同浓度下,以1BV/h为流速时,最佳上样体积为168mL;当流速为2BV/h时,最佳上样体积为162mL;当流速为3BV/h时,最佳上样体积为120mL。由此可得,在1、2BV/h流速下,最佳上样体积相近,而2BV/h流速时更节约时间,效率更高,故最佳上样流速为2BV/h。在此流速条件下,6mL(1.5g干重)湿树脂可以处理162mL浓度为132.6mg/L洛神花花色苷提取液,即每克树脂可纯化14.3mg花色苷,可见采用Sp850树脂纯化洛神花花色苷是一个高效经济的方法。
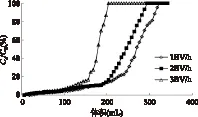
图5 不同流速条件下Sp850树脂 吸附洛神花花色苷的动态泄露曲线Fig.5 Dynamic breakthrough curves of roselle anthocyanins packed with Sp850 resin at different flow rates
2.6 动态洗脱曲线
为了选择最佳的洗脱流速,对1、2、3BV/h三种流速进行了测定。由图6可知,流速较慢时(1BV/h)出峰时间较慢,导致整个制备周期的延长。在流速提高至2BV/h和3BV/h时,出峰时间相似,但2BV/h的解吸曲线对称性更好,洗脱成分相对集中,有利于纯化和富集。因此在2BV/h流速条件下,从Sp850树脂解吸洛神花花色苷效果更好。
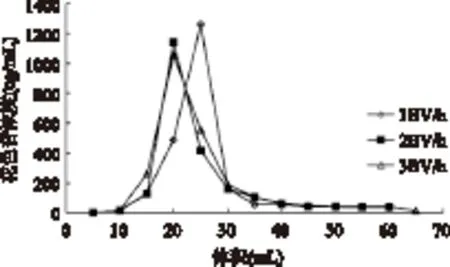
图6 不同流速条件下Sp850树脂 吸附洛神花花色苷的动态洗脱曲线Fig.6 Dynamic desorption curves of roselle anthocyanins packed with Sp850 resin at different flow rates
2.7 纯化效果分析
2.7.1 回收率 根据实验结果计算可知,在最佳纯化条件下,利用Sp850树脂纯化玫瑰茄花色苷的回收率Y达64.9%。
2.7.2 富集效果 由表4可知,纯化前花色苷的百分含量为5.8%,纯化后的花色苷的百分含量为36.8%,花色苷富集倍数为7.4。

表4 纯化前后洛神花提取物中花色苷的百分含量Table 4 Anthocyanins in raw roselle extract before and after purification with Sp850
2.7.3 纯化工艺对洛神花花色苷性质的影响 为考察纯化工艺对洛神花花色苷性质是否有影响,在可见光区400~800nm对其进行了全波长扫描和HPLC分析。全波长扫描结果发现,纯化后花色苷的波形及其最大吸收波长λmax没有发生改变,均位于花色苷类物质的最大可见吸收波长518nm(图7)。
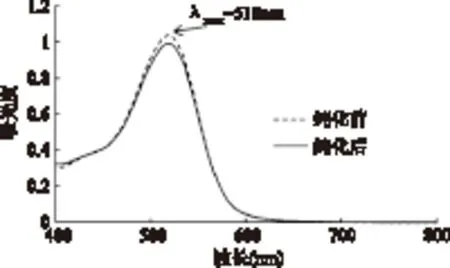
图7 纯化前后洛神花提取物的可见吸收光谱Fig.7 Absorption spectra of roselle extract before and after purification
洛神花色素提取液的HPLC分析结果如图8所示。由文献可知,洛神花中主要含有飞燕草素-3-和矢车菊-3-桑布双糖苷[21],分别对应为图中的两个主要吸收峰。纯化前后两个吸收峰的出峰时间和峰型没有发生改变。由光谱分析和HPLC结果,可以推测采用Sp850树脂纯化过程,未对花色苷的组成产生明显影响。
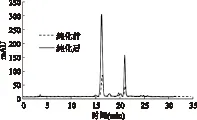
图8 纯化前后洛神花提取物的HPLC图谱Fig.8 HPLC spectra of roselle extract before and after purification
3 结论
本研究对7种不同性质的大孔树脂对洛神花花色苷的吸附解吸能力进行了测定,结果发现Sp850树脂具有较好的吸附和解吸能力。在25℃条件下,吸附数据对Langmuir和Freundlich模型都拟合良好。实验确定的分离纯化最佳条件为:上柱液溶液pH为2.0,上样流速2BV/h,此条件下每克Sp850树脂可处理14.3mg花色苷;洗脱剂为60%乙醇,解吸流速为2BV/h。可见光谱和HPLC分析可知纯化前后花色苷性质未发生变化,纯化后的洛神花花色苷纯度增加7.4倍,由5.8%变为36.8%,回收率达到64.9%。研究结果表明了Sp850大孔树脂对洛神花花色苷进行纯化的工艺是经济有效的,为洛神花色素工业化生产提供了理论基础。
[1]赵桃,唐亚伟,单月琴,等. 青稞紫色素的基本性质及其抗氧化能力[J]. 食品与发酵工业,2010,36(8):68-73.
[2]Kim M J,Hyun J N,Kim J A,etal. Relationship between phenolic compounds,anthocyanins content and antioxidant activity in colored barley germplasm[J]. Journal of Agricultural and Food Chemistry,2007,55(12):4802-4809.
[3]Nam S H,Choi S P,Kang M Y,etal. Antioxidative activities of bran extracts from twenty one pigmented rice cultivars[J]. Food Chemistry,2006,94(4):613-620.
[4]Philpott M,Gould K S,Lim C,etal. In situ and in vitro antioxidant activity of sweetpotato anthocyanins[J]. Journal of Agricultural and Food Chemistry,2004,52(6):1511-1513.
[5]Zhao T,Yang H,Li Y F,etal. In vitro studies on the radical scavenging activity of hulless barley pigment[J]. Advanced Materials Research,2011,183:145-150.
[6]Dai J,Patel J D,Mumper R J. Characterization of blackberry extract and its antiproliferative and anti-inflammatory properties[J]. Journal of Medicinal Food,2007,10(2):258-265.
[7]Zhao C,Giusti M M,Malik M,etal. Effects of commercial anthocyanin-rich extracts on colonic cancer and nontumorigenic colonic cell growth[J]. Journal of Agricultural and Food Chemistry,2004,52(20):6122-6128.
[8]Wang L S,Stoner G D. Anthocyanins and their role in cancer prevention[J]. Cancer Letters,2008,269(2):281-290.
[9]Dai J,Gupte A,Gates L,etal. A comprehensive study of anthocyanin-containing extracts from selected blackberry cultivars:extraction methods,stability,anticancer properties and mechanisms[J]. Food and Chemical Toxicology,2009,47(4):837-847.
[10]Toufektsian M C,De Lorgeril M,Nagy N,etal. Chronic dietary intake of plant-derived anthocyanins protects the rat heart against ischemia-reperfusion injury[J]. The Journal of Nutrition,2008,138(4):747-752.
[11]Cook N C,Samman S. Flavonoids-chemistry,metabolism,cardioprotective effects,and dietary sources[J]. The Journal of Nutritional Biochemistry,1996,7(2):66-76.
[12]Wong P-K,Yusof S,Ghazali H M,etal. Physico-chemical characteristics of roselle(L.)[J]. Nutrition & Food Science,2002,32(2):68-73.
[13]汪洪武,刘艳清. 大孔吸附树脂的应用研究进展[J]. 中药材,2005,28(4):353-356.
[14]刘瑞源,钟平,戴开金. 大孔吸附树脂提取中草药有效成分的研究进展[J]. 时珍国医国药,2004,15(6):3-4.
[15]Lee J,Durst R W,Wrolstad R E. Determination of total monomeric anthocyanin pigment content of fruit juices,beverages,natural colorants,and wines by the pH differential method:Collaborative study[J]. Journal of AOAC international,2005,88(5):1269-1278.
[16]Fu Y,Zu Y,Liu W,etal. Optimization of luteolin separation from pigeonpea[Cajanus cajan(L.)Millsp.]leaves by macroporous resins[J]. Journal of Chromatography A,2006,1137(2):145-152.
[17]樊金玲,朱文学,沈军卫. 高效液相色谱-电喷雾质谱法分析牡丹花中花色苷类化合物[J]. 食品科学,2007,28(8):367-371.
[18]Castaneda-Ovando A,Pacheco-Hernandez M L,Paez-Hernandez M E,etal. Chemical studies of anthocyanins:A review[J]. Food Chemistry,2009,113(4):859-871.
[19]Jung M-W,Ahn K-H,Lee Y,etal. Evaluation on the adsorption capabilities of new chemically modified polymeric adsorbents with protoporphyrin IX[J]. Journal of Chromatography A,2001,917(1):87-93.
[20]Vural G,Serpen A. Equilibrium and kinetic studies on the adsorption of dark colored compounds from apple juice using adsorbent resin[J]. Journal of Food Engineering,2002,53(3):221-227.
[21]Segura-Carretero A,Puertas-meja M A,Cortacero-Ramirez S,etal. Selective extraction,separation,and identification of anthocyanins from Hibiscus sabdariffa L. using solid phase extraction-capillary electrophoresis-mass spectrometry(time-of-flight/ion trap)[J]. Electrophoresis,2008,29(13):2852-2861.
Separation of anthocyanins from roselle by macroporous resins
FAN Bi-qin,DU Jing-jun,ZHAO Tao*
(School of Chemistry and Chemical Engineering,Shanghai University of Engineering Sciences,Shanghai 201620,China)
The absorption and desorption properties of total roselle anthocyanins on macroporous resins including NAK-9,X-5,AB-8,DM130,DA201,Sp850 and XAD-7 were compared. According to the results,Sp850 resin offered better absorption and desorption capacity for roselle anthocyanins than other resins,and its adsorption data at 25℃ fit the best to the Langmuir isotherm. Dynamic adsorption and desorption experiments were carried out on the Sp850 resin packed column to optimize the separation process of anthocyanins from roselle extracts. The optimum parameters for adsorption were as follows:sample pH2.0,flow rate 2BV/h,14.3mg anthocyanin/g resin;for desorption were:elution solvent 60% ethanol and flow rate 2BV/h. Based on the visible spectrum and HPLC results,the anthocyanin compositions didn’t change through the separation process. After be treated with Sp850 resin,the anthocyanins content in the product was increased 7.4-fold from 5.8% to 36.8%,with a recovery yield of 64.9%.
anthocyanins;macroporous resin;roselle;purification
2014-04-03
范碧琴(1992-),女,本科,研究方向:制药工程。
*通讯作者:赵桃(1982-),女,博士,副教授,研究方向:天然产物。
上海工程技术大学高水平项目培育基金(2012gp10);上海工程技术大学大学生创新活动计划(cs1104018);上海市大学生创新活动计划(cs1204011);国家大学生创新活动计划(cx1204012)。
TS201.2
B
1002-0306(2015)01-0220-06
10.13386/j.issn1002-0306.2015.01.037
