COX和CPT在非酒精性脂肪性肝病不同进展阶段中的变化
2015-06-04刘晓琳明雅南张静怡曾民德茅益民
刘晓琳 明雅南 张静怡 曾民德 茅益民
非酒精性脂肪性肝病(NAFLD)包括单纯性脂肪肝(NAFL)和非酒精性脂肪性肝炎(NASH),其与肥胖、糖尿病等代谢危险因素显著相关。NAFLD已呈世界范围内流行,各地患病率在6.3%~33%[1]。通常认为,NAFLD是一个良性过程,但是NASH具有进展为肝硬化和肝癌的风险[2]。
线粒体是细胞物质能量代谢的场所,通过多种信号通路参与肝脏的脂肪代谢和能量的产生。目前,已有越来越多的研究提示线粒体功能异常和NAFLD发生密切相关[3],NAFLD已被认为是一种线粒体疾病。与NAFLD相关的线粒体异常包括线粒体呼吸链复合物活性降低和线粒体β氧化功能受损[4]。细胞色素C氧化酶(COX)是线粒体呼吸链电子传递的终末复合物,镶嵌于线粒体内膜,可调控线粒体的氧化呼吸功能;而肉毒碱棕榈酰转移酶(CPT)是细胞线粒体脂肪酸氧化的限速酶,位于线粒体外膜,可调控长链脂肪酸由细胞质转移到线粒体进行β氧化[5]。本研究旨在了解线粒体两种关键酶在NAFLD进展中的变化。
资料和方法
一、材料
SD大鼠购于上海斯莱克动物实验中心;高脂饲料和胆碱蛋氨酸缺乏饲料购于Research Diets公司(美国);活性线粒体分离试剂盒(GMS10006.2)、纯化线粒体细胞色素C氧化酶活性测定试剂盒(GMS10014.2)、纯化线粒体肉毒碱棕榈酰转移酶活性测定试剂盒(GMS10104)购于杰美基因医药科技有限公司;Trizol、PrimeScriptTM反转录试剂盒、SYBR○RPremix Ex TaqTMII购于Takara公司(日本);PCR引物购于上海生工有限公司;RIPA购于碧云天生物技术公司;BCA购于Thermo公司(美国);COX和CPT抗体购于Abcam公司(英国);全自动生化分析仪(SIEMENS ADVIA1800,美国);TecanInfinite 2000多功能酶标仪(瑞士);UV2450分光光度仪(日本岛津)。
二、方法
(一)动物分组及模型制备 30只雄性6周龄SD大鼠平均分到3组,每组10只。在动物房适应性饲养1周后,对照组给予标准饲料,NALF组给予高脂饲料(HFD),NASH组给予蛋氨酸胆碱缺乏饲料(MCD)。期间自由饮水。饲养温度控制在(24±2)℃,湿度为(50±5)%,每天换水和垫料,每周末称重,持续12周。
(二)肝组织HE染色 在第12周末,大鼠处死后剪下整个肝脏并称重,迅速切下一小部分放入4%甲醛溶液中过夜,第2天将固定好的肝脏组织修剪后放入石蜡中包埋,切片后使用自动染色机进行HE染色。
(三)血清指标检测 在第12周末,采用眼底静脉丛取血法采集30只大鼠的血液,4℃静置凝固后,5 000×g离心30 min,随后使用全自动生化检测仪检测大鼠血清ALT、AST、TBil、三酰甘油(TG)、总胆固醇(TC)、游离脂肪酸(FFA)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)。
(四)实时定量PCR检测肝组织RNA 使用Trizol试剂盒提取肝脏总RNA,使用NanoDrop ND-1000检测RNA的质量和纯度,A260/A280≥1.8作为RNA质量合格的标准。根据PrimeScriptTM反转录试剂盒合成cDNA,然后按照SYBR○RPremix Ex TaqTMII说明扩增18S,COX和CPT。COX和CPT基因的mRNA水平以18S作为内参对照,结果表示为相对 mRNA含量。所用的引物序列为:COX:TGTTCTTCATCGGCTTCACT,AGGGAGGGAGGGAGGAG;CPT:TGACCCTACTACATCCAGAGAT,TCAGACGCCCAAGTATTCAC;18S:AGTCGCCGTGCCTACCAT,CGGGTCGGGAGTGGGTAAT。
(五)Western印迹检测肝组织蛋白 肝组织蛋白用RIPA试剂盒提取,并用BCA法测定肝脏蛋白浓度。经10%SDS-PAGE电泳分离;转移至硝酸纤维素膜,转膜电流为300 mA,COX为8 min,CPT为40 min;在5%的脱脂牛奶室温封闭1 h后,与兔抗鼠的COX(1∶1 000)、CPT(1∶2 000)抗体孵育,4℃过夜。第2天用TBST洗膜3次。室温孵育二抗3 h,洗膜2次。使用荧光试剂盒发光显影。
(六)提取线粒体 肝脏线粒体的提取使用GENMED活性线粒体分离试剂盒。取新鲜肝组织加入预冷的裂解工作液5 mL,涡旋5 s后放入预冷的DOUNCE匀浆器,匀化组织80下,4℃1500×g离心10 min,移出上清液到另一离心管,10 000×g离心10 min,弃上清液,加入保存液2 mL,10 000×g离心5 min,弃上清液,加入冻存液1 mL,混匀后放-80℃冰箱保存。
(七)线粒体COX和CPT活性的检测 使用Bradford蛋白定量测定每份线粒体样品的蛋白浓度。线粒体COX活性的检测使用GENMED纯化线粒体细胞色素C氧化酶活性测定试剂盒(GMS10014.2):在445μL的缓冲液中加入5μL待测样品,室温孵育3 min,加入50μL含有反应液和稳定液的反应工作液,即刻放进分光光度仪,波长550 nm,在0s和60 s各测读1次。线粒体CPT活性的检测使用纯化线粒体肉毒碱棕榈酰转移酶活性测定试剂盒:在350μL的缓冲液中加入50μL反应液和50μL底物液,室温孵育3 min,加入50μL待测样品,即刻放进分光光度仪,波长为412 nm,在0min和15 min各测读1次。
三、统计分析
统计 使 用 SPSS16.0,作 图 使 用 GraphPad Prism5.0。计量资料采用均值±标准差表示,组间比较使用单因素方差分析和Newman-Keuls检验。P<0.05为差异有统计学意义。
结 果
一、动物模型的建立
在造模过程中,NAFL组大鼠的体质量逐渐升高,且高于对照组,而NASH组大鼠的体质量自第5周开始逐渐低于对照组。造模结束后,NAFL的体质量高于对照组,而NASH组体质量低于对照组(P<0.05)。NAFL和NASH组的肝指数(肝湿重/体质量)都明显高于对照组,且NASH组显著高于NAFL组(P<0.05)。表1。
表1 各组大鼠体质量、肝湿重和肝指数比较(s)
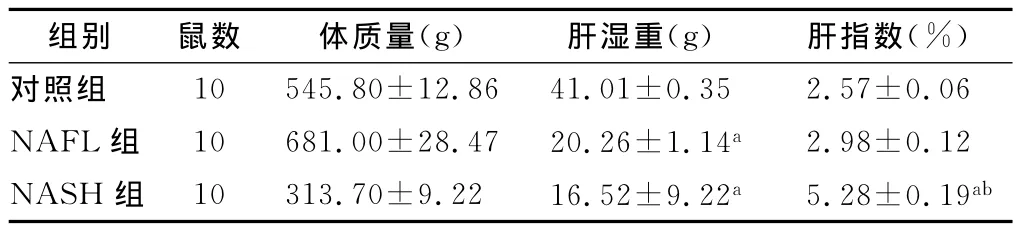
表1 各组大鼠体质量、肝湿重和肝指数比较(s)
注:与对照组比较,aP<0.05;与 NAFL组比较,b P<0.05
组别 鼠数 体质量(g)肝湿重(g)肝指数(%)06 NAFL组 10 681.00±28.47 20.26±1.14a2.98±0.12 NASH 组 10 313.70±9.22 16.52±9.22a5.28±0.19对照组 10 545.80±12.86 41.01±0.35 2.57±0.ab
二、各组大鼠肝脏病理组织学改变
对照组大鼠的肝脏组织结构完整,肝板排列整齐,肝细胞形态结构正常;NAFL组大鼠的肝脏出现大泡和小泡性脂肪变以及气球样变,主要集中在3区,且有少量炎性细胞浸润;NASH组大鼠肝脏则呈现明显的大泡性脂肪变,范围波及整个肝叶,炎性细胞浸润明显,且存在点状坏死。由此提示,NASH组大鼠的肝脏组织学进展程度更重,脂肪变、气球样变、小叶炎性反应更明显。见图1。
三、各组大鼠血清各项指标的变化
与对照组相比,ALT和AST在NAFL组和NASH组均明显升高,NASH组显著高于NAFL组。NASH组的TBil和LDL均较对照组和NAFL组显著增高。TG在NAFL和NASH组中升高。见表2。
四、各组大鼠肝脏组织COX和CPT基因表达量的变化
在大鼠的肝脏组织中提取RNA和蛋白检测了COX和CPT表达量的变化。RT-PCR结果显示,与对照组相比,NAFL组和NASH组COX mRNA含量均降低(P<0.05),见图2A;NAFL组和 NASH 组CPT mRNA含量分别降低了50%和60%(P<0.05),见图2B。NAFL组和 NASH 组的 COX和CPT的蛋白含量也明显降低。见图2C。
五、各组大鼠肝脏组织线粒体COX和CPT酶活性的变化
从肝脏组织分离的活性线粒体立即测量了COX和CPT两种酶的活性,结果显示:COX在NAFL和NASH组,分别降低20%和35%,且NASH组低于NAFL组(P<0.05);CPT在 NAFL和 NASH 组,分别降低35%和50%,且NASH组低于NAFL组(P<0.05)。结果表明,COX和CPT两种酶在NAFLD中活性都受到抑制,且随着疾病的进展,两种酶的活性降低更为显著。见图3。
表2 各组大鼠血清各指标比较(s)
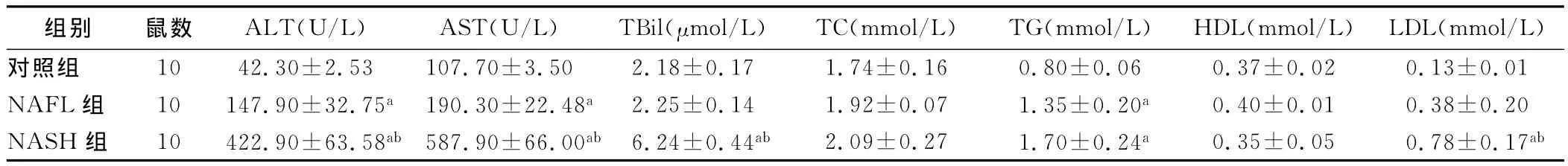
表2 各组大鼠血清各指标比较(s)
注:与对照组比较,aP<0.05;与 NAFL组比较,b P<0.05
组别 鼠数 ALT(U/L)AST(U/L)TBil(μmol/L)TC(mmol/L)TG(mmol/L)HDL(mmol/L)LDL(mmol/L)01 NAFL组 10 147.90±32.75a190.30±22.48a2.25±0.14 1.92±0.07 1.35±0.20a 0.40±0.01 0.38±0.20 NASH 组 10 422.90±63.58ab 587.90±66.00ab 6.24±0.44ab 2.09±0.27 1.70±0.24a 0.35±0.05 0.78±0.17对照组 10 42.30±2.53 107.70±3.50 2.18±0.17 1.74±0.16 0.80±0.06 0.37±0.02 0.13±0.ab

图1 各组大鼠的肝组织病理切片(HE×200)
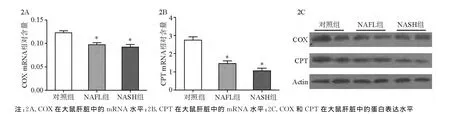
图2 COX和CPT在不同组别大鼠肝脏的表达情况

图3 COX和CPT在大鼠肝脏线粒体中的活性水平
讨 论
NAFLD的发病机制尚未完全阐明,游离脂肪酸向肝脏的传递和运输增多、脂肪酸氧化能力下降可能是NAFLD发病中的关键环节[6]。线粒体通过不同信号通路的调控,不仅参与脂肪酸的β氧化,而且在细胞能量代谢中也发挥重要作用。越来越多的研究证实肝脏的线粒体在NAFLD的发生发展中起到重要作用,但是具体的分子机制尚未明确[7]。
在NAFLD中,线粒体氧化呼吸链(MRC)复合物的活性发生了改变。在HFD和MCD诱导的NASH动物 模 型 中,COX 活 性显著下 降[8-9],但 也 有 报 道,COX活性不变甚至升高[10],这可能提示在NAFLD的进展中有一些MRC水平的代偿机制被激活。一项研究探索了NASH患者中MRC复合物活性的改变,发现5种MRC复合物的肝脏活性明显降低,且与血清TNF-α水平有关[11]。在 NAFLD中,饱和脂肪酸可直接抑制与 MRC相关的酶[12],也可激活c-Jun氨基端激酶,引起线粒体膜通透性转换,导致线粒体释放细胞色素C发生凋亡;同时过量产生的活性氧自由基可以对MRC复合物造成损伤[13]。本研究发现,在NAFL和NASH大鼠模型中,肝脏的COX mRNA和蛋白水平都下降,尤其在肝脏纯化的线粒体中,COX的活性在NASH大鼠比NAFL大鼠降低的程度更显著。提示在分离的线粒体中检测酶的活性改变能更敏感的反映肝脏线粒体的功能障碍;同时也提示随着NAFLD的进展,肝脏的能量代谢状态逐渐恶化。
有研究报道,在啮齿类动物NAFLD的模型中线粒体的脂肪酸氧化水平降低,同时与之相关的酶如CPT的活性降低[14-15]。随着高脂饮食时间的延长,PPARα表达逐渐降低,肝脏损伤加重[16]。特别是在NASH的动物模型中,PPARα表达量持续下降,脂联素水平逐渐降低[17]。虽然在NAFLD中线粒体脂肪酸氧化可维持正常或增强,但在一些以广泛氧化应激和脂质过氧化为特征的严重NASH和肝硬化阶段,线粒体的脂肪酸β氧化过程减弱[18-20]。这些数据都证实了NASH的线粒体β氧化功能存在不同程度的受损。而在本研究中NAFL和NASH大鼠肝脏CPT基因的表达量都减少,并且在肝脏纯化的线粒体中测量CPT的活性,发现在NAFL组和NASH组中,该酶的活性都受到了明显抑制,且NASH组比NAFL组的降低程度更显著。提示在NAFLD进程中,线粒体脂肪酸氧化过程受损,且NASH比NAFL的损伤程度更重。
综上,在NAFLD中,线粒体的能量转化和物质代谢功能都受到了不同程度的抑制,脂肪酸氧化功能异常会促进肝脏的脂肪聚集,MRC功能的进行性降低会干扰能量的输出。随着疾病的发展,两者的恶化会逐渐导致活性氧的过量产生,从而加重氧化应激,促发恶性循环进一步加重NAFLD。线粒体是多种物质和能量的代谢场所,所以其功能障碍会留下代谢指纹,未来可以通过代谢组学等高通量技术筛选出特异性的线粒体障碍标志物,这将有利于在NAFLD患者中早期发现线粒体功能异常。
1 Chalasani N,Younossi Z,Lavine J E,et al.The diagnosis and management of non-alcoholic fatty liver disease:Practice Guideline by the American Association for the Study of Liver Diseases,American College of Gastroenterology,and the American Gastroenterological Association.Hepatology,2012,55:2005-2023.
2 Starley BQ,Calcagno CJ,Harrison SA.Nonalcoholic fatty liver disease and hepatocellular carcinoma:a weighty connection.Hepatology,2010,51:1820-1832.
3 Grattagliano I,de Bari O,Bernardo T C,et al.Role of mitochondria in nonalcoholic fatty liver disease-from origin to propagation.Clinical biochemistry,2012,45:610-618.
4 Wei Y,Rector RS,Thyfault JP,et al.Nonalcoholic fatty liver disease and mitochondrial dysfunction.World journal of gastroenterology,2008,14:193.
5 Serviddio G,Giudetti AM,Bellanti F,et al.Oxidation of hepatic carnitinepalmitoyltransferase-I (CPT-I)impairs fatty acid betaoxidation in rats fed a methionine-choline deficient diet.PLoS One,2011,6:e24084.
6 García-Ruiz C,Baulies A,Mari M,et al.Mitochondrial dysfunction in non-alcoholic fatty liver disease and insulin resistance:cause or consequence?Free radical research,2013,47:854-868.
7 Nassir F,Ibdah JA.Role of mitochondria in nonalcoholic fatty liver disease.International journal of molecular sciences,2014,15:8713-8742.
8 Handa P1,Maliken BD,Nelson JE,et al.Reduced adiponectin signaling due to weight gainresults in nonalcoholic steatohepatitis through impaired mitochondrial biogenesis.Hepatology,2014,60:133-145.
9 Serviddio G,Bellanti F,Tamborra R,et al.Alterations of hepatic ATP homeostasis and respiratory chain during development of non‐alcoholic steatohepatitis in a rodent model.European journal of clinical investigation,2008,38:245-252.
10 Garciía-Ruiz I,Fernaández-Moreira D,Soliís-Munñoz P,et al.Mitochondrial complex I subunits are decreased in murine nonalcoholic fatty liver disease:implication of peroxynitrite.Journal of proteome research,2010,9:2450-2459.
11 Pérez-Carreras M,Del Hoyo P,Martín M A,et al.Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis.Hepatology,2003,38:999-1007.
12 Ciapaite J,Van Eikenhorst G,Bakker S J L,et al.Modular Kinetic Analysis of the Adenine Nucleotide Translocator–Mediated Effects of Palmitoyl-CoA on the Oxidative Phosphorylation in Isolated Rat Liver Mitochondria.Diabetes,2005,54:944-951.
13 Aguirre E,Rodríguez-Juárez F,Bellelli A,et al.Kinetic model of the inhibition of respiration by endogenous nitric oxide in intact cells.BiochimicaetBiophysicaActa (BBA)-Bioenergetics,2010,1797:557-565.
14 Vial G,Dubouchaud H,Couturier K,et al.Effects of a high-fat diet on energy metabolism and ROS production in rat liver.Journal ofHepatology,2011,54:348-356.
15 Han KL,Choi JS,Lee JY,et al.Therapeutic potential of peroxisome proliferators-activated receptor-/ dual agonist with alleviation of endoplasmic reticulum stress for the treatment of diabetes.Diabetes,2008,57:737-745.
16 Huang J,Jia Y,Fu T,et al.Sustained activation of PPARαby endogenous ligands increases hepatic fatty acid oxidation and prevents obesity in ob/ob mice.The FASEB Journal,2012,26:628-638.
17 Nagaya T,Tanaka N,Suzuki T,et al.Down-regulation of SREBP-1c is associated with the development of burned-out NASH.Journal of hepatology,2010,53:724-731.
18 Crescenzo R,Bianco F,Falcone I,et al.Increased hepatic de novo lipogenesis andmitochondrial efficiency in a model of obesity induced by diets rich in fructose.European journal of nutrition,2013,52:537-545.
19 Satapati S,Sunny NE,Kucejova B,et al.Elevated TCA cycle function in the pathology of diet-induced hepatic insulin resistance and fatty liver.Journal of lipid research,2012,53:1080-1092.
20 Diamond DL,Jacobs JM,Paeper B,et al.Proteomic profiling of human liver biopsies: hepatitis C virus-induced fibrosis and mitochondrial dysfunction.Hepatolofy,2007,46:649-657.
