短时强光处理对金心吊兰光合特性的影响
2015-06-01董立花韩巧红杨勇袁明
董立花,韩巧红,杨勇,袁明
(四川农业大学生命科学学院,四川 雅安 625014)
短时强光处理对金心吊兰光合特性的影响
董立花,韩巧红,杨勇,袁明*
(四川农业大学生命科学学院,四川 雅安 625014)
强光胁迫常常导致植物的叶绿素含量下降,但是叶绿素合成受阻的突变体在光胁迫下会发生怎样的生理生化变化目前未见报道。本研究以金心吊兰为材料,研究了同一叶片的不同区带对短时强光胁迫的生理响应。结果表明,1)在正常的光照下,金心部分PSⅡ的活性显著低于其他部分,但活性氧含量却维持在较高的水平;2)在强光胁迫的6 h内,金心部分的活性氧波动不大,抗氧化酶活性变化也较小,均低于其他部分;3)短时强光胁迫导致吊兰叶片的非光化学淬灭上升,而金心部分上升幅度较少,说明吸收的过多光能在金心部分不是以热耗散的形式消耗,并且金心部分能在较短的时间内恢复到胁迫前的非光化学淬灭水平。
光胁迫;金心吊兰;光合作用;叶绿素荧光
光是植物生长发育所必须的环境因子,是光合作用的能量来源,但是植物吸收过多的光能会产生过量的活性氧,抑制光合作用,甚至损伤光合器官,因此光强是影响植物光合作用最直接最重要的环境因子[1-2]。研究表明植物在受到强光胁迫后,光合效率降低,活性氧升高,抗氧化酶活性增加[3]。
叶绿素是植物吸收光能的分子,叶绿素合成的突变体常常被用于研究植物叶绿素代谢及光合作用的分子机制。植物中叶绿素生物合成受阻往往会导致叶绿素含量下降,叶绿体发育延迟,使得叶片表现出黄化或白化的现象,严重时甚至会导致植物体的死亡[4]。金心吊兰(Chlorophytumcapensevar.medio-pictum),是百合科(Liliceae)吊兰属(Chlorophytum)多年生植物,叶片表现为中心黄白色,边缘绿色,形成绿-黄白-绿的嵌合纵条纹[5],贾学静等[6]通过叶绿素原位荧光成像表明金心吊兰的金心部分叶绿素含量极低,没有典型的叶绿体。这种一叶双色性状的叶片是研究植物叶绿素代谢与光胁迫关系的极好材料。
光胁迫与光抑制一直是植物光合作用研究的热点,但是在强光下,叶绿素生物合成受阻的叶部位会发生怎样的生理变化,是否更能适应强光胁迫。本研究以园艺栽培突变体金心吊兰为材料,研究强光胁迫对其叶片生理活动的影响,重点分析叶绿素生物合成受阻的金心部分对强光胁迫的生理响应,从而为探索植物叶绿素生物代谢与光胁迫的关系奠定基础。
1 材料与方法
1.1试验材料和处理方法
试验于2014年6-8月进行,以野生型的全绿吊兰作为突变体金心吊兰的对照,以消除叶片位置效应的影响。选取生长一致的全绿吊兰和金心吊兰栽培于人工气候箱(20℃,80 μmol/m2·s,16 h光/8 h暗),适应生长4周。将材料转移至强光下(氙灯,500 μmol/m2·s),分别处理0,0.5,1,2,3 和6 h后,选取从顶部向外完全展开的第3片成熟叶的中段用于生理生化指标测定。光合参数的测定为10个重复,其余试验均为3个重复。
1.2测定指标和方法
1.2.1叶绿素含量的测定 称取1 g叶片,液氮冷冻研磨,加入10 mL 80%丙酮,转入离心管,用80%丙酮定容至20 mL,5000 r/min离心5 min,取上清液测定664,662,644和440 nm 下的吸光值。参照Lichtenthaler 和Wellburn[7]的方法计算叶绿素a,叶绿素b和类胡萝卜素的含量。
1.2.2光合能力的测定 参照Nilkens等[8]的方法采用多功能调制荧光成像系统(IMAGING-PAM,Walz公司,德国)测定光胁迫下吊兰叶片的荧光参数,先将整盆植株暗适应20 min后,选择从顶部向外完全展开的第3片叶进行测定,光强为500 μmol/(m2·s),间隔时间20 s。测定初始荧光(F0),最大荧光(Fm),光下最小荧光(F0′),光下最大荧光(Fm′),PSⅡ实际光化学效率(ΦPSⅡ),并利用F0和Fm,F0′和Fm′计算PSⅡ最大光化学效率(Fv/Fm),PSⅡ有效光化学量子产量(Fv′/Fm′)。使用GSF-3000(Walz公司,德国)光合仪测定蒸腾速率(Tr),气孔导度(Gs),胞间CO2浓度(Ci)等。测定叶室为2 cm×4 cm,光强为500 μmol/(m2·s),温度为25℃。每个测定选用10个叶片,每个叶片在中段位置选择3个测量点。
1.2.3活性氧和抗氧化酶活性的测定 过氧化氢的测定按照Shabala和Cuin[9]的方法,取叶片液氮研磨后,加入1 mL 0.1% (w/v)三氯乙酸,4℃ 12000 r/min离心10 min,取上清加入0.5 mL 10 mmol/L磷酸钾缓冲液(pH 7.0)和1 mL 1 mol/L碘化钾混匀,暗反应20 min。测390 nm处的吸光值。
超氧阴离子的测定参照Shabala和Cuin[9]的方法。称取叶片,液氮研磨,加入3 mL的50 mmol/L的磷酸钾缓冲液,4℃ 12000 r/min离心20 min,上清液为超氧阴离子的提取液。在试验组、对照组和空白调零组中分别加入0.5 mL的50 mmol/L的磷酸钾缓冲液,在试验组和空白调零组分别加入0.1 mL的10 mmol/L 盐酸羟胺,对照组中加入0.1 mL蒸馏水,在25℃保温10 min,取0.5 mL提取液分别加入试验组和对照组,空白调零组中加入0.5 mL 50 mmol/L的磷酸钾缓冲液,保温10 min,分别加入1 mL 58 mmol/L的对氨基苯磺酸溶液和1 mL 7 mmol/L的一萘胺溶液,25℃保温20 min。加入3 mL的三氯甲烷萃取,取粉红色上相测定530 nm处的吸光值。
超氧化物歧化酶(SOD)活性的测定按照氮蓝四唑(NBT)光还原法[9],反应体系为5 mL:4.05 mL的0.05 mol/L 磷酸缓冲液、0.3 mL的220 mmol/L 甲硫氨酸、0.3 mL的1.25 mmol/L NBT、0.3 mL的100 μmol/L EDTA、0.3 mL的33 μmol/L 核黄素,加入0.05 mL的粗酶提取液启动反应,在4000 lx光下反应15 min,测定560 nm处的吸光值。每间隔1 min测1次,连续测量3 min。
过氧化物酶(POD)活性的测定参照愈创木酚法[9],在离心管中加入3 mL 50 mmol/L磷酸缓冲液,1 mL 0.05 mol/L愈创木酚,1 mL 2% H2O2作为底物反应体系,加入100 μL过氧化物酶粗提液启动反应,分别测定1和3 min时470 nm处的吸光值。
过氧化氢酶(CAT)活性的测定参照过氧化氢还原法[9],具体步骤:3 mL反应液[33.33 mmol/L 磷酸缓冲液,15 mmol/L H2O2]加入50 μL 50 mmol/L粗酶提取液启动反应,测定240 nm处的吸光值。每间隔30 s测1次,连续测量3 min。
1.2.4吊兰叶片对光胁迫的恢复能力测定 参考Alboresia等[10]的方法稍有改动,以非光化学淬灭(NPQ)作为监测金心吊兰对光胁迫响应及其恢复的指标,测定时的弱光及恢复光均为2 μmol/(m2·s),模拟的生长光为86 μmol/(m2·s),胁迫光强为500 μmol/(m2·s),胁迫时间为30 min,每间隔20 s测定1次。
1.3数据分析
采用Excel 2007和SPSS 19.0进行统计分析,并使用ANOVA进行显著性检测(P<0.05),图中数据为平均值±标准误差,并运用Origin 9.0进行绘图。
2 结果与分析
2.1叶片光合色素含量
与野生型全绿吊兰的叶片相比,金心吊兰的叶片边缘为绿色,主脉及其靠近的区域表现出黄白色的条纹(图1)。吊兰叶片由于中心主脉的存在,其中心部分叶绿素含量显著低于边缘部分,但是金心吊兰中心部分叶绿素含量更少,仅为其边缘的18%,而全绿吊兰的中心部分叶绿素含量为边缘部分的58%。金心吊兰的边缘部分与全绿吊兰的边缘部分叶绿素含量没有显著差异,但是中心部分仅为全绿吊兰的34%。类胡萝卜素也表现出与叶绿素相似的变化(图1E)。这说明叶绿素与类胡萝卜素等光合色素的合成在金心吊兰的金心部分明显受到抑制。

图1 吊兰的表型和光合色素含量
2.2光胁迫对金心吊兰叶片光合能力的影响
光胁迫导致胞间CO2浓度(Ci)增加,气孔导度(Gs)和蒸腾速率(Tr)下降(图2)。强光胁迫6 h后,金心吊兰中心部分的蒸腾速率仅为胁迫前的14%,而边缘部分为胁迫前的33%;全绿吊兰的中心部分和边缘部分分别为胁迫前的34%和45%。这表明光胁迫对金心吊兰中心部分蒸腾速率的影响远大于其余部分。气孔导度的变化也表现出相似的特征,但是金心吊兰中心部分的胞间CO2浓度(Ci)却远高于边缘部分,而金心吊兰叶片的中心部分与边缘部分处在同一环境中,光照、温度、湿度等环境因子基本一致,此外, 蒸腾速率与光合速率呈正相关关系,由此表明金心吊兰中心部分光合作用可能更容易受到光胁迫的影响。
2.3光胁迫对金心吊兰叶片叶绿素荧光参数的影响
初始荧光(F0)的大小在某种程度上与叶绿素的含量有关,而与光合作用光化学反应无关[11],金心吊兰中心部分叶绿素含量很低,其F0也很低(图3A)。金心吊兰的金心部分PSⅡ有效光化学量子产量(Fv′/Fm′)和PSⅡ实际光化学效率(ΦPSⅡ)也都处于一个较低的水平。
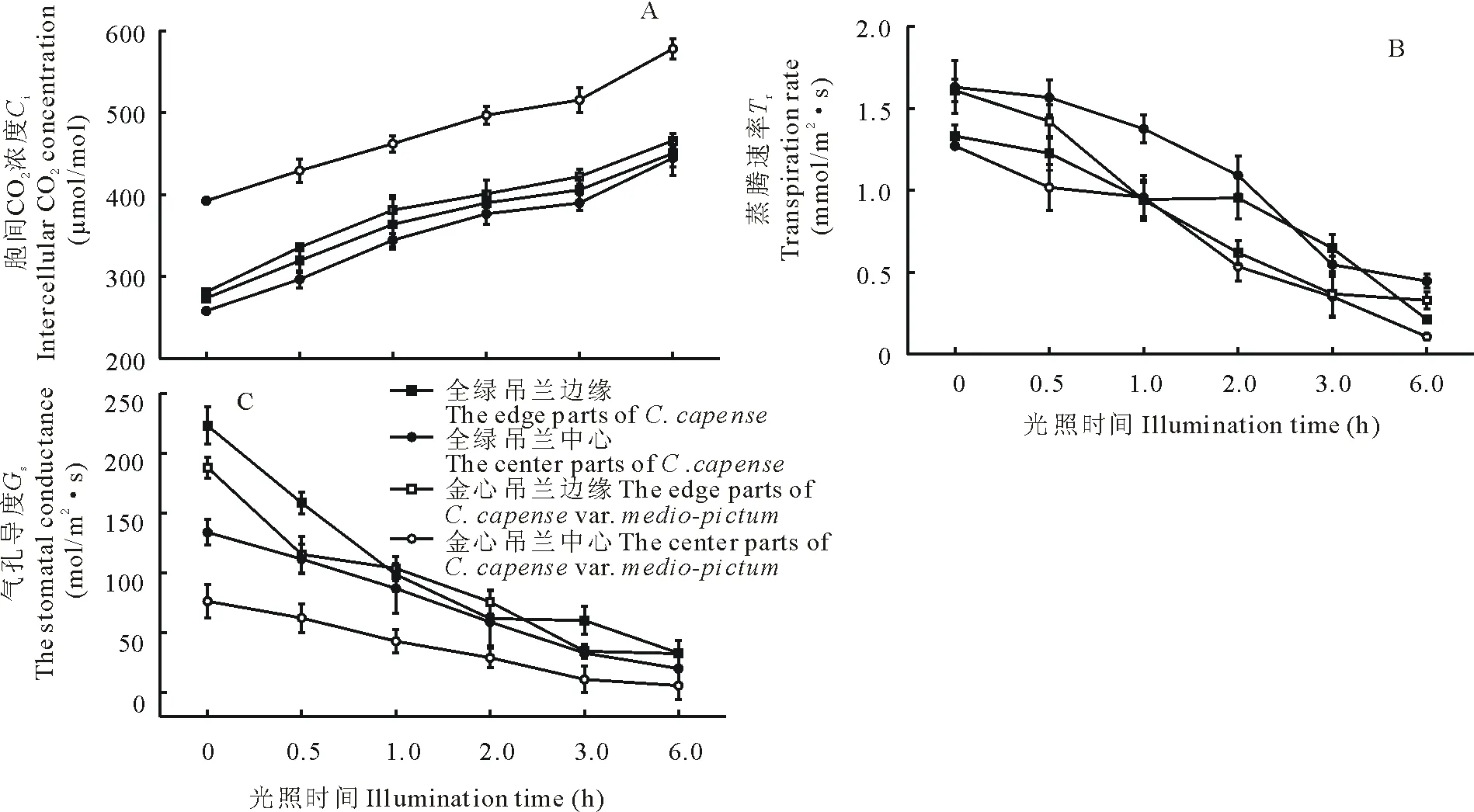
图2 强光胁迫对叶片光合参数的影响

图3 强光胁迫对叶绿素荧光参数的影响
在吊兰叶片的不同部位,随着光胁迫时间的延长,F0均逐渐增大,PSⅡ最大光化学效率(Fv/Fm)随着光胁迫时间的延长逐渐降低(图3B),表明光胁迫可能导致了吊兰叶片PSⅡ反应中心失活,或者叶片受到了不同程度的光抑制。PSⅡ有效光化学量子产量(Fv′/Fm′)和PSⅡ实际光化学效率(ΦPSⅡ)在吊兰叶片的不同部位均表现为随光胁迫时间的延长逐渐减少(图3C, D)。表明光胁迫下吊兰叶片PSⅡ反应中心随胁迫时间的延长而逐渐关闭,天线色素光能传递效率逐步下降,这可能是防止过剩光能导致光合器官被破坏的一种保护性机制[12]。从对强光胁迫0.5 h内的变化幅度来看,金心吊兰的金心部分F0增加约20%,全绿部分增加约10%,而全绿吊兰的中心和边缘部分的增幅都不到10%;金心吊兰的金心部分Fv/Fm下降约40%,其余材料均不到30%;金心吊兰的金心部分Fv′/Fm′下降约50%,其余材料均不到25%;金心吊兰的金心部分ΦPSⅡ下降约40%,其余材料均不到10%。从F0、Fv/Fm、Fv′/Fm′和ΦPSⅡ的变化幅度来看,光胁迫对金心吊兰叶片金心部分的光合作用影响更大。
2.4光胁迫对金心吊兰叶片活性氧的影响
在正常光照下生长,金心吊兰的O2-·含量高于全绿吊兰,中心部分均高于边缘部分(图4A);H2O2的含量金心吊兰也高于全绿吊兰,但是边缘部分高于中心部分(图4B),这表明金心吊兰叶片的叶绿素代谢与叶片的活性氧代谢紧密相关。H2O2的含量在光胁迫过程中总体呈逐渐上升的趋势,在胁迫6 h后全绿吊兰H2O2的含量高于金心吊兰,而且均表现为边缘部分高于中心部分。综合叶片各部分活性氧(O2-·和H2O2)水平在光胁迫过程中随时间波动幅度的变化,金心部分波动幅度较小,相对平稳,说明光胁迫对金心部分的活性氧水平影响较小。
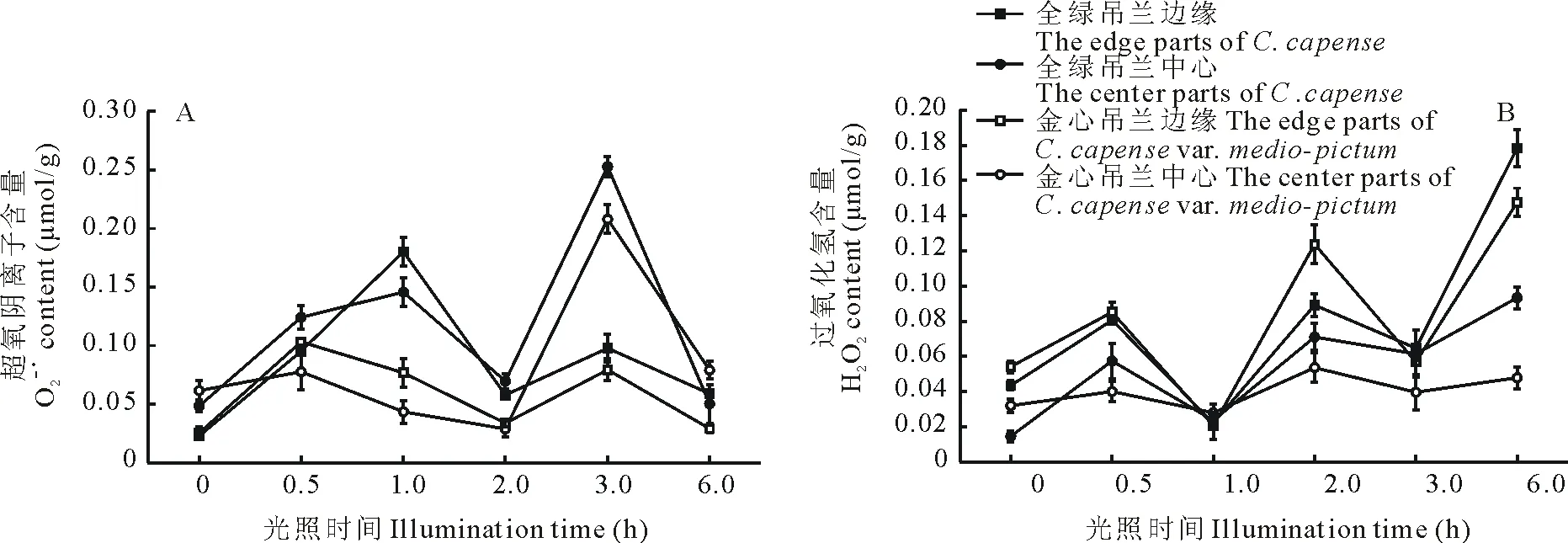
图4 光胁迫对叶组织过氧化氢和超氧阴离子含量的影响
2.5光胁迫对金心吊兰抗氧化酶活性的影响
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物体内清除活性氧的关键酶,其活性变化常常与植物适应胁迫生境的能力密切相关。强光胁迫导致吊兰叶片SOD活性逐渐降低;CAT活性变化总体上与SOD相似,酶活性呈下降的趋势;但POD活性总体是随着强光胁迫时间的延长而增加(图5)。强光胁迫0.5 h,SOD和CAT的活性已经发生了显著变化,说明对于吊兰叶片而言,这2个酶的活性对强光胁迫的反应比较灵敏。从POD和CAT在光胁迫过程中随时间的变化幅度来看,金心部分波动幅度较小,这与活性氧的变化趋势一致。
2.6吊兰叶片对强光胁迫的恢复能力
经过暗适应的吊兰,转到正常的生长光(80 μmol/m2·s)下,其NPQ经过一个短暂的适应期(约200 s),很快达到一个稳定状态(图6)。在正常的光照下,吊兰叶片中心部分的NPQ明显低于边缘部分;金心吊兰的金心部分低于全绿吊兰的中心部分,但是二者的边缘部分相似。说明吊兰叶片的不同部位,NPQ明显不同;叶绿素缺少的金心部分NPQ显著减少。在强光(500 μmol/m2·s)胁迫下,NPQ迅速增加,叶片边缘部分增加的幅度大于中心部分,金心部分增加最少。说明吊兰叶片的边缘部分在强光胁迫下,能够将更多的能量以热耗散的形式消耗掉,从而减少光氧化损伤;而中心部分的热耗散能力较弱。在弱光(2 μmol/m2·s)下,叶片的NPQ逐渐下降,经过500 s的弱光恢复,吊兰叶片的中心部分基本恢复到胁迫前的水平,边缘部分约为胁迫前的2倍。说明短时(720 s)的强光处理,不会对金心部分的光系统造成不可逆的损伤,且与其他部分相比较,金心部分能更快地恢复到胁迫前的光合能力。
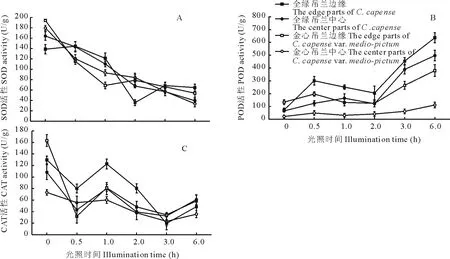
图5 光胁迫对叶片SOD、CAT、POD酶活性的影响
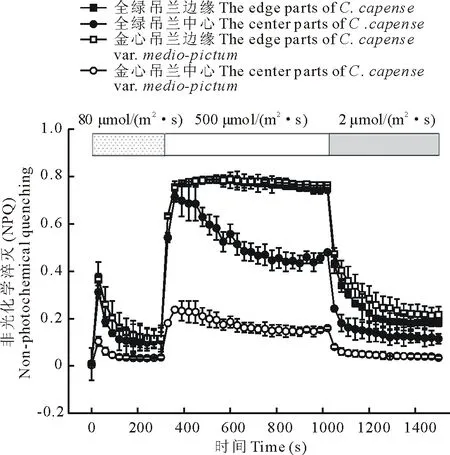
图6 短时强光胁迫对非光化学淬灭的影响
3 讨论
植物在胁迫环境下导致光合效率降低的原因主要包括气孔和非气孔因素,若Ci降低,Tr升高则是气孔因素;Ci升高,Tr降低,则是非气孔因素[13]。在强光下,吊兰叶片的胞间CO2浓度(Ci)随着胁迫时间的延长而增加;蒸腾速率(Tr)和气孔导度(Gs)随着胁迫时间的延长而下降(图2)。这表明光胁迫导致吊兰叶片蒸腾速率下降主要受非气孔因素调节。
PSⅡ对环境胁迫非常敏感,强光胁迫常导致PSⅡ结构和功能发生一系列变化[14]。在本研究中, 金心吊兰和全绿吊兰的生理指标和叶绿素荧光指标(除金心外)都趋于一致,其中生理指标的Gs,Tr,都随着光胁迫时间的延长而下降,Ci则随着光胁迫时间的延长而上升,这和邱翠花[14]对温州蜜柑的研究结果一致。
与气体交换的光合参数相比,叶绿素荧光参数更能反映高等植物光系统Ⅱ(PSⅡ)内在的光合特征,因此, 通过测定叶绿素荧光的变化可以较直观地研究植物光合作用的机制[15-16]。有研究表明,PSⅡ反应中心的失活会导致F0的升高[17],同时叶绿素含量、非辐射能量耗散和PSⅡ反应中心失活或破坏等因素也会导致F0的改变[18]。在强光胁迫下,Fv/Fm随着胁迫时间的延长而降低,表明吊兰叶片的不同区域都受到了不同程度的光抑制,而F0则随着胁迫时间的延长而增加,说明PSⅡ反应中心可能发生了失活或破坏。
植物体受到环境胁迫后,细胞内的活性氧,包括超氧根阴离子(O2-·)、过氧化氢(H2O2)等,代谢常常发生显著变化,因此活性氧的变化常常作为植物对逆境响应的生理指标[19]。在强光胁迫下,金心部分的变化幅度较小,这可能与其较低的叶绿素水平有关。SOD是超氧阴离子的专属清除酶,吊兰叶片在强光胁迫下,其活性变化与细胞内的O2-·变化没有表现出显著的关联关系(图4);CAT和POD都有清除细胞内H2O2的能力,在光胁迫的过程中,吊兰叶片的H2O2含量与CAT的活性表现出明显的负相关,即CAT酶活性升高时,细胞内积累的H2O2下降,反之亦然。这些结果表明,在光胁迫下,CAT是清除吊兰叶细胞内H2O2的主要酶类,POD的作用相对较弱。
NPQ反映的是PSⅡ天线色素吸收的不能用于光合电子传递而以热的形式耗散掉的光能部分,所以NPQ是一种对光合器官起保护作用的自我防护机制。在胁迫生境下植物NPQ常常会增加[20]。金心部分在正常的生长光下,其非光化学淬灭很低,说明在正常的光照下,金心部分的热耗散能力较弱。这样叶片吸收的过多光能不能通过热耗散和光合作用途径消耗,从而增加了过剩光能所激发的电子用来生成活性氧的比例。在正常的光照下,金心部分含有较高的活性氧水平证实了这一点(图4)。在长时间的强光胁迫下,金心部分的光抑制就会加剧,引起光合器官的损坏,甚至导致叶片的坏死。6 h强光照射使得金心吊兰和全绿吊兰受到了严重的光抑制,甚至对金心部分的叶组织造成无法恢复的伤害,最终变枯死亡(数据未给出)。但是在强光照射的过程中,金心部分超氧根阴离子和过氧化氢的波动较其他组织小,抗氧化酶类活性的变化也较小(图4,图5),那么导致其光合能力出现较大波动及其叶组织死亡的原因应该不是超氧根阴离子和过氧化氢的变化,具体原因还需要进一步研究。杨广东等[21]研究发现缺镁的黄瓜叶片在强光下光化学淬灭(光合作用)和非光化学淬灭(热耗散)都降低,使得叶片吸收的过多光能不能通过光化学反应途径和非光化学途径耗散,从而增加了过剩光能所激发的电子用来生成活性氧的比例,加剧光抑制,破坏光合器官,最终导致叶片的失绿坏死。这与吊兰的情况既相似又不同,吊兰在光胁迫下光化学淬灭(光合作用)降低,非光化学淬灭(热耗散)小幅度增加,超氧根阴离子和过氧化氢仅发生小幅度的波动,但是最终却也导致叶组织死亡。
[1] Cleland R E, Melis A, Neale P J.Mechanism of photoinhibition:photochemical reaction center inactivation in photosystem Ⅱ of chloroplasts.Photosynthesis Research, 1995, 9:79-88.
[2] Li X G, Meng Q W, Zhao S J.Photoinhibition and photoprotection mechanisms inGinkgobilobaleaves under strong light stress.Scientia Silvae Sinicae, 2004, 40(3):56-59.
[3] Fini A, Guidi L, Ferrini F,etal.Drought stress has contrasting effects on antioxidant enzymes activity and phenylpropanoid biosynthesis inFraxinusornusleaves:An excess light stress affair.Journal of Plant Physiology, 2012, 169:929-939.
[4] Wang P R, Zhang F T, Gao J X,etal.An overview of chlorophyll biosynthesis in higher plants.Acta Botanica Boreail-Occidentalia Sinica, 2009, 29(3):629-636.
[5] Jia X J, Ran H C, Zeng S H,etal.Study on leaf anatomical structure ofChlorophytumcapensevar.medio-pictum.Journal of Sichuan Agricultural University, 2011, 29(2):199-202.
[6] Jia X J, Dong L H, Ding C B,etal.Effects of drought stress on reactive oxygen species and scavenging system inChlorophytumcapenseVar.Acta Prataculturae Sinica, 2013, 22(5):248-255.
[7] Lichtenthaler H K, Wellburn A R.Determination of total carotenoids and chlorophylls a and b of leaf extracts in different solvents.Biochemical Society Transactions, 1983, 603:591-592.
[8] Nilkens M, Kress E, Lambrev P,etal.Identification of a slowly inducible zeaxanthin-dependent component of non-photochemical quenching of chlorophyll fluorescence generated under steady-state conditions inArabidopsis.Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2010, 1797:466-475.
[9] Shabala S, Cuin T A.Plant Salt Tolerance:Methods and Protocols[M].New York:Humana Press, 2012.
[10] Alboresia A, Gerottob C, Giorgio M G.Physcomitrellapatensmutants affected on heat dissipation clarify the evolution of photoprotection mechanisms upon land colonization.PNAS, 2010, 107(24):11128-11133.
[11] Lu C M, Zhang Q D, Kuang T Y,etal.The effects of water stress on photosystem Ⅱ in wheat.Acta Botanica Sinica, 1994, 36(2):93-98.
[12] Chen D Y, Liu C Y, Yuan Y,etal.Effects of temperature and light treatments on PSⅡ photochemical activity in‘roufurong’tree peony teaves.Acta Horticulturae Sinica, 2011, 38(10):1939-1946.
[13] Hartley I P, Armstrong A F, Murthyw R,etal.The dependence of respiration on photosynthetic substrate supply and temperature:Integrating leaf soil and ecosystem measurements.Global Change Biology, 2006, 12:1954-1968.
[14] Qiu C H.Study of Mechanism of Strong Light Induced Photodamage of Photosynthetic Apparatus inSatsumamandarin(CitrusunshiuMarc.) at High Temperature[D].Hangzhou:Zhejiang University, 2011.
[15] Ivanov A G, Rosso D, Savitch L V,etal.Implications of alternative electron sinks in increased resistance of PSⅡ and PSI photochemistry to high light stress in cold-acclimatedArabidopsisthaliana.Photosynthesis Research, 2012, 113:191-206.
[16] Li R, Wen T, Tang Y P,etal.Effect of shading on photosynthetic and chlorophyll fluorescence characteristics of soybean.Acta Prataculturae Sinica, 2014, 23(6):198-206.
[17] Krause G H, Weis E.Chlorophyll fluorescence and photosynthesis.Annual Review Plant Physiology and Plant, 1991, 42:313-349.
[18] Xu D Q, Wu S.Three phases of dark-recovery course from photoinhibition resolved by the chlorophyll fluorescence analysis in soybean leaves under field conditions.Photosynthetica, 1996, 32:417-423.
[19] Zhou C F, Zheng G S, Zhang Y X,etal.Strong light stress on peony leaf antioxidant system.Jiangsu Agricultural Sciences, 2011, 39(3):232-233.
[20] Li X, Feng W, Zeng X C.Advances in chlorophyll fluorescence analysis and its uses.Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(10):2186-2196.
[21] Yang G D, Zhu Z J, Ji Y M.Effect of light intensity and magnesium deficiency on chlorophyll fluorescence and active oxygen in cucumber leaves.Plant Nutrition and Fertilizer Science, 2002, 8(1):115-118.
参考文献:
[2] 李新国, 孟庆伟, 赵世杰.强光胁迫下银杏叶片的光抑制及其防御机制.林业科学, 2004, 40(3):56-59.
[4] 王平荣, 张帆涛, 高家旭, 等.高等植物叶绿素生物合成的研究进展.西北植物学报, 2009, 29(3):629-636.
[5] 贾学静, 冉何陈, 曾顺华, 等.园艺观赏植物金心吊兰的叶片解剖结构.四川农业大学学报, 2011, 29(2):199-202.
[6] 贾学静, 董立花, 丁春邦, 等.干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响.草业学报, 2013, 22(5):248-255.
[11] 卢从明, 张其德, 匡廷云, 等.水分胁迫对小麦光系统Ⅱ的影响.植物学报, 1994, 36(2):93-98.
[12] 陈大印, 刘春英, 袁野, 等.不同光强与温度处理对“肉芙蓉”牡丹叶片PSⅡ 光化学活性的影响.园艺学报, 2011, 38(10):1939-1946.
[14] 邱翠花.高温强光诱导的温州蜜柑光合机构光破坏机理研究[D].杭州: 浙江大学,2011.
[16] 李瑞, 文涛, 唐艳萍, 等.遮阴对大豆幼苗光合和荧光特性的影响.草业学报, 2014, 23(6):198-206.
[19] 周传凤, 郑国生, 张玉喜, 等.强光胁迫对牡丹叶片抗氧化系统的影响.江苏农业科学, 2011, 39(3):232-233.
[20] 李晓, 冯伟, 曾晓春.叶绿素荧光分析技术及应用进展.西北植物学报, 2006, 26(10):2186-2196.
[21] 杨广东, 朱祝军, 计玉妹.不同光强和缺镁胁迫对黄瓜叶片叶绿素荧光特性和活性氧产生的影响.植物营养与肥料学报, 2002, 8(1):115-118.
Photosynthetic characteristics ofChlorophytumcapensevar.medio-pictumunder short duration high light intensity
DONG Li-Hua, HAN Qiao-Hong, YANG Yong, YUAN Ming*
CollegeofLifeScience,SichuanAgriculturalUniversity,Ya’an625014,China
It is well known that high light often causes decreased chlorophyll in plants, but the photosynthetic and physiological characteristics of reduced chlorophyll variants under high light is not well understood.Physiological responses to high light intensity in the green stripe and yellow stripe leaf variants ofChlorophytumcapensevar.medio-pictumwere investigated in this study.The results showed that under normal light levels, PSⅡ activity of yellow stripe plants was lower than those of green stripe.However, the level of reactive oxygen species remained elevated.After 6 hours of high light stress, the level of reactive oxygen species and activity of antioxidant enzymes varied less in yellow stripe plants.Under a few minutes of high light stress, non-photochemical quenching increased in all tissues, but the non-photochemical quenching of the yellow stripe plants increased less than the others.These results demonstrated that excess light energy in yellow-stripe leaf tissue was not dissipated in the form of heat; furthermore, the level of non-photochemical quenching in yellow stripe plants was restored in a few minutes.
high light stress;Chlorophytumcomosumvar.medio-pictum; photosynthesis; chlorophyll fluorescence
10.11686/cyxb2015059
http://cyxb.lzu.edu.cn
2015-01-27;改回日期:2015-03-18
四川省教育厅青年项目(11ZB054)资助。
董立花(1989-),女,河北邯郸人,在读硕士。E-mail:dlh_scau@163.com
*通信作者Corresponding author.E-mail:yuanming@sicau.edu.cn
董立花, 韩巧红, 杨勇, 袁明.短时强光处理对金心吊兰光合特性的影响.草业学报, 2015, 24(12):245-252.
DONG Li-Hua, HAN Qiao-Hong, YANG Yong, YUAN Ming.Photosynthetic characteristics ofChlorophytumcapensevar.medio-pictumunder short duration high light intensity.Acta Prataculturae Sinica, 2015, 24(12):245-252.
