盐胁迫下TheIF1A基因启动子表达特性分析
2015-06-01郭宇聪杨桂燕赵玉琳张凤娇高彩球
郭宇聪 杨桂燕 赵玉琳 张凤娇 高彩球
(林木遗传育种国家重点实验室(东北林业大学),黑龙江哈尔滨150040)
盐胁迫下TheIF1A基因启动子表达特性分析
郭宇聪 杨桂燕 赵玉琳 张凤娇 高彩球
(林木遗传育种国家重点实验室(东北林业大学),黑龙江哈尔滨150040)
为探讨刚毛柽柳真核翻译起始因子1A(TheIF1A)基因对植物逆境胁迫响应的调控作用,对TheIF1A基因启动子盐胁迫下的应答表达情况进行分析,比较转TheIF1A基因启动子拟南芥在不同浓度盐胁迫及不同时间后GUS染色和酶活差异。结果显示:TheIF1A启动子在短时间内即对400mmol/L NaCl胁迫做出应答,主要表现为表达受抑制,各组织中老叶的GUS酶活性最高;100 mmol/L NaCl胁迫下,TheIF1A启动子活性也被明显抑制,胁迫20 h后,GUS酶活性恢复到较高水平,各组织中,根中的活性最低。研究表明,TheIF1A启动子的表达能对盐胁迫作出应答,但在低盐和高盐胁迫下的应答方式存在一定的差异性。
刚毛柽柳;盐胁迫;表达模式;TheIF1A启动子
真核生物翻译起始因子(eIF)是参与真核生物翻译起始过程的一种蛋白质,分为eIF1-6等6个不同的家族,在翻译起始过程中起着重要的调控作用[1-3]。其中eIF1A在翻译起始过程中行使的功能是从mRNA 5’端开始对基因序列进行查扫(scanning),当eIF1A查到AUG起始密码子时便会牢固结合到此处,在查扫过程中,eIF1A使Met-tRNA和40 s核糖体亚基牢固结合,阻止40 s与60 s核糖体亚基的结合,从而延迟了起始复合物的形成[4]。一些研究表明,植物eIF1A基因也参与植物抗逆调控过程[5-6]。但目前对翻译起始因子的启动子在抗逆调节过程中的作用研究较少。启动子是一段控制基因表达过程开始时间及表达程度的核苷酸序列,转录因子通过与基因启动子结合参与基因活动。对1个基因启动子表达特性的分析能初步判断1个基因的功能[7]。启动子表达特异性分析的方法目前主要使用GUS表达活性观察和测定[8-9],即将获得的基因启动子与GUS基因嵌合形成重组载体,通过农杆菌介导法转化拟南芥,得到转基因拟南芥纯合子。通过组织化学染色对转基因拟南芥各个生长时期及各个形态部位的GUS活性结果进行观察分析,同时对GUS酶活进行测定。对于逆境应答基因应答模式的研究则主要是通过对上述转基因拟南芥在营养生长最旺盛时期进行不同浓度和不同时间的胁迫处理,测定和比较胁迫条件下GUS的活性情况[10]。
柽柳(Tamarix spp.)是抗旱耐盐研究的理想材料[11]。刚毛柽柳(Tamarix hispida)ThWRKY4基因受其启动子的表达调控响应于盐、干旱、ABA等胁迫[12];ThbZIP启动子的表达也具有明显时空表达特异性,在调节目的基因的抗旱耐盐上发挥重要作用[13]。白花柽柳(Tamarix androssowii)翻译起始因子5A启动子GUS染色结果表明该启动子在不同生长发育时期、不同组织中也具有不同的表达特性[14]。前期研究表明刚毛柽柳翻译起始因子1A(TheIF1A)基因表达能够对NaCl、PEG、NaHCO3和CdCl2等胁迫做出应答,过表达TheIF1A基因能明显提高转基因烟草抗旱耐盐能力。表明TheIF1A基因可能是一个抗旱耐盐相关基因,在柽柳抗逆应答过程中发挥重要作用。在此基础上,本研究拟进一步对刚毛柽柳TheIF1A基因启动子在盐胁迫下的表达模式进行分析,探讨盐胁迫下TheIF1A基因启动子的表达特性,以此了解TheIF1A基因启动子对盐胁迫的响应模式,为探讨该基因的耐盐调控机理奠定基础。
1 材料与方法
1.1 植物材料及胁迫处理
将克隆获得的1 352 bp TheIF1A启动子置换pCAMBIA1301载体的35S启动子,转化拟南芥获得T4代纯合株系。将T4种子在4℃春化2 d后,用NaClO对种子进行表面消毒后播种于1/2 MS培养基上8 d,移栽至灭菌土。置于温度(22±2)℃,相对湿度为70%±5%,光照周期14 h明和10 h暗的温室中,5周后对植株分别进行400mmol/L NaCl浇灌处理(0、15、30、45min)和100mmol/L NaCl浇灌处理(0、5、10、20 h)。胁迫处理后取大小基本一致的整株苗进行GUS染色[12],利用实体显微镜观察和拍照;同时收集苗木用于GUS酶活性测定。每个处理12~16株苗。
1.2 GUS酶活性测定
1.2.1 标准曲线绘制
1)4-MU标准曲线:使用反应终止液将MU母液(1mmol/L)稀释成浓度范围在0~10μmol/L的系列标准液,在455 nm处测定其荧光强度,作出荧光强度与溶液浓度的线性曲线,即为4-MU标准曲线。
2)BSA标准曲线:配置BSA标准液(10mg/mL),逐级稀释得到BSA系列标准液(5个梯度),分别测定595 nm吸光度值。以蛋白浓度为横坐标,吸光度为纵坐标,获得吸光度与浓度曲线,即为BSA标准曲线。
1.2.2 样品GUS酶活性测定 取0.05~0.10 g植物材料于2 mL离心管,液氮研磨后加入600μL酶提取液;3 000 r/min 4℃离心10min,取适量上清液用考马斯亮蓝法测定蛋白含量,取50μL上清液加入37℃预热的950μL 2mmol/LMUG溶液,迅速充分混匀,立刻取出50μL加入到950μL 0.2mol/L Na2CO3终止反应,将该管作为酶促反应的0点;分别在反应5、10、20、30、45、60min后取出50μL的反应液,转入950μL的反应终止液中;用荧光分光光度计测定激发波长365 nm、发射波长455 nm处不同时间点的荧光值。
2 结果与分析
2.1 GUS酶活测定标准曲线
为了测定盐胁迫处理不同浓度不同时间转基因(TheIF1A)启动子拟南芥的GUS表达情况,制备了BSA和4-MU标准曲线(图1),各标准曲线的R值分别为0.99和1.00,达到测定要求。
2.2 高盐胁迫下TheIF1A基因启动子的表达模式
对400mmol/L NaCl胁迫处理后的转TheIF1A启动子拟南芥进行GUS染色,结果见图2。结果显示,胁迫处理前拟南芥的叶、根均能被染色,且颜色较深。胁迫15min后整个植株的GUS染色变浅,老叶着色较嫩叶深。胁迫30 min后整个植株的GUS染色加深,45min后染色稳定,且基本不变。
相应的GUS酶活性测定结果也显示,非胁迫处点,根、叶片和叶柄的GUS酶活性差异也达到显著水平,其中叶片中的GUS活性最高(图3B)。理时,整株GUS酶活性较高,胁迫处理15 min后迅速降低,随后逐渐升高(图3A)。在同一处理时间



2.3 低盐胁迫下TheIF1A基因启动子的表达模式
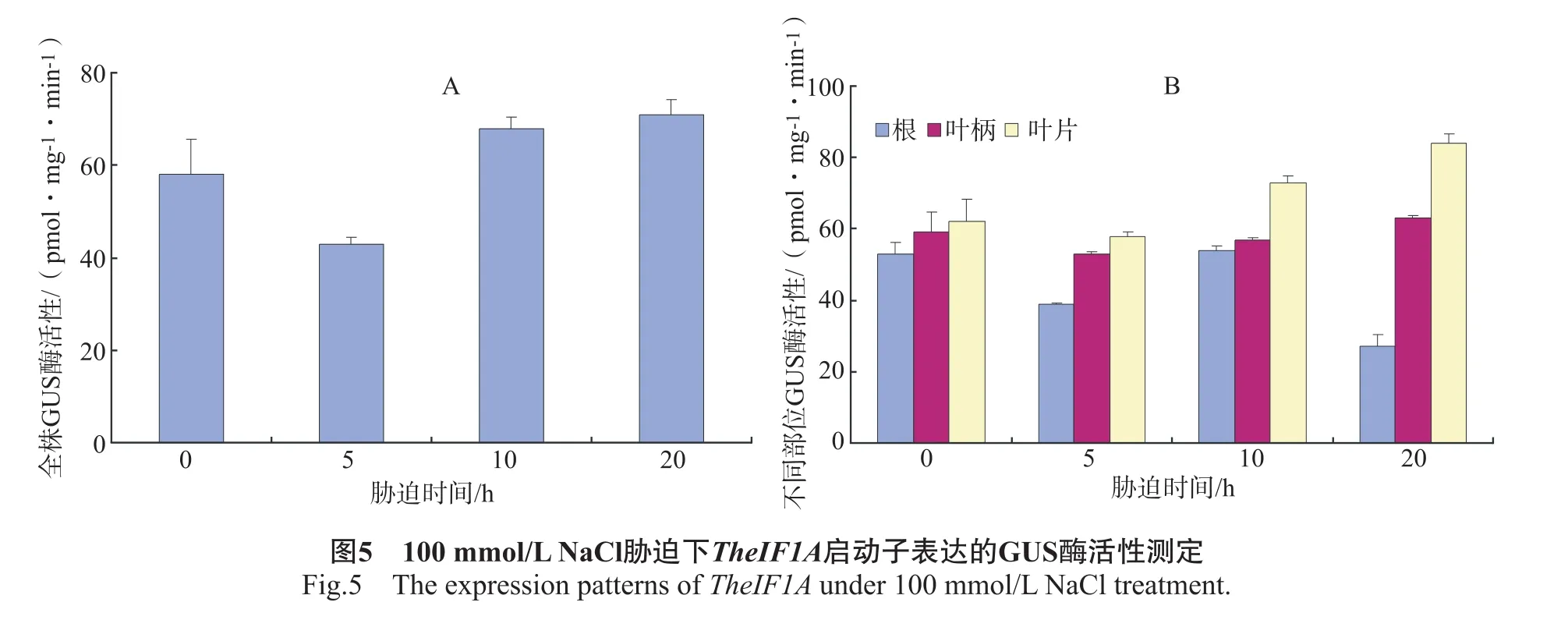
为了比较TheIF1A基因启动子对高盐瞬时胁迫和低盐较长时间胁迫的应答模式差异,用100 mmol/L NaCl胁迫处理转TheIF1A启动子拟南芥,对胁迫0~20 h后的植株进行GUS染色,结果如图4所示。非胁迫时植株的GUS染色整体较深,其中老叶的着色较根和嫩叶深,胁迫5 h时整个植株染色变浅;而10 h时叶片的染色加深,根部也有一定的着色;20 h时整个植株的GUS活性继续增强。这与高盐短时间胁迫的趋势基本相似。
各处理时期植株GUS酶活性测定结果显示,胁迫初期,整个植株总GUS酶活性明显降低,随着胁迫时间的延长,整个植株中GUS酶活性逐渐增加,表明TheIF1A启动子的表达活性总体增强(图5A)。不同组织部位GUS酶活性结果显示,GUS酶活性在不同组织部位间分布具有明显差异,叶片中的GUS酶活性最高,而根中的GUS酶活性最低(图5B),表明在高浓度和低浓度NaCl胁迫处理,TheIF1A启动子的表达虽都具有组织表达特异性,但GUS活性在各组织中的分布略有不同。

3 讨 论
本研究通过测定高盐和低盐胁迫下TheIF1A启动子的表达情况,以探讨其对TheIF1A基因耐盐调控的方式。非胁迫下,拟南芥整个植株GUS酶活性较高。400mmol/L NaCl胁迫处理后,GUS表达在3个组织中都被迅速抑制,尤其是叶片中表达量变化最大。叶片是植物进行光合作用的重要器官,叶片中TheIF1A启动子GUS活性在受到盐胁迫后迅速降低,随胁迫时间的延长,其活性明显增高,表明植物在受到高盐胁迫后,短期内其光合作用相关蛋白的翻译可能受到了明显抑制。在较低浓度盐胁迫下,5 h其GUS活性降低,且在根、叶、叶柄中不同,体现了TheIF1A启动子的组织特异表达特性,但高盐和低盐胁迫下,GUS酶活的变化在根茎叶中的变化有差异,说明TheIF1A启动子调控其响应高盐和低盐的表达模式不同。以往研究表明,不同基因启动子的表达特性不同。袁正强等人比较了BP、CP、SP、CaMV35S启动子在烟草中的GUS表达活性,结果转基因烟草的叶脉GUS活性高于叶片,揭示这3个启动子具有韧皮部组织特异性[15]。另有研究显示:Tm-22基因的抗病性受不同启动子控制,启动子对于Tm-22基因的抗病调节具有重要的作用[16]。
DREB基因是响应于干旱、盐等胁迫的抗逆调控相关基因,拟南芥DREB2A和DREB2B基因在干旱、盐胁迫下调控GUS基因的表达,且在高盐(250 mmol/L NaCl)胁迫15 min时这2个基因即被快速诱导[17]。Russal等[5]研究表明eIF1A基因也能有效提高酵母和拟南芥对NaCl的耐受力。干旱胁迫下柽柳eIF1A基因能加速蛋白的合成起始,提高SOD活性,从而提高转柽柳eIF1A基因烟草的抗旱能力[18]。本研究显示TheIF1A启动子能对高盐胁迫作出快速应答,但400 mmol/L NaCl胁迫下转TheIF1A启动子拟南芥在15 min时被明显抑制,到45min开始恢复到较高表达水平,这可能与盐浓度过高有关。盐离子浓度过高,可能抑制了TheIF1A启动子对翻译起始过程的调控,待植物对这种高强度的刺激作出响应并适应后,TheIF1A基因开始恢复调控翻译起始等功能来调节高盐适应。
高盐胁迫下TheIF1A体现的组织表达特异性与低盐胁迫不同,低盐胁迫下GUS酶活性主要趋势为根<叶柄<叶,而在高盐胁迫下则为叶>根>叶柄。2种浓度盐胁迫下TheIF1A启动子的表达活性在叶中均最高,而在叶柄和根中表达活性大小存在差异。表明在不同浓度盐胁迫刺激下TheIF1A启动子对TheIF1A基因的响应调控方式具有一定差异。植物根部是吸收水分和无机盐的重要器官。盐胁迫浇灌处理时,根部最先感知盐胁迫,最先受盐胁迫地影响。因此,根部对盐离子、矿物质等的选择性吸收,对盐胁迫环境的适应对植物耐盐调控起重要作用。植物的叶柄在水分、无机盐和有机物的运输过程中起重要作用。盐胁迫对植物的一种最重要的影响是引起生理性干旱。因此,2种盐浓度胁迫后,根和叶柄中TheIF1A启动子控制的GUS酶活性的差异,可能是由于2种盐胁迫处理对根和叶柄中的水分分配等的影响不同。
总之,转TheIF1A启动子拟南芥在不同浓度盐胁迫后的GUS染色及GUS酶活活性测定结果表明,TheIF1A启动子对盐胁迫的响应比较敏感,且在高盐和低盐胁迫下呈现不同的调控方式,该结果为后续TheIF1A启动子对TheIF1A基因耐盐调控机理的研究提供了参考。
[1] Kyrpides N C,Woese C R.Universally conserved translation initiation factors[J].Proceedings of the National Academy of Sciences,1998,95(1):224-228.
[2] Ptushkina M,Malys N,McCarthy JE.eIF4e isoform 2 in Schizosaccharomyces pombe is a novel stress-response factor[J].EMBO Reports,2004,5(3):311-316.
[3] Rangan L,Rout A,Sudarshan M,et al.Molecular cloning,expression and mapping of the translational initiation factor eIF1 gene in Oryza sativa[J].Functional Plant Biology,2009,36(5):442-452.
[4] Battiste JL,Pestova T V,Hellen C U,et al.The eIF1A solution structure reveals a large RNA-binding surface important for scanning function[J].Molecular Cell,2000,5(1):109-119.
[5] Rausell A,Kanhonou R,Yenush L,et al.The translation initiation factor eIF1A is an important determinant in the tolerance to NaCl stress in yeast and plants[J].The Plant Journal,2003,34(3):257-267.
[6] Latha R,Salekdeh G H,Bennett J,et al.Molecular analysis of a stress-induced cDNA encoding the translation initiation factor,eIF1,from the salt-tolerantwild relative of rice,Porteresia coarctata[J].Functional Plant Biology,2004,31(10):1035-1042.
[7] 吴纯清,张兴国,梁国鲁,等.拟南芥AtRD29α启动子在烟草中的表达特性[J].西南农业学报,2008,21(4):1045-1047.
[8] 王颖,麦维军,梁承邺,等.高等植物启动子的研究进展[J].西北植物学报,2004,23(11):2040-2046.
[9] Tang L,Kwon SY,Kim SH,et al.Enhanced tolerance of transgenic potato plants expressing both superoxide dsmutase and ascorbate peroxidase in chloroplasts against oxidative stress and high temperature[J].Plant Cell Reports,2006,25(12):1380-1386.
[10] 石东乔,周奕华.甘蓝型油菜BcNA1基因启动子在转基因烟草中对GUS基因表达的调控[J].植物生理学报,2001,27(4):313-320.
[11] 尹林克.中亚荒漠生态系统中的关键种:柽柳(Tamarix spp.)[J].干旱区研究,1995,12(3):43-47.
[12] Zheng L,Liu G,Meng X,et al.A WRKY gene from Tamarix hispida,ThWRKT4,mediates abiotic stress responses by modulating reactive oxygen species and expression of stress-responsive genes[J].Plant Molecular Biology,2013,82(4/5):303-320.
[13] Ji X,Liu G,Liu Y,et al.The bZIP protein from Tamarix hispida,ThbZIP1,is ACGT elements binding factor that enhances abiotic stress signaling in transgenic Arabidopsis[J].BMC Plant Biology,2013,13(1):151.
[14] Wang L,Xu C,Wang C,et al.Characterization of a eukaryotic translation initiation factor 5A homolog from Tamarix androssowii involved in plant abiotic stress tolerance[J].BMC Plant Biology,2012,12(1):118.
[15] 袁正强,吴家和.三个韧皮部特异性启动子在转基因烟草中表达的比较研究[J].农业生物技术学报,2002,10(1):6-9.
[16] 姜国勇,杨仁崔.番茄Tm-22基因在烟草中的表达及其对番茄花叶病毒(Tomv)的特异抗性[J].病毒学报,2004,19(4):365-370.
[17] 谢永丽,王自章,张淑平.DREB:一类应答植物非生物逆境胁迫的转录因子[J].青海大学学报(自然科学版),2006,24(2):54-58.
[18] 高彩球,李艳霞,刘桂丰,等.翻译起始因子(eIF1A)基因的获得及抗旱性分析[J].东北林业大学学报,2007,35(8):6-9.
(责任编辑 张 坤)
The Expression Pattern of TheIF1A Promoter Under Salt Stress
Guo Yucong,Yang Guiyan,Zhao Yulin,Zhang Fengjiao,Gao Caiqiu
(State Key Laboratory of Tree Genetics and Breeding(Northeast Forestry University),Harbin Heilongjiang 150040,China)
Eukaryotic translation initiation factor 1A in Tamarix hispida(TheIF1A)invovled in the regulation to abiotic stress.In this study,the TheIF1A promoter expression patternswere analyzed under salt stress to explore the genes functions under stress and then,GUS activities among different concentration NaCl and various stress times in the transgenic TheIF1A promoter T4 Arabidopsiswere compared.The results showed that TheIF1A promoter could quickly response to NaClwith 400 mmol/L.The GUSactivity was decreased after 15 min treated by NaCl stress.And the highest GUS activities were showed in leaves.The expression of TheIF1A promoter was also obviously decreased under 100 mmol/L NaCl stress.Then the GUSactivitieswere increased.After treated by 20 h,it was obvious higher than 0 h treatment.Among the 3 organs(roots,leaves and petioles),the GUS activity in root was the lowest.These results indicated that the expressions of TheIF1A promoter could response to salt stress,while the expression patters were difference between high and low concentration NaCl stresses.
Tamarix hispida;salt stress;expression pattern;TheIF1A promoter
S772.36
:A
:2095-1914(2015)06-0001-05
10.11929/j.issn.2095-1914.2015.06.001
2015-03-04
国家自然科学基金项目(31370676)资助;中央高校基本科研业务费专项资金项目(2572014DA03)资助。
第1作者:郭宇聪(1991—),女,硕士生。研究方向:林木遗传育种。Email:dnadada@163.com。
高彩球(1980—),女,副教授。研究方向:林木遗传育种。Email:gaocaiqiu@nefu.edu.cn。
