注射用头孢孟多酯钠与注射用奥美拉唑钠的配伍禁忌探讨
2015-06-01黎敏如
黎敏如
注射用头孢孟多酯钠与注射用奥美拉唑钠的配伍禁忌探讨
黎敏如
目的探讨注射用头孢孟多酯钠与注射用奥美拉唑钠的配伍禁忌。方法高效液相色谱法(HPLC)法测定头孢孟多酯钠、奥美拉唑钠配伍液在4、25、30℃环境下放置6 h内不同时间点外观、相对含量及pH值的变化。结果在室温(25、30℃)条件6 h下, 配伍液外观、澄明度及pH值发生明显变化, 且头孢孟多酯钠、奥美拉唑钠含量明显降低。结论注射用头孢孟多酯钠与注射用奥美拉唑钠存在配伍禁忌, 应间隔使用。
头孢孟多酯钠;奥美拉唑钠;配伍禁忌
头孢孟多酯钠(cefamandole nafate)为第二代头孢菌素类广谱抗生素, 奥美拉唑钠是临床常用质子泵抑制剂和抗酸药,二者常联用于放化疗后引起胃溃疡或食管炎合并咽部感染等疾病的治疗[1]。2014年10月, 本院临床科室报告指出二者应用时出现明显的外观颜色变化, 推断属配伍禁忌, 因及时更换输液器及药液, 患者无不良反应发生, 但《400种中西药注射剂临床配伍应用检索表》[2]及药品说明书均无以上两种注射针剂存在配伍禁忌的说明。为确保用药安全, 本实验参照相关文献方法[3,4], 采用高效液相色谱法对上述两药配伍稳定性及外观、pH值进行观察, 为临床用药提供参考。现报告如下。
1 材料与方法
1.1 仪器与试药 岛津LC-2010HT型高效液相色谱仪及配套工作站, 上海雷磁仪器厂PHS-3C酸度计, 常州诺基仪器有限公司BS124S型电子分析天平。注射用头孢孟多酯钠(海南灵康制药有限公司, 国药准字H20057291, 规格:0.5 g), 注射用奥美拉唑钠(苏州二叶制药有限公司, 国药准字H20103381,规格:60 mg), 头孢孟多酯钠、奥美拉唑钠对照品均购于中国药品生物制品检定所。
1.2 实验方法
1.2.1 波长的选择 精密称取头孢孟多酯钠、奥美拉唑钠对照品, 0.9%氯化钠溶液溶解制成2.0 mg/ml、0.6 mg/ml对照品溶液, 190~400 nm波长内进行扫描发现:头孢孟多酯钠、奥美拉唑钠最大吸收波长分别为(270±1)nm、(300±1)nm。301 nm处奥美拉唑钠、头孢孟多酯钠均可实现最大吸收, 可选择为测定波长。
1.2.2 色谱条件 色谱柱Agilent HC-C18(4.6 mm×250 mm, 5 μm);流动相:乙腈-水(35∶65), 流速1.0 ml/min;检测波长301 nm;柱温25℃, 进样量10 L。
1.2.3 线性关系考察 精密称取头孢孟多酯钠、奥美拉唑钠对照品适量, 加0.9%氯化钠溶液稀释制成不同浓度系列溶液, 按“1.2.2”色谱条件进样, 以对照品的峰面积(A)对浓度(C)进行线性回归, 得回归方程:A孟=1.0120 C孟-4.2300, r=0.9996(n=5);A奥=2.3107 C奥-4.6102, r=0.9993(n=5)。表明头孢孟多酯钠在2.4~56.0 μg、奥美拉唑钠在0.06~0.60 μg范围内线性关系良好。
1.2.4 精密度实验 取0.40 mg/ml头孢孟多酯钠对照品溶液和0.030 mg/ml奥美拉唑钠对照品溶液10 μl, “1.2.2”色谱条件下重复进样5次, 测得头孢孟多酯钠、日内精密度RSD分别为0.64%、0.75%。
1.2.5 回收率实验 取不同浓度(0.30、0.40、0.48 mg/ml)的头孢孟多酯钠对照品溶液, 分别加入0.4 mg/ml奥美拉唑钠氯化钠溶液中, 按“1.2.2”色谱条件进行测定, 代入回归方程, 测得头孢孟多酯钠平均回收率98.25%, RSD 1.91%。取奥美拉唑钠不同浓度(0.030、0.064、0.096 mg/ml)对照品溶液分别加入10 mg/ml头孢孟多酯钠溶液中, 测得奥美拉唑钠平均回收率99.17%, RSD 1.82%。
1.2.6 稳定性与重复性实验 精密量取已配置头孢孟多酯钠、奥美拉唑钠溶液, “1.2.2”色谱条件下0、2、4、6 h分别进行含量测定, 测得RSD为1.27%和0.75%, 重复进样5次,测得RSD为0.82%和0.70%。表明样品溶液在6 h内稳定、可重复性好。
1.2.7 配伍稳定性考察 模拟临床用药浓度, 精密称取注射用头孢孟多酯钠1 g、奥美拉唑钠42.6 mg, 加0.9%氯化钠溶液稀释制成10 mg/ml和0.4 mg/ml的溶液, 按1∶1比例混合, 避光条件下分别静置于4、25、30℃环境中, 0、2、4、6 h时观察外观变化及有无可见异物, 测定pH值及不同时间点的相对含量。
2 结果
2.1 外观变化 避光条件下4℃放置6 h, 配伍液均为澄明液体, 无沉淀及气泡产生;25、30℃放置10 min左右颜色逐渐加深变为黄色, 1 h时为淡咖啡色, 放置6 h颜色无消退,期间有少许沉淀物析出。
2.2 pH值变化 不同温度条件下, 不同时间内pH值有一定变化。见表1。
2.3 相对含量变化 温度越高、时间越长, 头孢孟多酯钠和奥美拉唑钠的相对含量越低。见表2。

表1 不同时间点和温度时配伍液pH值变化
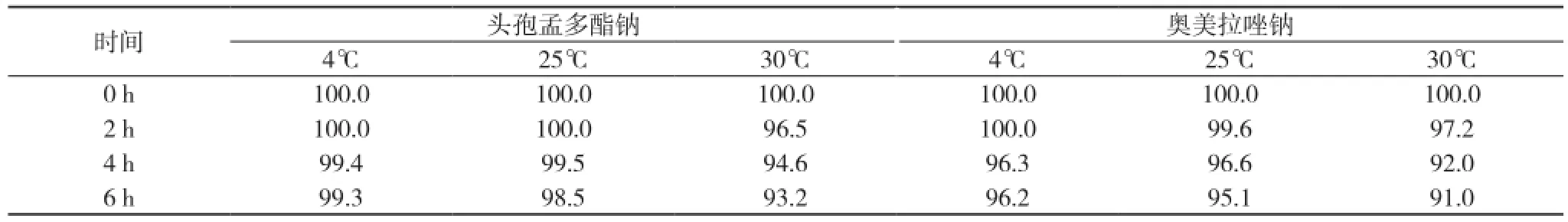
表2 不同时间点和温度时配伍液相对含量的变化(%)
3 讨论
本实验发现:避光条件下, 4℃条件下6 h内头孢孟多酯钠与奥美拉唑钠配伍液各指标均未发生明显变化。但在室温条件(25、30℃)下, 随着时间的延长、温度的升高, 配伍药液颜色、澄明度、药物成分相对含量及pH值均发生一定变化,且伴有少许沉淀物析出。表明两种注射药剂存在配伍禁忌。推测其原因, 可能在于头孢孟多酯钠的化学结构中有不稳定的β-内酰胺环, 遇酸、碱、热时易水解[5]。另一种药注射用奥美拉唑钠具有亚磺酰基苯并咪唑化学结构, 制备为钠盐成分, 呈弱碱性, 配伍液稳定性易受pH值、温度、金属离子等多种因素的影响。有报道指出, 奥美拉唑钠的稳定性与配伍药液pH值有显著正相关关系, pH值高, 稳定性较好,反之则降低, 遇酸性环境时, 奥美拉唑的化学结构极易发生破坏性变化, 从而出现临床报告指出的变色、沉淀析出现象[6]。
已有临床试验表明, 注射用奥美拉唑钠0.9%氯化钠注射液或5%葡萄糖注射液100 ml配伍, 稳定性指标均无明显改变, 6 h内观察均未见不溶性微粒, 因此, 可以推断注射用头孢孟多酯钠、奥美拉唑钠溶液配伍稳定性差与9%氯化钠注射液无关。另外, 由于注射用奥美拉唑钠处方中含有鳌合剂乙二胺四乙酸二钠(EDTA-2Na)[7], 因此可以排除金属离子影响奥美拉唑钠配伍溶液稳定性, 致奥美拉唑氧化变色的可能性。由此, 可以推断, 以上二药配伍溶液发生变色和沉淀析出的原理主要为:①注射用头孢孟多酯钠为酯类, 易水解, 加入氯化钠溶液时pH值降低, 呈酸性, 而奥美拉唑钠化学结构中磺酞基为弱碱性, pKa约4.0, pH值在9.0~10.0之间有较好的稳定性, 偏酸性条件下则会迅速降解, 从而导致溶解度变化和溶液变色[8]。②注射用奥美拉唑钠为钠盐成分,溶解度高(0.5 mg/ml), 而临床常用的最大浓度为40 mg/ml, 奥美拉唑钠溶液遇酸性环境如头孢孟多酯钠溶液后, pH值降低, 会生成游离的奥美拉唑, 在输液瓶中形成少量沉淀物。此外, 病室温度的升高则会加速上述反应的发生。
实验结果显示:为减少不良反应发生风险, 临床用药时应避免注射用奥美拉唑钠与酸性药物同用, 尽量单独使用,配伍头孢孟多酯钠等抗生素时, 宜间隔使用或加用0.9%氯化钠注射液进行冲管。
[1] 郑芳, 李聪, 黄麟杰, 等.HPLC-DAD考察头孢孟多酯钠与卡络磺钠在5%葡萄糖注射液和0.9%氯化钠注射液中的配伍稳定性.安徽医药, 2013, 17(8):1302-1304.
[2] 国家药典委员会.中国药典(二部).北京:中国医药科技出版社, 2010:639-640.
[3] 殷卫清, 唐叶秋, 陆敏, 等.卡络磺钠与头孢拉定等17种常用药物的配伍稳定性.抗感染药学, 2012, 9(2):145-147.
[4] 田洪霞, 陈倩, 王晓燕, 等.注射用美洛西林钠与奥硝唑注射液存在配伍禁忌.中国临床药理学杂志, 2012, 28(9):690-691.
[5] 张小敏.注射用头孢孟多酯钠与甲氧苄啶注射液存在配伍禁忌.护理实践与研究, 2011, 24(8):211.
[6] 陈艳伟, 贺军, 梁卉, 等.2013年6月大连医科大学附属第一医院注射用奥美拉唑钠的使用情况分析.现代药物与临床, 2014, 29(11):1297-1302.
[7] 陈奕伸, 梁嘉碧, 卓飞霞.注射用奥美拉唑钠常见配伍禁忌.北方药学, 2014, 11(5):90-91.
[8] 文晓红.注射用磷酸川芎嗪与注射用奥美拉唑钠存在配伍禁忌.西南国防医药, 2010, 20(7):770.
Incompatibility investigation between cefamandole nafate for injection and omeprazole sodium for injection
LI Min-ru.Department of Pharmacy, Dongguan City Zhongtang Hospital, Dongguan 523220, China
Objective To investigate the incompatibility between cefamandole nafate for injection and omeprazole sodium for injection.MethodsHigh performance liquid chromatography (HPLC) was applied to detect changes of external appearance, relative amount and pH of cefamandole nafate and omeprazole sodium in different time points during 6 h under 4, 25, and 30℃.ResultsAfter 6 h under indoor temperature (25 and 30℃), the solutions had obvious changes in external appearance, clarity, and pH.Contents of cefamandole nafate and omeprazole sodium were remarkably decreased.ConclusionCefamandole nafate for injection is incompatible with omeprazole sodium for injection, and they should be applied separately.
Cefamandole nafate; Omeprazole sodium; Incompatibility
10.14163/j.cnki.11-5547/r.2015.14.011
2015-01-04]
523220 东莞市中堂医院药剂科
