基因工程鸡α—干扰素纯化制品在鸡体内的消长规律
2015-05-30赵风立刘光晓姜德仟杨静王俊超于静静林娜
赵风立 刘光晓 姜德仟 杨静 王俊超 于静静 林娜

中图分类号:S859.79+7 文献标识码:B 文章编号:1673-1085(2015)05-0043-03
干扰素(interferon,IFN)是一类具有广泛生物学活性的蛋白质,具有调节机体免疫功能、抗病毒、抗肿瘤等多种作用,是机体防御系统的重要组成部分[1]。干扰素是在特定的诱导剂作用下,由细胞产生的一种具有高度生物学活性的糖蛋白,当它再作用于其他细胞时,使其它细胞立即获得抗病毒和抗肿瘤等多方面的免疫力[2]。α-干扰素是单核细胞产生的相对分子量18000的多肽,因其蛋白质分子的变异及肽链23位和34位氨基酸序列的组分不同,又可分为α2a、α2b、α2c等[3]。干扰素的活力具有相对的种属特异性,α-干扰素具有广谱的抗病毒活性,对DNA病毒和RNA病毒均有抑制作用[4]。
在干扰素研究中,不论在理论和实践上均有许多问题有待进一步探讨。而当前国内对基因工程重组干扰素在动物体内的消长规律尚未见报道,因此我们开展了基因工程鸡α-干扰素纯化制品在鸡体内的消长规律实验,结果显示,注射1倍剂量的鸡α-干扰素后8h后达到峰值;2、4、6、8和12h肉仔鸡内源性α-干扰素含量显著高于注射前、注射后0.5、1、48、96h和168h内源性α-干扰素含量(P<0.05)。
1 材料与方法
1.1 材料
1.1.1 试验动物 20只32日龄健康AA肉仔鸡,购自莱阳春雪集团。
1.1.2 药品与试剂 鸡α-干扰素注射液由青岛汇丰动物保健品有限公司提供(40MU/瓶×4ml);鸡α-干扰素检测试剂盒由BPB Biomedicals,Inc提供,批号70621S。Penta-His HRP Conjugate Kit、Tetra-His HRP Conjugate Kit由QIAGEN公司提供。
1.1.3 仪器设备 台式高速离心机(U.S.A)、水浴恒温摇床(U.S.A)、ZW-A微量振荡器(江苏亿通)、ELX800酶联免疫检测仪(U.S.A.)。
1.2 方法
1.2.1 试验动物处理 选择20只32日龄健康AA肉仔鸡,肌肉注射1个剂量鸡α-干扰素,试验期为7d。
分别在肌肉注射鸡α-干扰素注射液前、注射后0.5、1、2、4、6、8、12、24、48、96、168h时每次随机取4只受试鸡,心脏采血分离血清,用BPB Biomedicals,Inc生产的试剂盒进行测定内源性鸡α-干扰素,用Penta-His HRP Conjugate Kit测定外源性基因鸡α-干扰素。
1.2.2 鸡内源性α-干扰素含量的测定 试验步骤:①取出酶标板,依照次序对应分别加入100μl的标准品于空白微孔中;②分别标记样品编号,加入100μl样品于空白微孔中;③在标准品孔和样品孔中加入50μl的酶标记溶液;④18~25℃孵育反应90min;⑤洗涤液洗5次,每孔250μl,每次静置10~20s;⑥每孔加入底物A、B液各50μl;⑦18~25℃下避光孵育反应15min;⑧每孔加入50μl终止液,终止反应。
由标准品做标准曲线后求出方程,把样品OD450nm值代入方程求值。
1.2.3 基因工程鸡α-干扰素含量的测定 试验步骤:①取出酶标板,将被测血清和对照样品用pH10.6的碳酸盐缓冲液依次倍比稀释后依照次序分别加入相应的孔中,200μl/孔,4℃包被过夜;②PBS(pH7.2)洗4次,每孔200μl,每次10~60s;③在每样品孔中加入250μl Blocking buffer;④室温(20~25℃)置摇床2h;⑤PBS(pH7.2)洗4次,每孔200μl,每次10~60s;⑥每孔加入PBS/BSA稀释的Penta-His HRP各200μl;⑦室温(20~25℃)孵育2h;⑧PBS(pH7.2)洗4次,每孔200μl,每次10~60s;⑨每孔加入200μl底物溶液,在室温(20~25℃)下避光孵育反应15min;⑩测定OD值:反应结束后每孔加入50μl终止液,终止反应后在492nm波长测定各反应孔的OD值,记录结果。
2 结果
2.1 注射鸡α-干扰素对肉仔鸡内源性α-干扰素含量的影响 结果显示,注射1倍剂量的鸡α-干扰素8h后达到峰值;2、4、6、8h和12h肉仔鸡内源性α-干扰素含量显著高于注射前,以及注射后0.5、1、48、96h和168h内源性α-干扰素含量(P<0.05),见表1。
2.2 基因工程鸡α-干扰素含量的测定
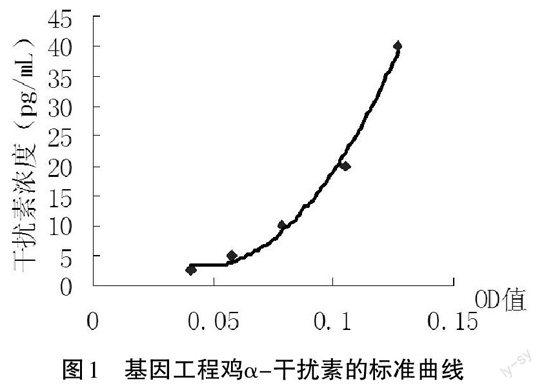
2.2.1 标准曲线的制备 将基因工程鸡α-干扰素做不同浓度的稀释,按照1.2.3中描述的方法测定不同干扰素浓度下对应的OD值,以OD值为横坐标(x),以干扰素浓度(y)为纵坐标回归,建立回归方程为y=5525.9x2-513.28x+15.106,r2=0.9911,如图1所示。可以看出干扰素浓度在0.05-0.15时,基本呈线性关系。
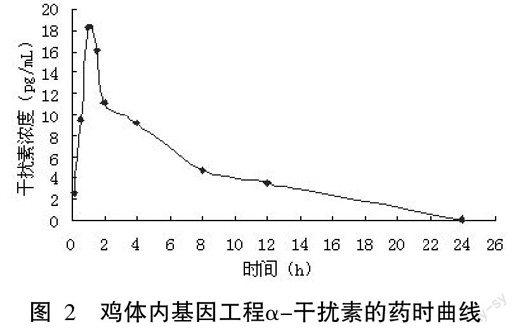
2.2.2 基因工程鸡α-干扰素的药时曲线 给鸡肌肉注射基因工程鸡α-干扰素后血药浓度如图2所示。可以看出在2h血药浓度达到峰值,之后逐渐减低,在24h降为零。
2.2.3 基因工程鸡α-干扰素的药动学参数 基因工程鸡α-干扰素药动学数据经中国药理学会推荐的3p97软件处理,分别用单室、双室、三室模型按最好二乘法进行拟合后,基因工程鸡α-干扰素鸡体内的代谢过符合一室开放模型,权重为1/C2。
基因工程鸡α-干扰素的药动学参数如表2所示。
3 讨论
本试验中由于没有合适的试验盒来区分内源性的天然鸡IFN-α和外源性的重组鸡IFN-α,因此我们采用了分别检测内源性的天然鸡IFN-α和外源性的重组鸡IFN-α来进行对比,在研究外源性的重组鸡IFN-α对内源性的天然鸡IFN-α的影响的同时探讨外源性的重组鸡IFN-α在体内的代谢规律。此次试验表明,血清中的内源性的鸡IFN-α在im(肌肉注射)注射重组鸡IFN-α后也发生变化,表现在im注射重组鸡IFN-α后8h达到峰值,在12h时可检测的干扰素浓度开始缓慢降低,约在4d后降低到使用前水平;而对血清中外源性重组鸡IFN-α使用表达标签6-His tag的抗体进行检测,结果表明外源性重组鸡IFN-α在im注射后约1~2h时达到较高的浓度,之后血清中的浓度逐渐降低,在注射后8h后血清水平降低至检测限度以下(Penta-His HRP Conjugate Kit检测范围≥10pg),因此根据OD值计算的外源性重组鸡IFN-α可能会存在较大的误差,需要建立更敏感的检测方法来对外源性重组鸡IFN-α的消长规律,并在高峰期缩小采血间隔以获得标准的药代曲线。
参考文献:
[1]梁斌.国内动物干扰素的研究进展[J].综述与专论,2005,35,(2):39-42.
[2] 连京华,李玉峰,高广尧,等.兽用干扰素的研究进展[J].山东农业科学,2005,1:78-80.
[3] 吴皓,陈丽芳.干扰素的研究进展[J].河南农业科学,2004,12:77-79.
[4] 陈新谦,金有豫,汤光.新编药物学[M].第15版.北京:人民卫生出版社,2003.695.
[5] 杨汉春.兽医免疫学[M].第3版.北京:中国农业出版社,2003,11.
