从人工合成胰岛素到蛋白质折叠研究
2015-05-30王志珍
王志珍
每个科学家的工作必定是站在前人的肩膀上,再向上去攀登新的高峰。作者的研究主要涉及“蛋白质折叠问题”,许多思想火花和实验设计直接或间接地源于“胰岛素人工全合成”的“肩膀”。此文与读者分享对蛋白质折叠问题的认识,介绍中国科学家对蛋白质折叠问题研究的贡献,并以此纪念我国科学家成功地人工全合成结晶牛胰岛素50周年。
蛋白质科学发展至今,大概可分为三个阶段。由于前期层析技术的发明得以提供纯蛋白,使胰岛素一级序列测定,肌红蛋白和血红蛋白的三维结构测定在1950年代取得成功,蛋白质科学的发展进入到第一个黄金时代。伴随“基因时代”DNA重组技术的出现,得以制备各种突变蛋白,1980年代分子生物学的发展把蛋白质科学推向第二个黄金时代。21世纪进入后基因组时代,作为生命活动主要承担者的蛋白质的研究,又开创了一个辉煌局面,成为她在生命科学发展史上的第三个黄金时代。
蛋白质折叠问题
“蛋白质折叠(protein folding)”可归于分子生物学中心法则中的科学问题,也就是说遗传信息如何从一维的氨基酸序列,传递到三维的功能蛋白质分子。应该说这是蛋白质科学中至今还没有解决的问题。20世纪五六十年代,美国国立卫生研究院的安芬森(C.B.Anfinsen)从牛胰核糖核酸酶A的氨基酸序列与生物活性、构象之间关系的系统研究中得到著名的安芬森命题:蛋白质肽链的氨基酸序列含有该蛋白三维结构的全部信息。也就是常说的“蛋白质一级结构决定高级结构”,从而开拓了“蛋白质折叠”的新领域,其指导“蛋白质折叠”研究的经典原理为“自发自组装原理(spon-taneous self-assembly principle)”,即“细胞中新合成的多肽链不需要其他分子帮助,也不需要进一步耗能,就可以获得其功能结构”。
1972年安芬森在斯德哥尔摩接受诺贝尔化学奖的演讲中谈到,他们的成功受到以往工作的影响,早在1930年代和1950年代,就有许多科学家观察到蛋白质变性的可逆性,这种自然选择的真谛是通过还原变性核糖核酸酶的重新氧化折叠和复性的研究认识到的。
说到蛋白质变性,必须提到为国际科学界所肯定的中国科学家的杰出贡献。1999年,库珀(A.Cooper)为纪念安芬森而撰写的文章《蛋白质折叠和稳定性的热力学》中指出:“蛋白质折叠早期的杰出研究,特别是吴宪、安芬森、谢拉加(H.A.Scheraga)、埃兹尔(J.T.Ed-sail)等的工作奠定了现代蛋白质折叠的基础。”
1995年笔者在德国格丁根大学做访问研究时,在蛋白质研究的权威性综述刊物Advances in ProteinChemistry第46卷上读到蛋白质研究的老前辈、美国哈佛大学的埃兹尔教授的文章《吴宪与第一个蛋白质变性理论》,对吴宪教授的学术成就给予了极高的评价。同时还全文刊登了吴宪教授在1931年用英文发表的关于蛋白质变性的论文[Study on Denaturation ofProteins.XⅢ.A Theory of Denaturation.Chinese Journalof Physiology,1931,5(4):321-344]。把一篇1931年在中国学术杂志上发表的论文,在64年后重新刊登在国际一流的学术刊物上,体现了此文的重要性。
在北平协和医学院生物化学系工作的吴宪教授,1920年就开始关于蛋白质变性的研究,到1931年共发表16篇论文。他在1929年第13届国际生理学大会上首次提出蛋白质变性理论:“天然蛋白质之分子,因环境种种之关系,从有程序而坚密之构造,变为无程序而散漫之构造,是为变性作用。”即使说安芬森提到了米尔斯基(A.Mirsky)早期的蛋白质变性工作的重要性,米尔斯基的蛋白质变性理论实际上也与吴宪的变性理论非常类似,但比吴宪晚了5年才发表在《美国科学院院报》上。应该指出,在1931年,蛋白质的肽键结构尚未被普遍接受,最早的蛋白质结晶也刚刚完成,吴宪提出的蛋白质变性理论,在思想上是超前于他所处的时代的。这就是为什么他的理论在世界范围内被广泛接受、论文在半个多世纪后仍值得重新发表的原因。虽然科学术语和中国文字的用法70年来已经有了很大的变化,但今天用吴宪1931年论文摘要的原文来概括蛋白质的变性作用还是那样合适。吴宪的变性理论仍然是当前国际上蛋白质变性和蛋白质折叠研究的基础,所以,蛋白质变性理论是中国科学家的首创。
1993年在沈阳召开的第六届中国生化学会代表大会暨第七次全国生化学术会议上,邹承鲁教授建议组织“纪念吴宪的蛋白质变性理论”专题讨论会,邀请了吴宪之子吴瑞教授出席并做报告。吴教授在DNA测序方面做出过先导性的工作,并在中国改革开放后,发起并创办生命科学领域最早的公派留学项目(CUSBEA),为促进中国学生赴美留学事业做出了重大贡献。
1970年代末,英国的拉斯基(Ron Laskey)在进行体外组蛋白和DNA重组研究时,发现必须要有一种细胞核内的酸性蛋白“核质蛋白(nucleoplasmin)”存在。两者才能组装成核小体,否则就发生沉淀。这里的核质蛋白并不提供组装的空间信息,也不是最终形成的核小体的组分,但它与组蛋白结合后,可屏蔽其正电荷,防止与DNA形成沉淀,从而促进两者正确装配。拉斯基给这个酸性蛋白起了个十分新颖的名字“分子伴侣(molecular chaperone)”,把一个社会学的名词chaperon赋予了具有新性质的蛋白质分子,既形象又贴切。
1980年,英国华威大学(University of Warwick)的埃利斯(R.J.Ellis)在研究高等植物叶绿体中的核酮糖1,5-二磷酸羧化酶一加氧酶(1,5-bisphosphate car-boxylase-oxygenase,Rubisco)时,发现在叶绿体中合成的八个大亚基必须先与一种蛋白质结合后,才能与在细胞质中合成的8个小亚基在叶绿体内组装成有活性的Rubisco酶分子。Rubisco是地球上极其古老的一种酶(已存在22亿~35亿年),它催化植物的光合作用反应,即利用二氧化碳和水合成有机物,是地球上最重要、最大量但效率最低的酶。遗憾的是,因为受蛋白质自组装的观念影响太深,这些新发现没有引起足够的重视。1986年,埃利斯在英国皇家学会组织的一次专门讨论关于Rubisco的会上,提出这个Rubisco结合蛋白可能是核质蛋白之后的第二个分子伴侣,但他还是担心这不过是两个特例,因为被它们结合的蛋白质在体外太容易聚集了。同年,英国的佩勒姆(H.R.Pel-ham)讨论了热休克蛋白70和热休克蛋白90在蛋白质组装和解组装中的作用。尽管佩勒姆没有直接用“分子伴侣”这个名词,但埃利斯说,正是佩勒姆的工作促使他整合了自己的思路。1987年在哥本哈根召开的一次研讨会(The NATO Advanced Study Meeting)上,在《自然》周刊参会代表的说服下,埃利斯正式提出“分子伴侣”的科学概念,即“一类在序列上没有相关性但有共同功能的蛋白质,它们在细胞内帮助其他含多肽的结构完成正确的组装,但它们不是组装完成的结构在发挥其正常生物功能时的组成成分。”。此后20多年中,埃利斯不断发表文章,深入讨论和完善“分子伴侣”的定义和性质:“一大类不同的蛋白质,有共同性质,即帮助其他大分子结构的非共价折叠、解折叠,组装、解组装,但不是这些结构在发挥其正常生物功能时的永久组成成分。”“分子伴侣”是蛋白质一种新的功能的鉴定,它的发现更新了蛋白质折叠的概念,导致蛋白质折叠的原则发生深刻转变,从经典的“自发的自组装(spontaneous self-assembly)”发展到“有帮助的自组装(assisted serf-assembly)”。
安芬森原理揭示了蛋白质的氨基酸序列包含肽链正确折叠所需要的全部信息,决定了蛋白质分子在热力学上稳定的空间结构,但没有包含动力学问题在内的蛋白质折叠的全部问题。安芬森在美国国立卫生研究院的同事谢克特(A.N.Schechter)1995年为安芬森写的悼文中说:“安芬森的内心更钟爱热力学的研究方法,虽然他在热力学和动力学两方面实验中都极其活跃。”新生肽折叠和变性蛋白的重折叠需要帮助的新概念与安芬森原理并不矛盾,而正是在动力学的意义上,发展、加深和完善了蛋白质折叠学说。用我们熟悉的语言来说,如果一级结构是肽链折叠形成特定三维结构并获得生物学活性的内因,且是第一位因素,那么可以认为分子伴侣是肽链正确折叠的外因,是条件,外因需要通过内因起作用。但如果没有适当的充分的条件,多肽链可能发生错误折叠,如果又逃逸了质量控制(quality control)机制,就不能正确折叠成为活性蛋白质,而可能形成聚集,甚至导致疾病发生。近30年来,对分子伴侣在生命活动中的重要性的认识日益深入,尤其体现在内质网蛋白质质量控制和未折叠蛋白反应(unfolded protein response,UPR)。通过蛋白质质量控制以维持内质网平衡,而逃逸蛋白质质量控制会引起内质网应激,可能造成许多疾病,如神经退行性疾病、糖尿病、高血压、心血管疾病、肿瘤、白血病,以及衰老等。
人工全合成胰岛素中的蛋白质折叠问题
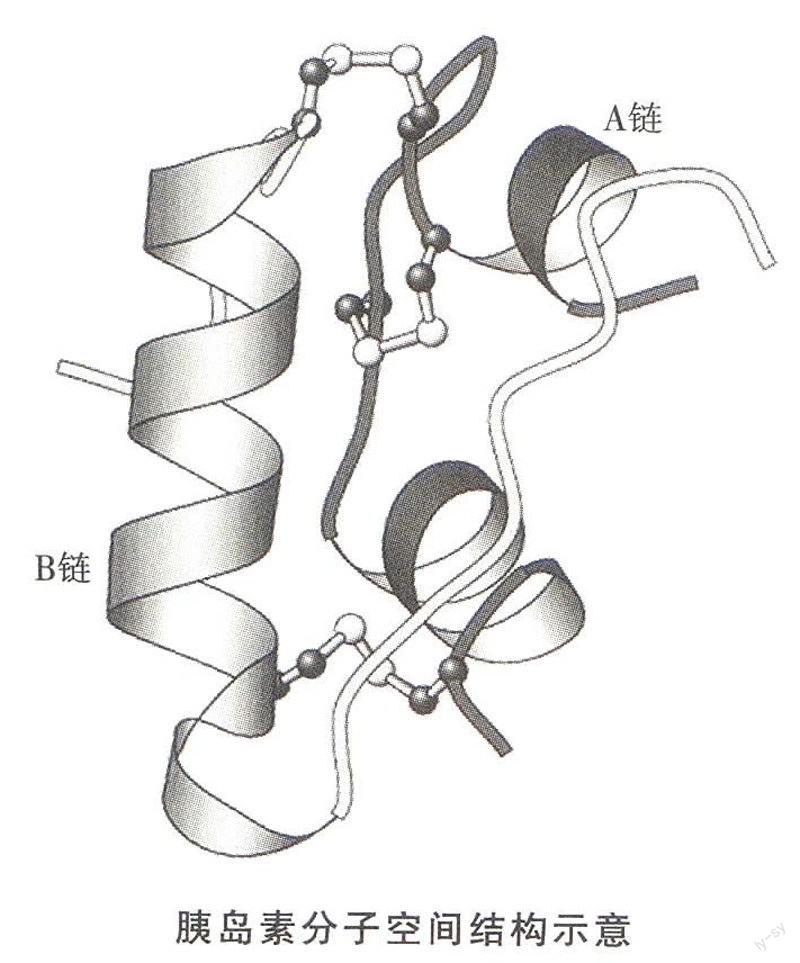
1958年“大跃进”时期,中国科学家提出要“合成蛋白质”。这无疑是真正意义上的“原始创新”的科学狂想。不到10年,在1965年国际上首先成功地人工全合成了具有全部生物活性的结晶牛胰岛素!虽然当时由9个氨基酸残基组成的小肽的人工全合成工作已得过诺贝尔奖,但由两条肽链共51个氨基酸残基组成,并含有一个链内二硫键和两个链间二硫键的胰岛素蛋白分子的合成则复杂得多。
首先必须解决合成路线的问题。中国科学院上海生物化学所的邹承鲁先生带领杜雨苍、许根俊等青年科学家承担胰岛素拆合的工作在1959年即获得成功,重组胰岛素的活力恢复达到了10%,但由于德国察恩(H.Zahn)和美国卡措扬尼斯(P.G.Katsoyannis)两个研究小组也在进行胰岛素合成的研究,很自然这个结果必须保密。同时也由于当时中国所有的学术刊物都被迫停刊。他们的结果当然也不可能及时发表。一直到1960年狄克逊(G.H Dixon)和沃德洛(A.C.Wardlaw)在《自然》周刊上报道还原的胰岛素A和B链共同氧化得到1%-2%的胰岛素活力恢复之后,中国科学家才于1961年在《生物化学与生物物理学报》发表活力恢复达到10%的结果。以后他们又不断改善重组条件,使活力恢复达到以B链计算的30%,保证化学合成的A链和B链以高产率重组成活性胰岛素分子。1970年代礼来(Eli Lilly)公司生产第一代DNA重组胰岛素所采用的条件与中国研究组发表的重组条件十分相似,说明中国科学家的工作经得起实践考验。
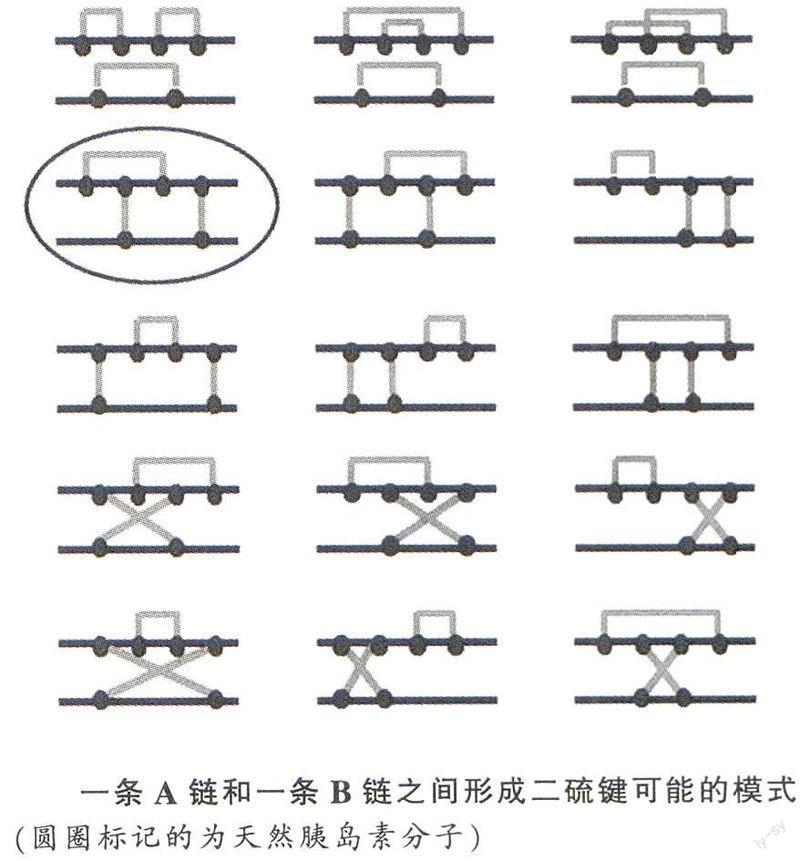
从科学的意义上讲,胰岛素人工全合成绝不仅仅只是多肽合成的问题,它包含了一个崭新的、重要的蛋白质折叠问题,也就是A、B两条肽链能否在溶液中氧化生成三个正确的二硫键,从而折叠成有天然构象的活性蛋白分子。只有解决这个蛋白质折叠的问题,才能合成有全部生物活性的胰岛素分子。实际上胰岛素A和B链重组问题与安芬森将4个二硫键全部还原的变性的核糖核酸酶肽链重新氧化、折叠恢复活力的工作几乎是同时完成的。核糖核酸酶只有一条肽链,其8个巯基的所有组合方式亦仅有105种可能性;而胰岛素则是由两条肽链组成,即使溶液中仅有一条A链和一条B链。二硫键可能的形成模式就有15种;两条肽链可能以不同的比例与方式组合,所以其6个巯基所有的可能组合方式实际上是无穷多的,但其中只有一种天然构象具有活性。可见与单肽链的核糖核酸酶相比,胰岛素的复性问题要复杂得多得多。中国小组所得到10%的活力恢复的结果,在本质上远远超过二硫键随机配对的概率,这使得他们当时就提出了“天然胰岛素分子是所有各种从A链与B链可能形成的分子中最稳定的结构”的重要结论,这无疑是对蛋白质折叠问题的重大贡献。不幸的是,由于此工作的任务导向性加上“文革”的种种干扰,胰岛素人工合成工作中初放的蛋白质折叠问题的硕大蓓蕾没能及时绽放。
直到1970年代末,全国科学大会召开,郭沫若热情洋溢的来信宣布“科学的春天”来到了!胰岛素拆合成功的基础研究才在北京的生物物理所扬帆启航,笔者也有幸参与了邹承鲁先生领导的“胰岛素A、B链相互作用的研究”,运用各种生物物理方法研究溶液中胰岛素A、B链和各种化学修饰的A、B链在不同的溶液条件下的相互作用。我们从牛肝里提取纯化了蛋白质二硫键异构酶,研究它催化A、B链生成天然胰岛素的作用。10年的工作总结出胰岛素分子折叠的观点:“胰岛素A、B链本身已具有一定的结构,含有形成天然胰岛素正确结构的全部信息,能在溶液中相互识别和相互作用,从而导致3个二硫键正确配对,形成结构最稳定的天然胰岛素分子”,阐明了从人工化学合成的胰岛素A、B链生成天然胰岛素分子的蛋白质折叠规律,揭示了人工合成胰岛素中A、B链重组成功的理论基础。
从胰岛素到蛋白质折叠
改革开放后,国家更加重视和支持基础性科学研究。从1989年开始,经科学界认真讨论,遴选30个国家基础性研究重大国家课题构成“攀登计划”的首批项目。其中,邹承鲁先生承担了“新生肽链及蛋白质折叠的研究”,笔者有幸承担子课题“帮助蛋白质折叠的生物大分子——分子伴侣和折叠酶”。
在当时,折叠酶和分子伴侣被定义为两种性质和作用机制不同的帮助蛋白。在运用蛋白质二硫键异构酶催化胰岛素A、B链生成天然分子的研究基础上,根据对分子伴侣新概念的认识,我们提出:蛋白质二硫键异构酶在新生肽链折叠中的作用,是否仅限于通过二硫键交换促进新生肽链的折叠;作为在内质网管腔中的一种含量丰富的蛋白质,又具有特异性不强的可广泛与多肽结合的能力,似乎已具备分子伴侣的必需条件,是否还可能在新生肽链折叠中起着更为普遍的分子伴侣的作用。我们提出了“蛋白质二硫键异构酶既是酶又是分子伴侣”的假说,向《美国实验生物学会联合会杂志》(FASEB J)投稿。在文章评审期间,又看到埃利斯在他的论文中明确指出:“蛋白质二硫键异构酶不是分子伴侣”。我们受到极大挑战,别无选择,只有尽快提供实验证据来支持、证明自己的观点,所幸我们的假说文章在当年年底发表,这对我们是极大的鼓励。
由于二硫键的形成与肽链的折叠是两个密切关联又互相影响的过程,要证明蛋白质二硫键异构酶固有的分子伴侣活性,首先必需把它与其异构酶活性区分开。为此,我们选用不含二硫键的蛋白做底物蛋白,监测蛋白质二硫键异构酶对变性底物蛋白在迅速稀释复性过程中的聚合和复性效率的影响,以及对底物在变性过程中聚合的影响。结果表明,蛋白质二硫键异构酶的作用符合分子伴侣性质的全部指标。由于底物蛋白不含二硫键,蛋白质二硫键异构酶对它们复性的帮助和促进作用,以及对变性过程中聚合的抑制作用,也就与它的二硫键异构酶的活力没有关系,只能归结于它的分子伴侣活性,所以蛋白质二硫键异构酶确实具有其固有的、与其异构酶活力相独立的分子伴侣活力。
接着,我们研究这两个活性的结构基础。蛋白质二硫键异构酶分子有两个含有CGHC-序列的催化部位和至少一个多肽结合部位。当时的文献认为,酶的催化部位也是其分子伴侣活力所必需的,但我们认为他们用的实验方法在含二硫键的靶蛋白上是不能区分蛋白质二硫键异构酶的两个活力的,因此怀疑此结论。我们用化学修饰方法封闭催化部位——半胱氨酸的巯基,导致蛋白质二硫键异构酶失活,发现这种丧失异构酶活力的蛋白质二硫键异构酶具有与天然蛋白质二硫键异构酶几乎完全相同的分子伴侣作用。于是,我们认识到蛋白质二硫键异构酶的分子伴侣活力是不依赖于酶的-CGHC-催化部位的。
进一步,我们又证明了多肽结合部位是蛋白质二硫键异构酶具有两种活性所必需的。我们的化学修饰酶使我们为冲击更加重要的、国际上尚未解决的关键问题,即在生理底物上区分蛋白质二硫键异构酶的两种生物活性产生了灵感。蛇毒蛋白专家周元聪教授慷慨地为我们提供了蛇毒的酸性磷酸酯酶A2,该蛋白只有124个残基,却有7个二硫键,完全符合生理底物的要求。我们设计的一整套实验的结果表明,催化量的天然酶(只起到酶的催化作用)只能使磷酸酯酶的复性从5%增加到15%,化学计量(分子伴侣发挥作用的条件)的天然酶帮助复性到45%,而化学计量的化学修饰酶(只有分子伴侣活性)不起任何作用。令我们兴奋的是,催化量的天然酶和化学计量的化学修饰酶共同存在时,则使磷酸酯酶的复性提高到化学计量的天然酶帮助复性的45%水平。这个结果指出,绝大部分的天然酶是可以被仅有分子伴侣活性、但丧失异构酶活性的化学修饰酶所替代,所以绝大部分的天然酶实际上是在发挥分子伴侣活性。我们得出的结论是:蛋白质二硫键异构酶的二硫键异构酶和分子伴侣两种活性协同作用,才能使它发挥帮助肽链折叠和催化二硫键形成的作用,即催化蛋白质氧化折叠的功能是由异构酶和分子伴侣两种活性共同承担协同完成的。单独的异构酶活性或单独的分子伴侣活性,都不足以行使催化蛋白质氧化折叠的功能。国际同行评价该工作“成功地区分了蛋白质二硫键异构酶的异构酶和分子伴侣两种活性”,我们的假说得到认可。令人欣慰的是,“分子伴侣”概念的提出者埃利斯,当年认为蛋白质二硫键异构酶不是分子伴侣。但在1997年和2013年发表的综述中都把蛋白质二硫键异构酶列入了分子伴侣的名单。
最近,我们又解析出人们等待了半个世纪的人源蛋白质二硫键异构酶的三维结构,揭示了它作为氧化还原调控的分子伴侣的结构基础和作用机制。更重要的是,近年来蛋白质二硫键异构酶作为分子伴侣的生物学功能,已在越来越多的生理和病理活动中被揭示。人们正在向着探讨内质网中蛋白质平衡、氧化还原平衡与衰老和各种疾病关系的新方向迈进。
关键词:蛋白质折叠 分子伴侣 人工全合成胰岛素 蛋白质二硫键异构酶