转录因子活化蛋白-2在颞叶癫痫模型小鼠海马的表达变化
2015-05-29赵旭东
李 艳 赵旭东
(重庆医科大学中医药学院,重庆 401331)
颞叶内侧癫痫(MTLE)是指颞叶内侧海马病变导致的癫痫(EP),临床主要表现为复杂部分性发作,病理以海马硬化为典型特征。目前,EP的发病机制尚不清楚〔1〕。在EP动物模型中存在明显神经细胞凋亡现象,神经细胞凋亡可能是EP重要发病机制〔2〕。然而,EP神经细胞凋亡原因尚不清楚。研究表明,转录因子活化蛋白-2(AP-2)对调节细胞凋亡具有重要作用〔3,4〕。AP-2表达对细胞生存具有双重作用,其过低或过高表达都可引起细胞凋亡。因此,我们推测EP发病可能与AP-2异常表达从而进一步引发细胞凋亡相关。本实验观察了海人酸(KA)侧脑室注射诱导的EP小鼠海马AP-2表达,对AP-2在EP发病机制中所起作用进行初步探讨。
1 材料和方法
1.1 材料 C57BL/6小鼠(32只),健康雄性,体重22~25 g。在温暖(20~24℃),相对湿度40% ~70%,自由进食和饮水。随机将实验动物分为模型组和对照组两组。模型组再按照不同处死时间分为造模后3 h、8 h、24 h,每组8只。KA(Sigma公司),兔抗小鼠AP-2抗体(AP-2;Santa Cruz公司),生物素化山羊抗兔二抗(博士德公司),脑立体定向注射仪(深圳瑞沃德有限公司)。
1.2 方法
1.2.1 制备EP模型 首先使用水合氯醛(3.6%,360 mg/kg)腹腔注射,小鼠麻醉后固定小鼠头部于立体定向仪。去毛、消毒,切开头皮以使前囟暴露。根据小鼠脑立体定向图谱在相应部位(前囟后0.4 mm,右侧旁开1.3 mm)钻一圆孔直径为1.0 mm,深度达硬脑膜表面。通过微量进样器,注入1μl KA(0.1μg/μl),4 min内匀速注射完,然后留针4 min后用骨蜡封闭颅骨钻孔,缝合小鼠皮层,后进行EP行为学观察。依据Racine分级〔5〕判断EP发作程度,Ⅲ级以上为成功动物模型。而对照组则采用等体积生理盐水代替KA进行侧脑室注射,操作方法相同。手术后3 h、8 h、24 h进行取材。
1.2.2 RT-PCR方法检测AP-2 mRNA表达 小鼠手术后3 h、8 h、24 h分别断头取出脑组织,分离出海马,使用Trizol法(Trizol试剂盒,天根公司),提取组织细胞总RNA,紫外分光光度法定量后,按照逆转录试剂盒说明,反转录条件:42℃ 10 min,30℃ 20 min,99℃ 5 min,4℃ 4 min。以引物设计软件 Primer Premier5.0设计AP-2、内参GAPDH,由上海生工生物公司合成。AP-2上游引物:5'ACTATCGGCGGCACGAGGAC 3';AP-2下游引物:5'TGGCGTGAGGTAAGGAGTGG 3';扩增片段为90 bp;GAPDH上游引物:5'TGCCCAGAACATCATCCC 3';GAPDH上游引物:5'AAGTCGCAGGAGACAACC 3';扩增片段为252 bp;PCR循环条件为:94℃ 预变性2 min,94℃ 变性30 s,60℃退火30 s,取5μl样品,1%琼脂糖凝胶电泳检测回收结果。1μl DNA样本作为PCR扩增模板,阴性对照扩增模板为去离子水;扩增条件为95℃预变性2 min;随后95℃ 15 s,退火温度15 s,72℃延伸40 s,共35个循环;最后 72℃延伸5 min。使用加权计算结果进行灰度值对比。
1.2.3 Western印迹检测AP-2蛋白表达情况 小鼠手术后分别于3 h、8 h、24 h断头取出脑组织,分离出海马组织,将海马组织冲洗干净并且置于2 ml的匀浆器中预先加入1 ml蛋白提取缓冲液、蛋白酶抑制剂cocktail(Roche),冰上研磨,收集研出液。放在冰上孵育15 min以后,置于4℃离心机、离心10 min,吸取上清并分装,放置在-80℃中保存。将蛋白样本和5×SDS上样液充分混合后,100℃煮沸7 min,冷却后加入上样孔(20μl/孔),120 V 恒压电泳约 1.5 h,PVDF 膜转膜 100 mA,22 min、5%脱脂奶粉室温封闭2 h,加入一抗兔抗小鼠AP-2抗体(1∶1 000),4℃冰箱过夜,TBST清洗后,加入二抗辣根过氧化物酶标记(1∶4 000),室温孵育,2 h。TBST洗涤 PVDF膜,最后用化学发光试剂盒(碧云天)进行曝光。采用Bio-rad化学发光成像仪进行分析、采集。
1.2.4 免疫组化检测AP-2在海马表达水平 模型小鼠手术后分别于3 h、8 h、24 h断头取出脑组织,4%多聚甲醛缓冲液固定24 h后,用石蜡包埋,在视交叉前端大脑和背侧海马处连续切片,切片厚度为10μm。石蜡切片依次脱蜡、脱水、再加入3%过氧化氢10 min,PBS清洗、胰酶37℃硝化30 min,PBS清洗,BSA室温封闭30 min,甩去余液加入兔抗小鼠AP-2抗体单克隆抗体(Santa cruz,USA)(1∶100),4℃过夜。PBS 清洗、加入生物素化山羊抗兔二抗(博士德公司,SABC),37℃孵育40 min,滴加SABC37℃孵育40 min,DAB显色,室温5~10 min,用显微镜观察染色变化。判断染色结果标准采用选择相同区域、相同条件下用IMAGE软件进行光密度分析。
1.2.5 免疫荧光检测AP-2在海马神经元中的表达水平 取24 h小鼠模型,断头取出脑组织,用4%多聚甲醛液固定24 h,15%和30%蔗糖依次脱水3 h,在视交叉前端大脑和背侧海马处连续切片,切片厚10μm。加入5%山羊血清37℃,30 min后甩去血清,加入一抗是兔抗小鼠AP-2抗体单克隆抗体(1∶100,Santa Cruz,USA)和山羊抗小鼠 NeuN(1 ∶200,Millipore),4℃过夜。第2天分别使用CY5,FITC二抗(1∶100,北京中杉公司),37℃,40 min,再加入 DAPI,37℃,5 min,在激光共聚焦显微镜下进行观察与采图。
1.3 统计学方法 采用SPSS18.0软件包进行方差分析和相关分析。
2 结果
2.1 小鼠行为学观察结果 模型组小鼠侧脑室注射KA于3 h后明显出现反复发作的面部抽搐、身体背曲、肢体阵挛、阵发性旋转、尾部翘起、跌倒站立等EP发作表现。每次发作时间10余秒,呈间歇性反复发作状态。在8 h后逐渐恢复到正常状态,并且24 h仍有发作,主要以Ⅱ~Ⅲ级发作。对照组小鼠无上述EP发作的症状。
2.2 EP发作小鼠及对照组各时间RT-PCR检测AP-2 mRNA转录水平 图1显示,AP-2条带位于90 bp左右,与预期产物大小保持一致。术后3 h、8 h、24 h,EP小鼠海马AP-2表达具上升(0.459 8±0.025 59、0.845±0.025 91、0.675±0.03,P<0.05),其中术后8 h 时表达最高(0.255 6±0.027 57,P<0.01),术后24 h时趋于降低,但是仍高于对照组(P<0.05),见图1。

图1 RT-PCR检测基因AP-2在各组小鼠海马的表达
2.3 EP发作小鼠及对照组各时间点Western印迹检测AP-2蛋白表达 AP-2条带位于48 kD左右,和预期产物大小保持一致。术后癫痫小鼠分别在3 h、8 h、24 h海马组织 AP-2表达具上升(0.395 4±0.024、0.891±0.068、0.63±0.011,P<0.05),其中术后8 h时表达最高(P<0.01),术后24 h时趋于降低,但是仍高于对照组(0.154±0.011,P<0.05),见图2。
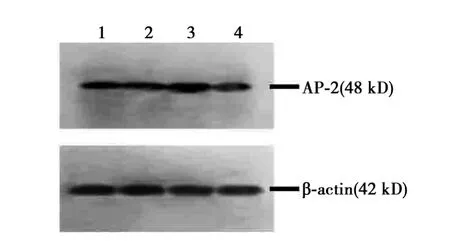
图2 Western印迹检测蛋白AP-2在各组小鼠海马的表达
2.4 EP发作小鼠以及对照组各时间点免疫组化检测AP-2在海马表达水平 在对照组海马中有较少棕黄色颗粒沉积,说明在正常海马细胞内AP-2表达较少,但是在模型组海马则有大量棕黄色颗粒沉积,因此AP-2在EP小鼠海马表达增加,AP-2主要表达主集中在海马CA1的区域,尤其是在手术8 h后海马组织有大片棕黄色颗粒沉积。免疫组化的结果证明AP-2在手术8 h后EP小鼠海马AP-2表达是最高。其余各时间点细胞形态未见明显差异。见图3。
2.5 EP发作小鼠及对照组各时间点免疫荧光检测AP-2在海马表达水平 免疫荧光组织染色结果发现,在海马CA3区中,AP-2在胞核中与胞质中均有表达,并且可以在NeuN(为神经元的特异标记物)中可见有共表达发生,说明海马神经元可以分泌AP-2蛋白。见图4。

图3 AP-2在各组小鼠海马CA1区的免疫组化表达(×400)

图4 AP-2与NeuN在EP24 h小鼠海马CA3区的共表达(×400)
3 讨论
由于EP发病机制目前尚不清楚,目前的抗EP药都是控制EP症状的发生,长期治疗效果不佳。有动物实验发现,短暂或持续的EP发作可导致脑内神经元凋亡和多种凋亡相关基因的表达,如凋亡调节蛋白、天冬氨酸特异性半胱氨酸蛋白酶(Caspases)家族成员等〔6〕。Akcali等〔7〕在颞叶 EP 动物模型海马CA1区检测到编码Bax、Bcl-2蛋白的mRNA呈异常表达;Lee等〔8〕在红藻氨酸盐诱导的EP模型海马神经元中发现了早期即刻基因的大量表达,如c-Jun、c-fos,并通过免疫组化定量分析,及用TUNEL检测细胞凋亡,证实早期即刻基因的表达与凋亡细胞数目呈正相关。然而,EP患者细胞凋亡发病机制目前尚不清楚。
AP-2转录因子是一种特殊序列的DNA结合蛋白,可以与诱导病毒和细胞增强元件相互作用,刺激基因有选择的表达。在哺乳动物中有4类AP-2基因被确定,它们是AP-2α、AP-2β、AP-2γ和AP-2δ,所有类型的AP-2都具有激活转录的能力,双向调节基因转录表达〔9〕。已知AP-2激活的基因有细胞周期抑制因子 p21,WAF/CIP、TGF2α、c2KIT、Ⅳ型胶原酶、SV40 增强、人类金属硫蛋白基因Ⅱa、ER、IGFBP 25、HER22/neu癌基因等。AP-2负性调节的基因,包括MCAM/MUC18、原癌基因c2Myc、c2EBP2α等〔9〕。AP-2通过调控这些基因的转录活动,影响细胞生命活动、细胞间稳态、胚胎发育等。
本实验说明AP-2高表达与EP发病可能具有密切关系。目前研究表明,许多介导细胞生长、形成和联系的基因,一般都具有AP-2结合位点和顺式调控序列〔10〕。AP-2表达异常可引发细胞凋亡,也可引发癌症等疾病。另外,AP-2还参与调节了乙酰胆碱酯酶、乙酰胆碱转移酶、烯醇化酶、突触蛋白、早老素2、脑啡肽原和儿茶酚胺合成酶等多种神经相关基因的调控〔11〕。因此,AP-2对神经细胞存活及神经系统功能具有重要作用。AP-2异常表达可能引发神经细胞凋亡,从而引发一系列神经系统症状。本文推测,EP患者AP-2表达上升,导致神经细胞凋亡,进一步诱发了EP发病。
1 Jones NC,Nguyen T,Corcoran NM,et al.Targeting hyperphosphorylated tau with sodium selenate suppresses seizures in rodent models〔J〕.Neurobiol Dis,2012;45(3):897-901.
2 Kim YS,Choi MY,Ryu JH,et al.Clusterin interaction with Bcl-xL is associated with seizure-induced neuronal death〔J〕.Epilepsy Res,2012;99(3):240-51.
3 Eckert D,Buhl S,Weber S,et al.The AP-2 family of transcription factors〔J〕.Genome Biol,2005;6(13):246.
4 Li X,Glubrecht DD,Godbout R.AP2 transcription factor induces apoptosis in retinoblastoma cells〔J〕.Genes Chromosomes Cancer,2010;49(9):819-30.
5 Racine RJ.Modification of seizure activity by electrical stimulationⅡ-motor seizure〔J〕.Electroencophaogr Clin Neurophysiol,1972;32(3):281-94.
6 Bengzon J,Mohapel P,Ekdahl CT,et al.Neuronal apoptosis after brief and prolonged seizures〔J〕.Prog Brain Res,2002;13(5):111-9.
7 Akcali KC,Sahiner M,Sahiner T.The role of bcl-2 family of genes during kindling〔J〕.Epilepsia,2005;46(2):217-23.
8 Lee MC,Rho JL,Kim MK,et al.c-JUN expression and apoptotic cell death in kainite-induced temporal lobe epilepsy〔J〕.J Korean Med Sci,2001;16(5):649-56.
9 Hilger-Eversheim K,Moser M,Schorle H,et al.Regulatory roles of AP-2 transcription factors in vertebrate development,apoptosis and cell-cycle control〔J〕.Gene,2000;260(1-2):1-12.
10 Xu GP,Van Bockstaele E,Reyes B,et al.Chronic morphine sensitizes the brain norepinephrine system to corticotropin-releasing factor and stress〔J〕.JNeurosci,2004;24(38):8193-7.
11 Coelho DJ,Sims DJ,Ruegg PJ,et al.Cell type-specific and sexually dimorphic expression of transcription factor AP-2 in the adult mouse brain〔J〕.Neuroscience,2005;134(3):907-19.
