竹笋壳生物转化木糖醇高产菌株的筛选
2015-05-22祝燕燕陈显群杨胜利
祝燕燕,陈显群,杨胜利
(1.浙江工业大学药学院,浙江 杭州 310014;2.温州市食品研究所,浙江 温州 325000)
木糖醇是一种五碳糖醇,甜度与蔗糖相当,同时木糖醇具有较宽的酸pH范围,玻璃化所需温度较低,具有较长时间的储藏和保存的较优性能[1]。木糖醇是所有食用糖醇中生理活性最好的品种,作为一种高效的功能性营养添加剂,它味甜低热,口感清凉,发热与葡萄糖等同[2]。根据文献报道,目前工业化生产低热量、无糖的多元醇甜味剂的需求正在与日俱增,其中木糖醇就是一种重要的替代品,具有优良的生理功能和广泛的应用价值[3]。
传统的木糖醇生产方法是采用化学催化加氢法,该法生产成本高,对环境污染严重[4]。生物转化法一直被认为是一条更为经济的工艺路线,因为发酵生产木糖醇无需木糖纯化步骤,还可以简化木糖醇的分离过程[5]。我国竹类资源十分丰富,全国毛竹林约为240万公顷。目前竹笋壳一般没有利用价值,农民都是任其腐烂。其实竹笋壳富含丰富的半纤维素,其含量为28.12%[6],用其生产木糖乃至木糖醇将是很好的原料,成本低廉。基于竹笋壳的成分和生物转化法的特点,我们以竹笋壳水解液作为木糖来源发酵生产木糖醇。
1 材料
1.1 菌种
土样来自浙江工业大学小竹林。用无菌小铲子除去表面的土壤,选取离地面5~15 cm处的土壤,小心放入清洁干净的样品袋中,密封好,记录采样的时间、地点以及环境条件。
挑取出现发霉状况的竹笋壳,将其放入粉碎机中粉碎,将碎粒小心放入清洁干净的样品袋中,密封好。
1.2 培养基
种子培养基(g/L):D-木糖 20,酵母膏 5,磷酸二氢钾2,二水氯化钙0.1,七水硫酸镁 0.2,硫酸铵 5,琼脂 20。
菌种保藏培养基(g/L):D-木糖 20,酵母膏 5,磷酸二氢钾2,二水氯化钙0.1,七水硫酸镁0.2,硫酸铵5,琼脂20。
发酵培养基(g/L):竹笋壳水解液(木糖含量20),蛋白胨 10,酵母粉 10。
灭菌条件:木糖与其他营养成分分开灭菌,条件为121℃,20 min。
1.3 菌种的分离纯化
取土样5 g溶于适量的无菌水中进行搅拌,之后取上清液按照稀释法进行适当的稀释,各取稀释梯度为 10-1、10-2、10-3、10-4 、10-5、10-6、l0-7的稀释液0.1 mL分别涂布于细菌选择性培养基中。每个稀释浓度涂3个平板以上,然后将平板放入30℃恒温培养箱培养3~5 d,之后观察菌落的形态和大小,从平板上挑选长得好的大的菌落,进行平板划线分离后再接入斜面进行菌种保藏和初筛分析用。
1.4 菌种的扩大培养
分离纯化得到的优势菌株,取适量接种于含有100 mL种子培养液的250 mL锥形瓶中,平行接种3瓶种子液。在30℃、200 r/min的培养条件下摇床培养2~3 d,根据微生物生长状况适时终止培养,选取长势良好且澄清透明的发酵液作为种子发酵液。
2 方法
2.1 竹笋壳水解液的制备
(1)竹笋壳:来自浙江工业大学北门菜市场,将竹笋壳清洗烘干后,用电动粉碎器粉碎,粉碎粒度100目,半纤维素质量分数为28%。
(2)竹笋壳半纤维素水解:竹笋壳粉末以1:8(质量:体积)的固液比与质量浓度1.0%硫酸混合,121℃下水解1 h。
(3)真空浓缩:水解液离心滤去竹笋壳残渣后,50℃真空浓缩至总还原糖为20%左右。
(4)中和:水解液用固体NaOH过中和至pH 10.0,4500 r/min离心20 min去除沉淀。上清液用浓硫酸回调至pH 5.5。冷藏备用。
2.2 水解液的发酵
在250 mL锥形瓶中加入100 mL发酵培养基,将液体种子以5%的接种量接入发酵培养基中,摇瓶转速200 r/min。30℃发酵48 h后停止摇动,最后进行24 h的木糖醇积累。
2.3 测定方法
2.3.1 木糖浓度测定
取待测品 10 mL,2500 r/min离心 10 min,将上清液适当稀释。在25 mL试管中加入1 mL稀释的上清液于大试管中,加入3 mL的DNS试剂,混匀后在沸水浴中反应5 min,冷却,定容25 mL。在波长540 nm处测量吸光度值,根据标准曲线回归方程计算出样品糖浓度[7]。
2.3.2 木糖醇含量测定
用紫外可见分光光度计法来测定木糖醇的含量。
试剂的配置:试剂a:将0.320 g高碘酸钾溶于100 mL 1%的盐酸中。
试剂b:配置鼠李糖1.11 g/L。
NaSH试剂(需现配现用):在100 mL 150 g/L的乙酸铵中,分别加入0.2 mL的乙酸及乙酰丙酮。
取适量发酵液,4500 r/min离心15 min,将上清液适当稀释。取1 mL稀释液于小试管中,加入1 mL的试剂a,混匀后在室温下反应10 min,再分别加入2 mL的试剂b和4 mL的NaSH试剂,混合均匀后在53℃水浴中保温15 min,冷却后于412 nm处测定吸光度值[8]。
2.3.3 转化率计算

3 结果与分析
3.1 菌种生长情况
图1是部分菌种划线分离后生长情况。它们是从不同浓度的进行平板涂布的培养基上挑选出来的,长得较大的较好的单菌落。在超净工作台上,将这些单菌落挑选出来,进行划线分离,然后放入恒温培养箱中进行培养。最后在超净工作台上,将以上分离出来的单菌落接到斜面试管中进行菌种的保藏,以备后续试验。
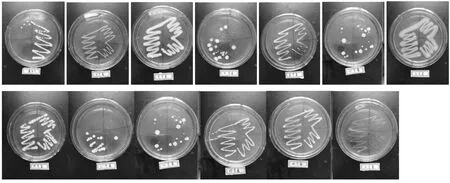
图1 菌种的生长情况Fig 1 The growth situation of strain
3.2 木糖标准曲线
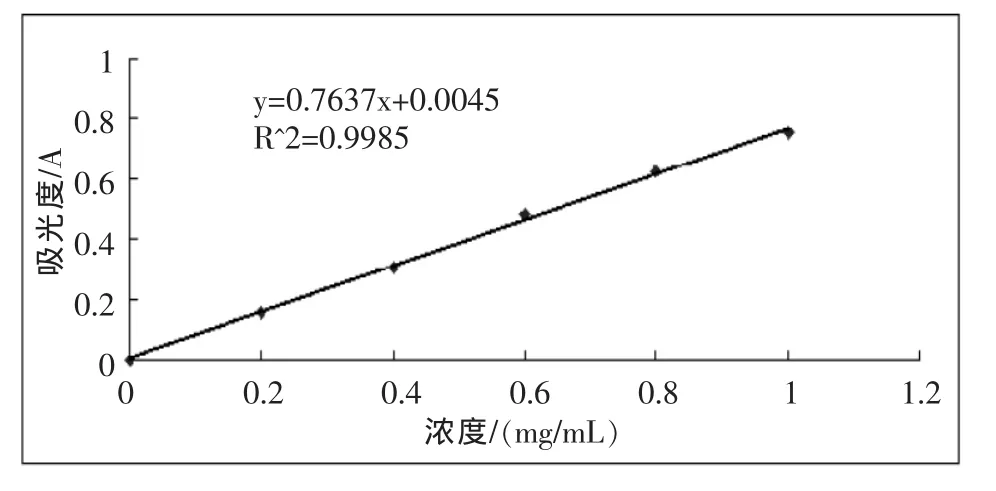
图2 木糖标准曲线Fig 2 Standard curve of xylose
3.3 木糖醇标准曲线
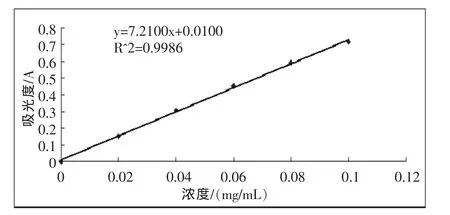
图3 木糖醇标准曲线Fig3 Standard curve of xylitol
3.4 筛选结果
初始培养基的木糖浓度均为20 mg/mL。
发酵液中的木糖醇含量根据木糖醇标准曲线方程式计算,并乘以稀释倍数。

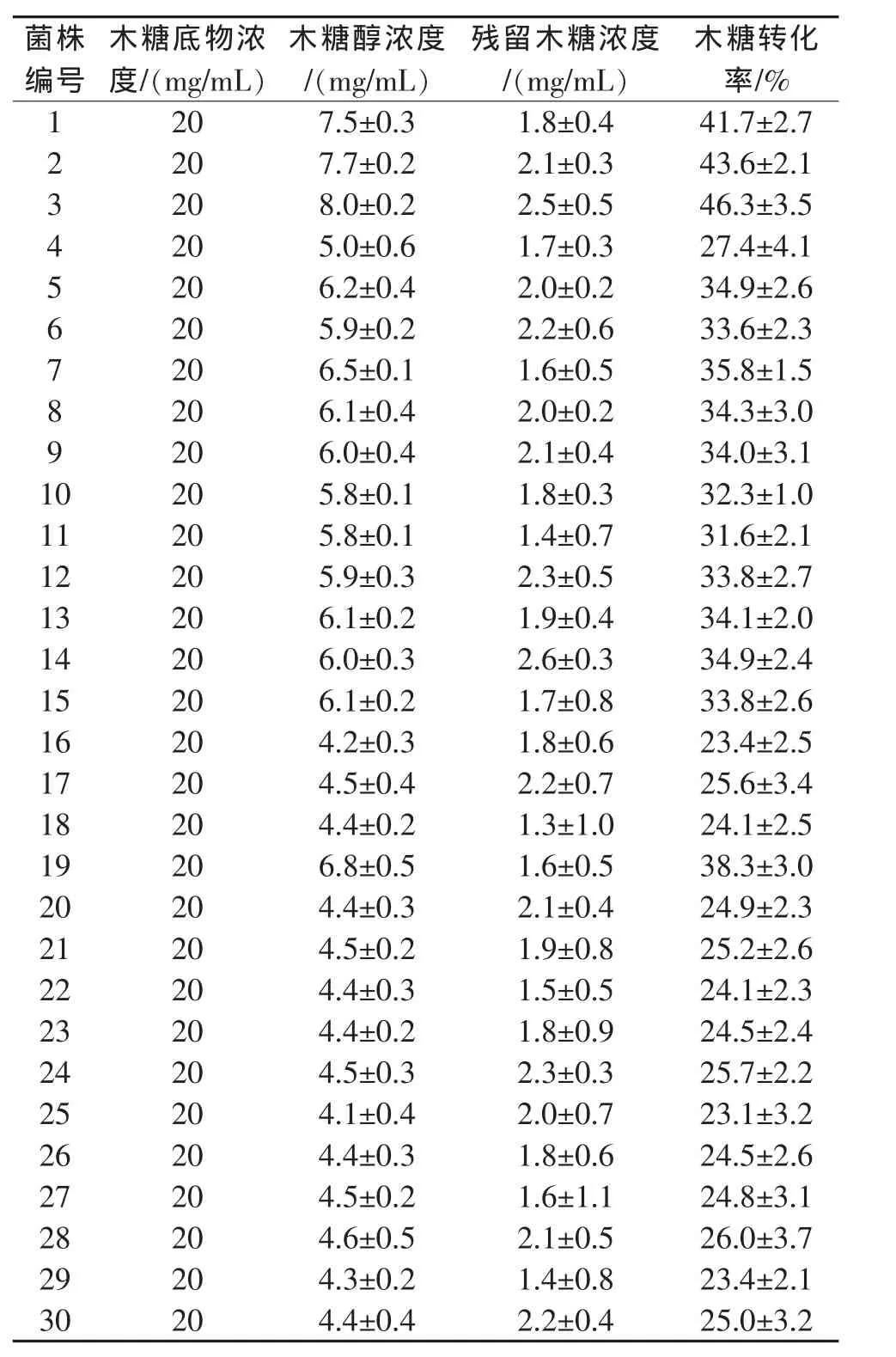
表2 工业应用试验数据表
不同菌种发酵所得到的木糖转化率如表1所示。从表中可以看出,这30个菌株的转化能力各不相同,在取平均值之后,可以看到转化率高的菌株能够达到46.3%,而转化率低的只有23.1%。用自然筛选得到的菌株差异较大,并且为了获得高转化率的菌株需要进行大量的实验积累数据。
4 结论
从发霉竹笋壳及特定土样出发,以竹笋壳水解液为唯一碳源,通过筛选培养基筛选出了能利用木糖生产木糖醇的30株菌株,并通过摇瓶培养后比较木糖转化率得到了高产木糖醇菌株即第3号菌株,其木糖转化率达到46.3%。对竹笋壳的废物利用,绿色环保,并有利于增加农民收入,对其发酵生产木糖醇可进行后续研究。
[1]张凤,张丽君,周长民.木糖醇的特性及应用[J].当代化工, 2008, 37(2):92-95.
[2]M覿kinen K K.Xylitol and oral health[J].Adv.Food Res,1979,25:137-180.
[3]Swati M.Comparative study on different strategies involved for xylitol purification from culture media fermented by Candida tropicali[J].Separation and Purification Technology, 2011, 78(3):266-273.
[4]王关斌,赵光辉.木糖醇的生产与发展趋势[J].浙江化工,2005,36(2):25-26.
[5]赵寿经,候琨,梁彦龙,等.产木糖醇菌株的筛选及发酵条件优化[J].吉林大学学报(工学版),2010,40(3):868-872.
[6]周晓洁,李建强,陈延兴.竹笋壳化学成分分析[J].武汉科技学院学报,2010,23 (1):1-3.
[7]王旭,苏桂峰.假丝酵母发酵玉米芯半纤维素水解液生产木糖醇[J].China Brewing, 2009(6):42-45.
[8]张晓元,王松梅,朱希强,等.热带假丝酵母发酵生产木糖醇的研究[J].食品与药品,2006,8(11):27-30.
