超说明书用药的安全隐患
2015-05-21张宏丽许建辉
张宏丽,许建辉,李 新
0 引言
超说明书用药(药品未注册用法)是指疾病治疗中药品使用的适应证、给药方法或剂量未列入药品监督管理部门批准的药品说明书之内。超说明书用药的具体含义包括适应人群、适应证、给药途径或给药剂量等与药品说明书注册内容不符,或超出规定的范围[1]。从实践看,在国内外都已成为临床上相当普遍的现象[2]。一直以来,对超说明书用药都存在着不同的认识,一方面认为超说明书用药是临床医学发展的客观需要;另一方面,则认为其所带来的的潜在危害也不容忽视[3]。我国目前对超说明书用药所应具有的规范性和法律基础还缺乏足够的共识[4],现笔者对超说明书用药存在的风险进行分析,以期呼吁有关各方积极推动立法,规范超说明书用药。
1 超说明书用药引发不良反应
自2008年6月26日至2014年12月31日,国家不良反应监测中心发布了64期《药品不良反应信息通报》,通报中涉及94个药物。其中,西药62个,占65.96%;中药30 个,占31.91%;中西复方制剂2个,占2.13%。另外,通报抗菌药物品种15个,占总数的15.96%;中药注射液17个,占总数的18.09%。23个药物的不良反应信息中明确存在不合理用药情况,含14个西药,8个中药,1个中西复方制剂,具体不合理使用情况见表1。
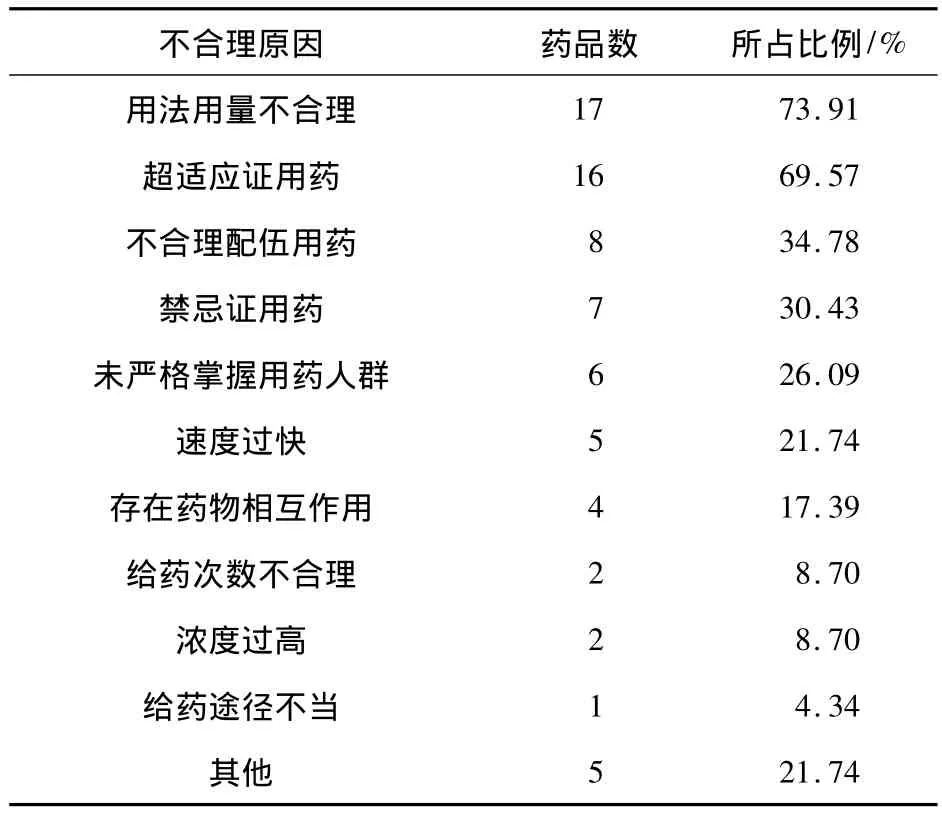
表1 不合理用药情况
从表1可以看出,23个药物使用过程中,有17个药物存在用法用量不合理现象(其中有11个药物是超剂量使用的),截止2014年12月《不良反应信息通报》中有10个超剂量使用的药物详述具体数据(见表2)。通报的药物不良反应信息有16个药物(69.35%)存在超适应证使用的问题,其中,有8个药物明确了超适应证用药所占比例(见表3)。

表2 不良反应中超剂量用药所占比例
从表2中可以看出,由于超剂量使用导致严重不良反应所占的比例高达65.10%。11个药物中,3例为中药注射液(红花注射液、香丹注射液、生脉注射液)、2例为抗菌药物(头孢唑林、克林霉素注射液)存在超剂量使用引发不良反应。
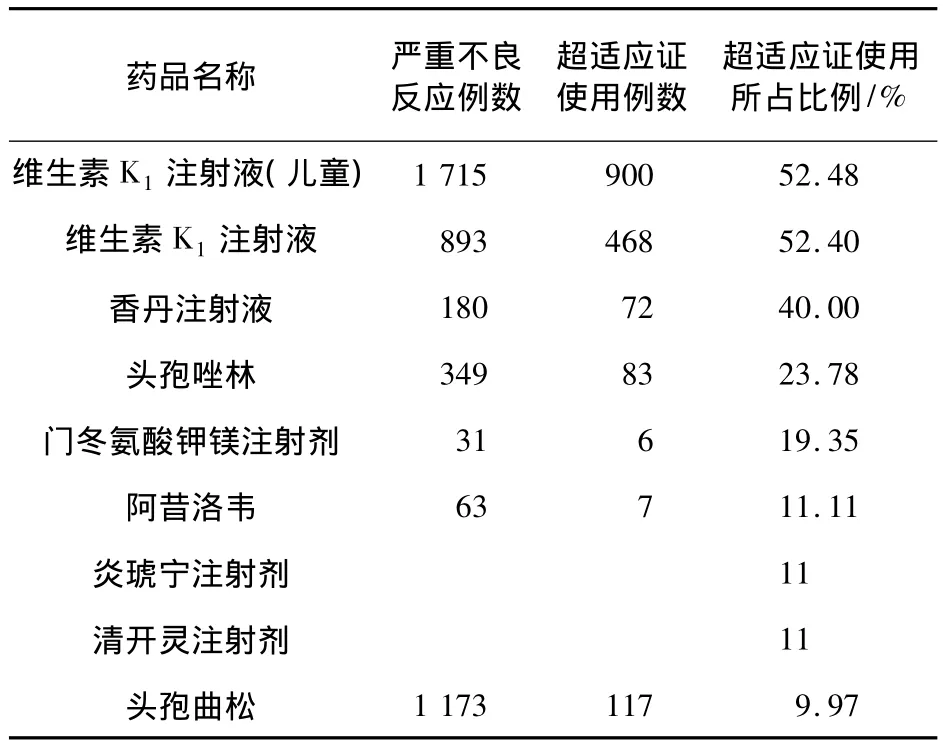
表3 不良反应中超适应证所占比例
从表3中可以看出,儿童超适应证使用引发严重不良反应的比例较高,如维生素K1注射液(儿童),1 715例严重不良反应病例中有52.48%存在超适应证使用的问题。9个药物中3例中药注射液(香丹注射液、炎琥宁注射液、清开灵注射液),2例为抗菌药物(头孢唑林、头孢曲松)存在超适应证使用的问题。
儿童的生理功能与机体功能尚未成熟发育,对药物的吸收、分布、代谢和排泄与成人相比差异显著,更容易产生药物不良反应。在治疗中,如未严格按照说明书用药,风险更高,更容易引发不良反应。
中药注射液成分复杂,有效成分多为蛋白质、多肽、多糖等大分子物质,受工艺技术和提纯方法制约,一些角蛋白质和鞣质等抗原性物质无法完全去除,溶媒选择不当造成配伍后pH改变,析出的不溶性微粒,或发生氧化、还原、缩合等反应均可引起不良反应。但部分医生或因知识更新慢或受利益驱动,认为中药作用温和、缓慢,不易造成不良后果,存在随意扩大适应证、增加剂量或延长疗程等不规范行为大大增加了不良反应的发生概率。而且,中药的药代动力学研究还不完善,说明书中未列项较多,如儿童用药、老年用药、对肝肾功能的影响,致使不规范行为风险系数增加。
抗菌药物的不规范使用的问题存在已久、部分患者甚至某些医务人员认为抗菌药物是一个“万能药”,感冒、发烧等非微生物感染疾病,会选用抗菌药对抗,造成无感染指征用药;医生对药理性质不熟悉,对浓度依赖性和时间依赖性药物没有概念,随意调整给药剂量、时间、剂量,抑或对药物的抗菌谱掌握不熟,造成“药不对菌”的现象;对患者过敏史不了解、下级医师对上级医师的“抄方”、护士未严格进行皮试试验等不严谨行为都可能威胁到患者的用药安全。药物发生不良反应的因素很多,但不规范的行为不但增加耐药率,还会大大增加不良反应,甚至增加医患间的冲突。
我国于2000年正式实施药品不良反应报告制度,2004年国家药监局发布了正式的《药品不良反应报告和监测管理办法》。2008年8月26日发布了第一期《药品不良反应信息通报》。可见,我国行政部门非常重视用药安全。药品作为特殊商品,其效益和风险并存,威胁用药安全的原因错综复杂,既有药品本身的原因,也有人为因素。严格遵循药品说明书的规定正确使用药品,既保证患者得到安全、有效、适当的药物治疗,又最大限度地维护医务工作者的利益,以发挥药物的治疗作用,规避用药风险,这个风险不但包含对患者的损害,同时也增加执业风险。例如,在把超说明书用药的问题带到了医务人员、律师、法官和公众面前的“眼药门”事件中,将安维汀用于老年性黄斑变性本应属于正常的医疗行为,由于超说明书用药无明确的法律、法规和规章制度可遵循,这种为了患者病情需要而不得不采取的诊疗行为却得不到保护。大量资料表明,允许超说明书用药的国家,使用过程中也需严格审核,比如美国FDA[5-6]、德国联邦MHRA[7]等指出,超说明书用药,应当掌握科学、全面的医学证据。日本厚生省文件[8]指出:超说明书用药可以以国外实例及国外药品说明书或相关政府机构发布的最新药品安全性信息为依据。因此,不严谨的超说明书行为必将面临医疗风险甚至法律风险。
2 超说明书用药立法现状
目前,全球有与药品超说明书使用相关立法的国家共7个,它们是美国、德国、意大利、荷兰、新西兰、印度和日本。除印度禁止超说明书用药外,其余6国均允许合理的超说明书用药,但仅英国和爱尔兰明确规定了超说明书处方权。在明确超说明书用药责任的国家中,主要责任仍由医务人员承担。有10个国家的政府部门或学术组织发布了与超说明书用药相关的指南或(和)建议[8]。
为了规范药品的临床使用,我国已制订了《药品管理法》、《处方管理办法》、《医院处方点评管理规范(试行)》、《医疗机构药事管理规定》、《药品管理法实施条例》[9]等多部法律法规和相关规定。2010年3月,广东省药学会印发了《药品未注册用法专家共识》,这是我国第一部由专业协会发布的超说明书用药专家共识,该共识虽然对医疗进步起到很好的推动作用,但只要未经立法机关或卫生行政部门、药监局认可通过,则缺乏足够的法律效力。目前,我国尚未对超说明书用药问题制订出相关具有法律约束力的规范,然而因超说明书用药导致医疗纠纷应承担的法律责任却规定得相当明确[10]。药品说明书具有法律效力,超说明书用药导致不良后果的,医生和医院要承担相应法律责任。
3 结论
积极推动立法,推进相关制度建设,保障循证支持的超说明书用药,杜绝不合理用药。超说明书用药现象分为不合理用药和有证据支持的患者病情需要的治疗两种情况。前一种是医生不负责任的表现,而后一种则是医生为了患者病情需要而不得不采取的措施。超说明书用药可以为患者病情的缓解起到立竿见影的效果,也有可能带来严重的不良反应从而导致医疗纠纷。药物的使用受用药相关人员的道德情操、职业素养、行为动机、心理因素等的影响。因此,需加强医院药事管理制度、充分发挥临床药师的监督指导职能、强化医师专业知识的培训、利用信息化完善合理用药监测系统等多种手段确保用药的合理性、安全性。同时,对于超说明书用药的广泛性、合理性、风险性,卫生行政部门及药品监督管理部门亟需将医师、药师、律师集合成一个团队,对超说明书用药进行科学合理的监管,协同推动立法、制定部门或地方性相关法规。
[1] 广东省药学会.关于印发《药品未注册用法专家共识》的通知[J].今日药学,2010,20(4):2.
[2] Stafford RS.Regulating off-label drug use:rethinking the role of the FDA[J].N Engl J Med,2008,58(14):1427.
[3] 唐蕾,韦炳华,何秋毅,等.超说明书用药的现状及其法律风险[J].中国药房,2014,25(45):4225-4228.
[4] 杨训,田祥,李阳.我国医师对超说明书用药认知情况的调查分析[J].中国药房,2014,25(20):1829-1831.
[5] C.Lee Ventola,MS.Off-Label Drug Information Regulation[S].P&T,2009,34(8):428-449.
[6] 徐蓉,孙新欣,邵明立.风险规制视域下的美国超说明书用药法律探讨[J].中国新药杂志,2014,23(22):2598-2650.
[7] MHRA.Off-label use or unlicensed medilines.prescribers'responsibilities[S].Drug Safety Update,2009,9(2):6.
[8] 张伶俐,李幼平,曾力楠,等.15国超说明书用药政策的循证评价[J].中国循证医学杂志,2012,12(4):426-435.
[9] 陈绍辉,毛颖婕.关于超说明书用药的法律性质[J].医学与法学,2014,6(3):19-24.
[10] 魏亮瑜,刘宇,睢素利,等.对超说明书用药法律问题的再认识[J].中华医院管理杂志,2014,30(9):690-962.
