中电导钙激活钾通道(IKCa通道)在HeLa细胞中的表达及其对细胞增殖的影响*
2015-05-19范凌晔石磊詹平刘玲聂丹毛熙光
范凌晔,石磊,詹平,刘玲,聂丹,毛熙光
论著
中电导钙激活钾通道(IKCa通道)在HeLa细胞中的表达及其对细胞增殖的影响*
范凌晔,石磊1,詹平,刘玲,聂丹,毛熙光
(泸州医学院附属医院:妇产科;1人力资源部,四川泸州646000)
目的:本研究旨在探讨中电导钙激活钾通道(IKCa通道)在宫颈癌HeLa细胞中的表达及其对细胞增殖的作用。方法:以宫颈癌HeLa细胞株为研究对象,构建包含IKCa通道特异性shRNA片段的pGenesil-IK质粒;运用荧光定量PCR和Western Blotting比较pGenesil-IK质粒转染干预前后宫颈癌HeLa细胞中IKCa通道基因和蛋白表达水平的变化;运用WST-1检测技术和流式细胞术观察转染干扰质粒后对HeLa细胞增殖的影响。结果:①转染pGenesil-IK干扰质粒后HeLa细胞IKCa通道mRNA及蛋白表达水平较对照组显著降低(P<0.05)。②转染pGenesil-IK1干扰质粒显著抑制HeLa细胞增殖和细胞周期(P<0.05)。结论:宫颈癌HeLa细胞上有较高的IKCa通道表达,抑制宫颈癌HeLa细胞株IKCa通道表达能有效抑制癌细胞增殖,提示IKCa通道可能是宫颈癌的治疗靶点之一。
宫颈癌曰中电导钙激活钾通道曰RNA干扰曰细胞增殖
宫颈癌(cervical cancer)是一种严重危害妇女健康的全球性疾病,在妇科肿瘤中位居第二。目前针对宫颈癌发病以及浸润转移机制尚未完全阐明[1]。我们知道细胞正常电生理结构以及功能的改变往往导致疾病的发生,甚至肿瘤的形成。作为钙激活钾离子通道家族成员之一的中电导钙激活钾通道(IKCa通道),在人体许多恶性肿瘤中出现高表达,并参与了肿瘤的发生、发展、侵袭和转移[2-5]。然而IKCa通道是否参与宫颈癌的发生尚未见报道。故本研究观察IKCa通道在HeLa细胞中的表达及下调IKCa通道后对HeLa细胞增殖的影响,探讨IKCa通道在宫颈癌发病中作用以及意义。
1 材料和方法
1.1 实验分组和RNA干扰质粒构建
本实验中的宫颈癌HeLa细胞株由重庆医科大学病理学实验室馈赠。实验分为4组:空白对照组(Control):不转染IKCa通道干扰质粒的的HeLa细胞;阴性对照组:转染含有乱序的对照干扰质粒pGenesil-HK的HeLa细胞;pGenesil-IK1组和pGenesil-IK2组:分别转染含有两个不同的IKCa通道干扰序列的HeLa细胞。RNA干扰质粒构建采用从GeneBank数据库中搜索得到IKCa通道的基因序列(NM-002250),选择设计两条shRNA和一条随机重排而成的阴性对照,所筛选出的基因靶序列1(1360-1380)模板为(GCCTGGATGTTCTACAAACAT);靶序列2(1512-1532)模板(CAAGATGCACATGATCCTGTA);阴性对照(GCCTGGATGTTCTACAAACAT),分别构建shRNA真核表达质粒命名为pGenesil-IK1,pGenesil-IK2,pGenesil-HK(由上海吉凯公司合成)。
1.2 实验方法
1.2.1 HeLa细胞培养和转染
将细胞悬液转入含10%小牛血清RPMI-1640(Hyclone,美国)培养基中,在37℃、5%CO2的培养箱内培养。用脂质体LipofectamineTM2 000转染细胞(Invitrogen,美国),转染步骤按照操作说明书进行。
1.2.2 荧光定量PCR实验
采用Taqman探针法检测IKCa通道基因表达。用Primer Premier 5.0软件设计PCR扩增引物及TaqMan探针序列(由上海吉凯公司合成),如表1所示,以GAPDH作为内参照基因。通过总RNA提取,逆转录得到cDNA,之后进行Real-time PCR反应。反应体系为:模板cDNA 5μL,10×PCR Buffer 10 μL,25 mM MgCl25μL,2.5 mM 4 dNTP混合液8 μL、0.5μM上下游引物各1μL、Taq DNA Polymerse(5 U/μL)1μL、加H2O使总反应体系为100μL;退火温度为55℃。反应循环数40个循环。

表1 Taqman法荧光定量PCR引物和探针序列
1.2.3 Western Blotting实验
蛋白的提取按凯基全蛋白提取试剂盒说明进行,测定蛋白浓度后,调整样品浓度,每个泳道加入的总蛋白量为30μg。按照Western Blotting方法进行,包括SDS-PAGE电泳、转膜和封闭。一抗(兔抗IKCa抗体,稀释比例1∶1 000;小鼠抗GAPDH抗体,稀释比例1∶20 000,北京依玛博科技有限公司)4℃孵育过夜,辣根过氧化物酶标记二抗(分别羊抗兔二抗和羊抗小鼠二抗,稀释比例为1∶5 000,北京依玛博科技有限公司)室温孵育1 h,之后显影并进行灰度值分析。
1.2.4 细胞增殖和细胞周期实验
每组20孔,每个时间点设5个复孔。于转染后21、45、69、93 h分别往每孔中加入10μL的WST-1继续培养3 h,将96孔板置于摇床上摇动1 min,以充分混匀待检测体系。使用用酶标仪分别测定转染24、48、72、96 h后各孔450 nm处吸光度值。计算同组处理样品吸光度平均值,绘制细胞生长曲线,统计分析。
1.2.5 细胞周期实验
于转染48 h后收集细胞,PBS洗涤细胞一次(离心2000 r/min,5 min)调整细胞浓度为1×106/ mL,用70%乙醇4℃固定24 h,染色前用PBS洗去固定液,加入100μL RNaseA 37℃水浴30 min,再加入碘化丙啶(PI)溶液400μL染色混匀,4℃避光30 min后,在流式细胞仪上进行检测分析。使用流式细胞术进行检测分析。计算增殖指数(PI)%=(S+G2)/(G1+S+G2)×100%。
1.3 统计学分析
计量资料采用均数±标准差(x±s)表示。组间比较采用单因素方差分析(ANOVA)。统计学处理采用SPSS16.0软件进行,以P<0.05表示差异具有统计学意义。
2 结果
2.1 IKCa通道干扰质粒在HeLa细胞上的表达
IKCa通道干扰质粒转染HeLa细胞24 h后的荧光显微镜观察结果,如图1所示。从图中可以看出,转染后含有GFP标签的对照质粒pGenesil-HK和IKCa通道干扰质粒pGenesil-IK1均能在HeLa细胞上表达,具有较高的转染效率(大于70%)。转染干扰质粒pGenesil-IK2的结果与pGenesil-IK1结果类似。2.2 Q-PCR检测HeLa细胞IKCa通道mRNA表达水平

图1 IKCa通道干扰质粒在HeLa细胞上的表达(×200)
以未转染的HeLa细胞为对照组(Control),各处理组IKCa和内参GAPDH的CT值、ΔCt值、ΔΔCt值(处理组ΔCt值-Control组ΔCt值)及倍数关系如表2所示。转染48 h后,pGenesil-IK1组、pGenesil-IK2组、pGenesil-HK组、Control组的ΔCt分别为9.81± 0.28,9.40±0.80,8.79±0.28,7.93±0.29。pGenesil-IK1组、pGenesil-IK2组表达水平明显低于pGenesil-HK组和Control组,差异有统计学意义(P<0.05)。pGenesil-HK组与Control组IKCamRNA表达无统计学差异(P>0.05),pGenesil-IK1组与pGenesil-IK2组IKCa mRNA表达水平差异无统计学意义(P>0.05)。

表2 IKCa通道干扰质粒对IKCa和GAPDH的CT,ΔCt和ΔΔCt的影响(n=3,x±s)
2.3 IKCa通道干扰质粒对HeLa细胞IKCa蛋白表达的影响
IKCa通道干扰质粒对HeLa细胞IKCa蛋白表达影响如图2所示。从图中可以看出,对照质粒pGenesil-HK对HeLa细胞IKCa通道表达没有明显影响(P>0.05)。而与对照组相比,干扰质粒pGenesil-IK1和pGenesil-IK2均能明显下调HeLa细胞IKCa通道蛋白表达水平。相对表达量分别由1.30±0.15(Control,n=5)下降到0.77±0.12(pGenesil-IK1,n=5)和0.74±0.13(pGenesil-IK2,n=5),差异具有统计学意义(P<0.05)。而干扰质粒pGenesil-IK1和pGenesil-IK2之间对IKCa通道蛋白表达量影响无统计学差异。

图2 IKCa通道干扰质粒对HeLa细胞IKCa蛋白表达的影响
2.4 IKCa通道干扰质粒对HeLa细胞增殖的影响
在本实验中应用WST-1检测转染IKCa通道干扰质粒对HeLa细胞增殖的影响。结果发现,随着时间的延长,各组细胞OD值呈进行性升高,但是pGenesil-IK1组较pGenesil-HK组和HeLa细胞空白对照组(Control)升高幅度小(见表3)。在24、48、72、96 h 4个时间点,pGenesil-IK1组细胞生长和增殖速度明显减缓,与pGenesil-HK组和HeLa空白对照组细胞相比,差异具有统计学意义(P<0.05),而pGenesil-HK组和Control组在各个时段细胞增殖活性无明显差异(P>0.05),提示IKCa通道下调能有效抑制宫颈癌HeLa细胞增殖。

表3 WST-1检测IKCa通道干扰质粒对HeLa细胞增殖的影响(n=5,x±s)
2.5 IKCa通道干扰质粒对HeLa细胞周期的影响
流式细胞仪分析细胞周期发现,与HeLa细胞空白对照组(Control)和pGenesil-HK质粒转染组相比,pGenesil-IK1质粒转染组HeLa细胞G0/G1期细胞增加,S期细胞减少,细胞被阻滞在G1期,结果具有统计学意义(P<0.05)。从表4中可以看出,Control组和pGenesil-HK组HeLa细胞G0/G1期比率分别是(48.8±0.2)%和(49.6±0.3)%,而pGenesil-IK1组G0/G1期为(53.0±1.8)%,与Control组和pGenesil-HK组相比,结果具有统计学意义(P<0.05)。Control组和pGenesil-HK组HeLa细胞S期比率是(31.5±1.5)%和(32.8±0.6)%,转染质粒pGenesil-IK1组比率则分别为(28.6±0.9)%,与细胞对照组(HeLa)和pGenesil-HK组相比,S期细胞减少,差异具有统计学意义(P<0.05)。计算细胞增殖指数PI发现:转染了pGensil-IK1质粒的HeLa细胞增殖指数为(45.0±1.8)%,而空白对照组(HeLa)和质粒对照组(pGenesil-HK)增殖指数分别为(50.2 ±0.1)%,(49.3±0.4)%,与对照组细胞相比,差异具有统计学意义(P<0.05)。这些结果提示,表达IKCa通道shRNA重组质粒的转染抑制了细胞增殖,使细胞生长停滞于G0/G1期。
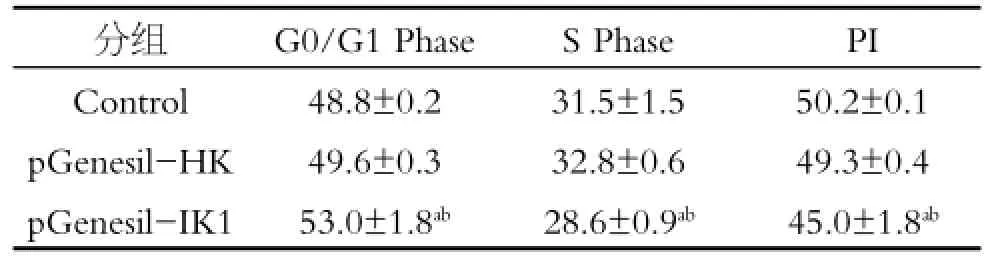
表4 流式细胞术检测IKCa通道干扰质粒对HeLa细胞周期的影响(%,n=5,x±s)

图3 IKCa通道干扰质粒对HeLa细胞周期影响的流式细胞检测图
3 讨论
IKCa通道属于钙激活钾通道家族成员之一,主要存在于一些非兴奋性细胞中,参与细胞钙离子内流、膜电位、增生、凋亡和分泌等各种生理活动的调节[6-7]。IKCa通道的激活可导致细胞膜长期处于超极化状态,形成细胞内外电位差,这种电位差能促使对电位敏感的钙离子通过细胞膜进入细胞内,产生复杂的细胞内信号传导的级联反应,从而对细胞的功能产生的影响。研究提示IKCa通道功能的改变参与了包括肿瘤在内的多种疾病的发生[8-9]。既往研究发现,IKCa在乳腺癌和前列腺癌的发生发展及侵袭中有非常重要的作用[10-11]。上述的研究证实了IKCa通道在肿瘤中占有重要的地位和作用,在我们的研究中,我们运用PCR和Western Blotting从基因和蛋白两方面证实HeLa细胞中存在IKCa通道的表达,也为下一步研究其在宫颈癌中的作用和意义奠定基础。
肿瘤细胞的增殖是肿瘤生长和侵袭的重要基础,我们知道细胞增殖依赖于细胞周期蛋白的调节,细胞周期的长短取决于G0/G1期的时间,G0/G1期时间越短,细胞的周期就越短,细胞增殖速度就越快。在人前列腺癌细胞研究中,Lallet-Daher等[11]发现,用IKCa的特异性阻断剂TRAM-34阻断IKCa可使细胞膜去极化,钙离子内流减少,细胞增殖周期减慢并停滞于G0/G1期;用IKCa的特异性阻断剂TRAM-34及其靶向siRNA阻断LNCaP和PC-3细胞的IKCa表达后,可导致细胞周期依耐性激酶抑制因子(CDKIS)p21Cip1蛋白蓄积。这些研究提示钾离子通道通过调控癌细胞的生长周期进程进而调控肿瘤的增殖和凋亡。目前,如何阻断HeLa细胞的增殖过程,延缓宫颈癌的生长是目前研究宫颈癌的热点[12]。在其他肿瘤中,使用TRAM-34或者RNA干扰阻断IKCa表达后能显著阻断肿瘤细胞的增殖。在本实验中,我们在检测IKCa通道在HeLa细胞上表达的基础上,通过干扰技术敲除IKCa表达后进一步发现:敲低IKCa通道表达能使HeLa细胞增殖指数(PI)明显降低,细胞周期停滞于G0/G1期。随后采用WST-1法分析发现在IKCa通道干扰质粒转染HeLa细胞后HeLa细胞生长增殖受到了严重的抑制殖。然而对于其中的具体的分子机制我们将在进一步的实验研究中阐述。
综上所述,宫颈癌HeLa细胞上有较高的IKCa通道表达,抑制宫颈癌HeLa细胞株IKCa通道表达能有效抑制癌细胞增殖,提示IKCa通道可能是宫颈癌的治疗靶点之一。
1.Canavan TP,Doshi NR.CervicaI cancer[J].Am Fam Physician,2000,61(5):1369.
2.Wullf H,Kolski-Andreaco A,Sankaranarayanan A,et al. Modulators of small and intermediate conductance calcium activated potassium channels and their therapeutic indications[J].Curr Med Chem,2007,13:1437-1457.
3.Bloch M,Ousingsawat J,Simon R,et al.KCNMA1 gene amplification promotes tumor cell proliferation in human prostate cancer[J].Oncogene,2007,26:2525-2534.
4.Hayashi M,Wang J,Hede SE,et al.An intermediate conductance Ca2+-activated K+channel is important for secretion in pancreatic duct cells[J].Am J Physiol Cell Physiol,2012,303:C151-C159.
5.Hosseinzadeh Z,Almilaji A,Honisch S,et al.Upregulation of the large conductance voltage and Ca2+-activated K+channels by Janus kinase 2[J].Am J Physiol Cell Physiol,2014,306:C1041-C1049.
6.Joanne E.Millership,Daniel C,et al.Calcium-activated K+channels increase cell proliferation independent of K+conductance[J].Am J Physiol Cell Physiol,2011,300:792 -802.
7.Karl Kunzelmann.Ion Channels and Cancer[J].J Membrane Biol,2005,205(3):159-173.
8.Ohya S,Niwa S,Kojima Y,et al.Intermediate-Conductance Ca2+-Activated K+Channel,KCa3.1,as a Novel therapeutic target for benign prostatic hyperplasia[J]J. Pharmacol.Exp.Ther,2011,338:528-536.
9.Huang X and Jan LY.Targeting potassium channels in cancer[J].J.Cell Biol,2014,206:151-162.
10.Haren N,Khorsi H,Faouzi M,et al.Intermediate conductance Ca2+-activated K+channels are expressed and functional in breast adenocarcinomas:correlation with tumour grade and metastasis status[J].Histol Histopathol, 2010,25(10):1247-1255.
11.Lallet-Daher H,Roudbaraki M,Bavencoffe A,et al.Intermediate conductance Ca2+-activated K+channels(IKCa1)regulate human prostate cancer cellproliferation through a close control of calcium entry[J].Oncogene, 2009,28(15):1792-1806.
12.石孟琼,刘雄,周继刚,等.南赤瓟提取物诱导宫颈癌HeLa细胞凋亡及作用机制研究[J].第三军医大学学报, 2012,34(18):1844-1848.
(2015-01-13收稿)
Objective:To detect the expression of intermediate conductance calcium activated potassium channel in cervical cancer cell lines(HeLa),and to observe the effect of blocking IKCachannels on cell proliferation and cycle.Methods:The plasmid of pGenesil-IK containing of IKCaspecific shRNA fragment channelwas transfected into HeLa cells.The combined use offluorescence quantitative PCR and Western blotting were used to investigate the gene and protein expression level of IKCachannels.The effect of IKCachannels on the proliferation of HeLa cells was investigated by WST-1 and flow cytometry.Results:①After transfection with the interference plasmid of pGenesil-IK1,IKCa channel mRNA and protein expression levels in the HeLa cells were lower than in the control group(P<0.05).②The cell cycle was inhibited by transfection with the interference plasmid of pGenesil-IK1(P<0.05).Conclusion:IKCachannels are highly expressed in cervical cancer HeLa cells.Inhibiting expression of IKCachannel can effectively inhibit,cell proliferation of HeLa cells, which suggested that IKCachannels may be one of the targets in the treatmentofcervical cancer.
Cervical cancer;Intermediate conductance calcium activated potassium channel;RNA interference;Cellproliferation
R737.33
A
10.3969/j.issn.1000-2669.2015.03.001
*四川省科技厅应用基础项目(No:2008JY0014-1)
范凌晔(1978-),女,助教
毛熙光(196-),男,教授。E-mail:maoxiguang6639@163.com
Expression of intermediate conductance Ca2+-activated K+channels(IKCachannels)in HeLa cells and its role in cell proliferation
Fang Lingye,Shi Lei1,Zhan Ping,Liu Ling,Nie Dan,Mao Xiguang
Department of Gynaecology and Obstetrics;1Department of Human Resource,the Affiliated Hospital of Luzhou Medical College
