中华苦荬菜提取物Chinensiolide A的体外抗肿瘤活性*
2015-05-16周黎赵颖王玉李丽波张树军李涛
周黎 赵颖 王玉 李丽波 张树军 李涛
在现代抗肿瘤药物中,中药占据重要的地位,目前从中草药资源中寻找选择性高、活性强、作用独特、毒副作用小的抗肿瘤新药研究方兴未艾[1]。中华苦荬菜又名丝叶苦菜、山苦菜,系菊科被子植物,1~2年生或多年生草本,叶或茎被折断后有白色乳状物流出,全草呈苦味,具有清热、解毒、消炎、凉血、止痛、消肿等功效[2-3]。本研究首次报道了中药中华苦荬菜根部提取物Chinensiolide A(化学结构见图1)在细胞水平上对肺腺癌A549细胞、人肝癌Ble-7402细胞、结直肠腺癌LoVo三种细胞的抑制作用,为该药接下来的临床应用提供科学依据。
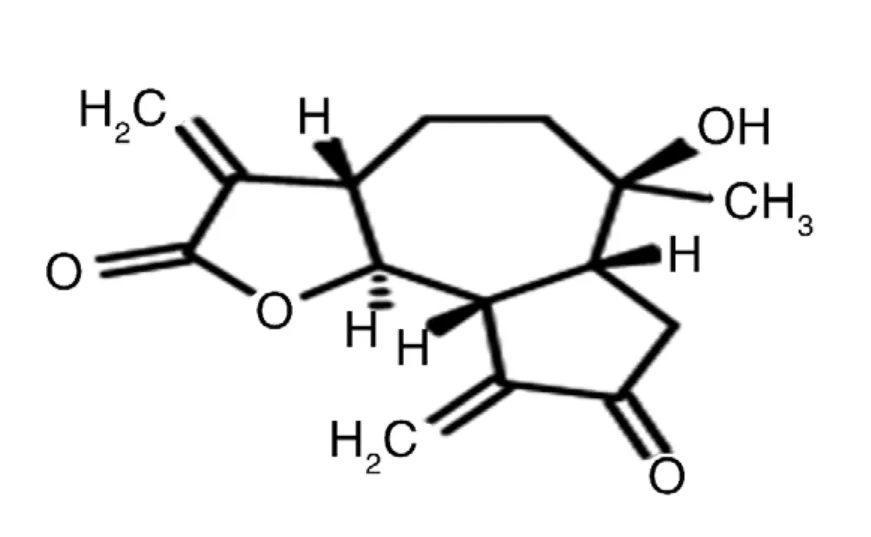
图1 Chinensiolide A化学结构
1 材料与方法
1.1 材料与试剂 中华苦荬菜提取物Chinensiolide A由张树军等[4]合成,纯度≥98%(HPLC),人肺腺癌A549细胞、肝癌Ble-7402细胞及结直肠腺癌LoVo细胞来自齐齐哈尔医学院基础研究室[5-6]。DMEM培养液购自美国Gibco公司;胎牛血清购自hyclone公司,胰蛋白酶、四甲基偶氮唑盐(MTT)及二甲基亚砜(DMSO)购自Sigma公司。
1.2 仪器与设备 Safire2多功能酶标仪购自奥地利,洁净操作台购自苏净集团安泰公司,二氧化碳孵箱购自日本三洋公司,Olympus IX70-SIF2倒置显微镜;恒温水浴锅,电子天平购自德国赛多利斯集团,微量移液器购自Gilson公司。
1.3 实验方法
1.3.1 药液配制 精密称取Chinensiolide A 粉末适量,转至1 mL量瓶中,加入DMSO稀释至刻度,充分溶解,使母液浓度为55 mmol/L。取母液10 μL,加入不含血清的培养基990 μL,稀释至550 μmol/L的工作液。过滤除菌后使用,现用现配。取上述工作液10 μL,加至100 μL细胞液中,终浓度为50 μmol/L,确保DMSO的终浓度不超过0.1%。
1.3.2 细胞培养 将肺腺癌A549细胞、肝癌Ble-7402细胞及结直肠腺癌LoVo细胞分别置于5 mL DMEM培养液的培养瓶中,在37 ℃、体积分数为5%的CO2的培养箱中培养,细胞呈贴壁生长,复苏次日及隔日更换培养液,待细胞至对数生长期进行传代,消化液为0.25%胰蛋白酶与0.02% EDTA[7]。实验选择处于对数生长期的细胞进行研究。
1.3.3 MTT法测细胞活性 对数生长期的A549细胞、Ble-7402细胞及LoVo细胞,消化后计数制成细胞悬液,浓度为4×104个/mL,取100 μL接种于96孔板中,培养24 h后,加入不同浓度的Chinensiolide A,加样体积为10 μL/孔,对照孔加DMSO,继续培养24 h,然后每孔加入6 mg/mL的MTT磷酸缓冲液10 μL,同条件下继续培养4 h,弃孔内原有液体,加DMSO 150 μL/孔,振荡以充分溶解结晶,用全自动酶标仪测定570 nm处的吸光度(D值)(参比波长630 nm)。以溶剂对照组细胞存活率为100%,计算不同浓度的Chinensiolide A实验组细胞的存活率和抑制率。计算公式如下:存活率=(Chinensiolide A 实验组D值/对照组D值)×100%;抑制率=100%-存活率。采用计算软件(LOGIT 法)计算Chinensiolide A的半数抑制浓度(IC50)值,每个实验重复3 次。
1.3.4 形态学观察比较法 在加药24 h后,加入MTT 10 μL/孔,继续培养4 h后,利用倒置显微镜观察实验组与对照组细胞,进行形态学观察分析。
1.4 统计学处理 使用SPSS 21.0统计软件进行分析,计量资料采用(s)表示,单因素方差分析(one way ANOVA)进行组间比较,以P<0.05为差异有统计学意义。
2 结果
2.1 Chinensiolide A对肺腺癌A549细胞的影响 在浓度1~50 μmol/L间Chinensiolide A对肺腺癌A549细胞的抑制作用随浓度的增长而增加,存活率依次降低。在10、20 μmol/L两浓度药物作用下抑制率差距尤为显著,在50 μmol/L时,Chinensiolide A对人肺癌A549细胞活力的抑制率已高达98.37%,提示Chinensiolide A在低浓度对A549细胞也有较强的抑制作用。Chinensiolide A对人肺癌A549细胞IC50值是17.79 μmol/L,见表 1。
表1 Chinensiolide A对人肺癌A549细胞活力的抑制作用(s)%

表1 Chinensiolide A对人肺癌A549细胞活力的抑制作用(s)%
*与空白对照组比较,P<0.01;1~50 μmol·L-1Chinensiolide A各组间两两比较,P<0.01
?
2.2 Chinensiolide A对肝癌Ble-7402细胞的影响 在浓度1~50 μmol/L浓度范围内,Chinensiolide A对肝癌Ble-7402细胞的抑制率由0.68%升至85.27%,抑制作用随药物浓度的增加而增长,且各浓度组间比较差异均有统计学意义(P<0.05),其浓度依赖关系显著。Chinensiolide A对肝癌Ble-7402细胞的IC50值为25.75 μmol/L,见表 2。
表2 Chinensiolide A对人肺癌BEL-7402细胞活力的抑制作用(s) %
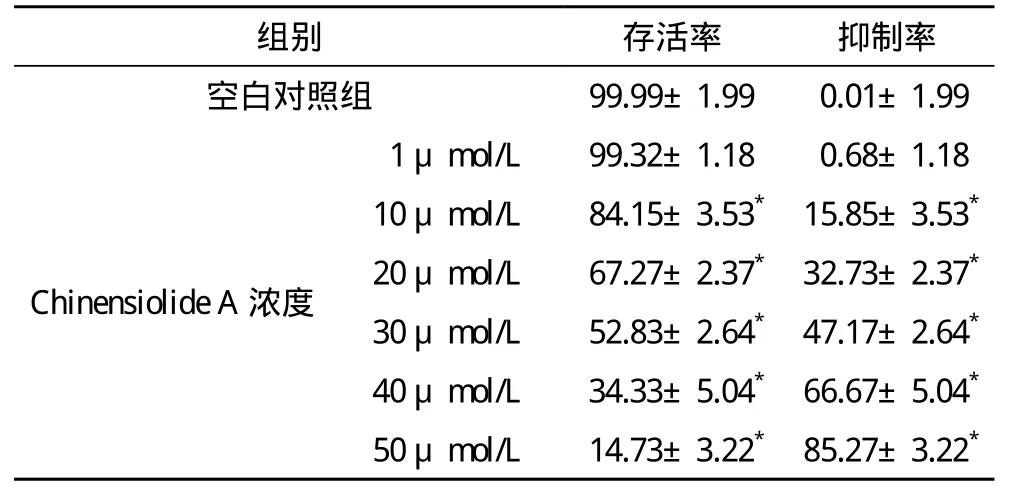
表2 Chinensiolide A对人肺癌BEL-7402细胞活力的抑制作用(s) %
*与空白对照组比较,P<0.01;1~50 μmol/L Chinensiolide A各组间两两比较,P<0.01
?
2.3 Chinensiolide A对结直肠腺癌LoVo细胞的影响 在浓度1~50 μmol/L浓度范围内,Chinensiolide A对结直肠腺癌LoVo细胞的抑制作用随浓度的增长而增加,抑制作用由1.12%增至99.57%,接近于全部抑制;且各组之间抑制率变化幅度较大,尤其在浓度1、10 μmol/L浓度和40、50μmol/L浓度之间变化近30个百分点,说明其抑制作用呈现出一定的浓度依赖趋势。Chinensiolide A对结直肠腺癌LoVo细胞的IC50值为13.6 μmol/L,见表3。
表3 Chinensiolide A对人肺癌LoVo细胞活力的抑制作用(s)%

表3 Chinensiolide A对人肺癌LoVo细胞活力的抑制作用(s)%
*与空白对照组比较,P<0.01;1~50 μmol·L-1Chinensiolide A各组间两两比较,P<0.01
?
2.4 形态学观察 结果显示空白组细胞贴壁正常生长、分裂,呈不规则形状,部分细胞中有多个细胞核且细胞核较大,颜色较深,细胞之间紧密排列,生长状态良好。药物组细胞生长缓慢,部分细胞死亡,药物对3种肿瘤细胞的生长有不同程度的杀伤作用,对每种肿瘤细胞的抑制作用随浓度的增加作用增强。加入MTT后,能清楚看出存活的细胞,与空白对照组相比,Chinensiolide A的浓度在50μmol/L时,对3种细胞系抑制作用最强。
3 讨论
如今肿瘤俨然成为21世纪一大难题,关于治疗肿瘤疾病的课题也成为世界大热点,中药具有多环节、多靶点抗肿瘤的作用,并且毒性小,副作用低,源于自然,药源丰富,国内外对单味中药提取物抗肿瘤作用进行了广泛而深入的研究[8-13]。中华苦荬菜具有多方面的生物活性,包括抗炎、抗烟碱、抗氧化、抗病毒、抗白血病等,其根部提取物Chinensiolide A为愈创木烷型倍半萜内酯类化合物[14-15]。本实验通过研究Chinensiolide A在3种人源肿瘤细胞系——人肺癌A549细胞、人肝癌BEL-7402细胞和人结直肠腺癌LoVo细胞的抗肿瘤活性,首次探究出其较强的抗肿瘤活性。
本课题组经过在药物浓度1~1000 μmol/L范围内的初步研究,发现Chinensiolide A对三种肿瘤细胞系均有不同程度的抑制作用,且作用显著。在预实验中,Chinensiolide A浓度大于50 μmol/L时,细胞存活率均小于10%,随着浓度的增加存活率明显下降,发现该药对三种细胞均有不同程度的抑制作用,且作用比较明显,从而根据数据设计,将浓度确定在1~50 μmol/L准确测量,来获得准确的IC50数值。结果显示中华苦荬菜提取物Chinensiolide A对肺腺癌A549细胞、肝癌Bel-7402细胞、结直肠腺癌LoVo细胞有明显抑制作用,IC50 分别是 17.79 μmol/L、25.75 μmol/L、13.6 μmol/L。
综上所述,中华苦荬菜提取物Chinensiolide A具有一定的抗肿瘤活性,在对三种细胞系的实验中,Chinensiolide A对A549细胞、LoVo细胞的抑制作用要较对Bel-7402细胞显著。因此,Chinensiolide A在抗肿瘤方面具有很好的发展前景,值得深入探究,在接下来的研究中,可以通过抗肿瘤细胞增殖,诱导肿瘤细胞周期阻滞、凋亡、分化,肿瘤免疫以及动物水平等各种研究方法来更精确地了解抗肿瘤机制。
[1] Park Y H,Jeong M S,Jang S B.Death domain complex of the TNFR-1, TRADD, and RIP1 proteins for death-inducing signaling[J].Biochem Biophys Res Commun,2014,443(4):1155-1161.
[2] Zhang S,Wang J,Xue H,et al.Three new guaianolides from Siyekucai (Ixeris chinenseis)[J].J Nat Prod,2002,65(12):1927-1929.
[3]杨树青,朱晓伟,申键,等.苦荬菜属植物化学成分及药理活性研究进展[J]. 内蒙古医科大学学报,2013,55(S1):111-115.
[4]张树军,王丹,许策,等.中华苦荬菜根部化学成分研究[J].中国中药杂志,2014,39(16):3089-3093.
[5]毋子亭,张芬.单味中药诱导肝癌细胞凋亡的研究进展[J].中国医学创新,2011,8(10):194-196.
[6]艾旭,李昀,邓冲,等.白藜芦醇对肝癌Bel-7404细胞增殖、凋亡、侵袭影响机制研究[J].中国医学创新,2012,9(22):12-13.
[7]陈宇航,李丽波,辛亚兵,等.新化合物2-[(4-苄氧基)苯胺基]-6-环己胺基嘌呤的体外抗肿瘤活性[J].中国新药与临床杂志,2014,33(10):724-728.
[8]陈永顺,李静,贾晓栋,等.青蒿琥酯配伍螺旋藻多糖抗肝癌SMMC-7721细胞活性作用研究[J].中外医学研究,2013,11(34):142-143.
[9]王治伟,万利,迟琼.壁虎粉提取物对HL-60细胞增殖和凋亡的影响研究[J].中外医学研究,2012,10(11):1-3.
[10]高媛,宋联强,樊梅,等.马甲子叶提取物的抗肿瘤活性研究[J].华西药学杂志,2015,30(3):303-305.
[11]郑昱.14味中药醇提液、水提液对人肝癌SMMC-7721细胞株的体外抑瘤实验及凋亡研究[J].中外医学研究,2013,11(35):145-146.
[12]冯丽,孙燕霞.银杏叶提取物对乳腺癌MCF-7细胞增殖、凋亡的影响[J].中外医学研究,2013,11(8):64-65.
[13]周宏雷,袁久荣.中华苦荬菜化学成分的研究[J].中草药,1996,27(5):267-268.
[14]王晓飞,王晓静.中华苦荬菜化学成分研究[J].中草药,2007,38(8):1151-1152.
[15]贺礼东,邓启刚,张树军,等.中华苦荬菜根部化学成分研究[C]//中国药学会.2006第六届中国药学会学术年会论文集,北京,2006.北京:中国药学会,2006:3.
