氢-水同位素交换反应热力学理论研究
2015-05-15钟正坤朱正和陈银亮
钟正坤,张 莉,孙 颖,朱正和,陈银亮
(1.中国工程物理研究院核物理与化学研究所,四川绵阳 621900;2.四川大学原子分子物理研究所,四川成都 610065)
氢-水同位素交换反应热力学理论研究
钟正坤1,张 莉2,孙 颖1,朱正和2,陈银亮1
(1.中国工程物理研究院核物理与化学研究所,四川绵阳 621900;2.四川大学原子分子物理研究所,四川成都 610065)
本文采用量子化学从头计算法对氢同位素分子及相应的氢同位素水分子进行了几何结构优化和振动频率计算,得到了6种氢-水同位素交换体系的热力学函数和气相反应平衡常数。研究结果表明:平衡常数的理论计算值与实验结果吻合,在0.1MPa和283.2~373.2K的反应条件下,HD-H2O体系平衡常数的计算值与实验值间相对偏差小于6%。
氢同位素交换;热力学;从头计算法
氢气与水之间的氢同位素交换(氢-水同位素交换)反应具有分离因子高、工艺简单以及无毒、无腐蚀性等诸多优点,是一种极具发展潜力的氢同位素分离途径,在重水生产、含氚废水处理及含氚重水氚提取等工艺过程中具有潜在的应用价值[1-2]。近20年来,人们对以氢-水同位素交换为基础的氢同位素分离技术进行了大量研究。美国Mound实验室建造了含氚废水处理实验工厂[3],法国ILL[4]、加拿大CRNL[5]和俄罗斯PNPI[6]等都进行了含氚重水提氚工程演示试验。通过热力学研究确定氢-水同位素交换反应的平衡常数等参数,是催化交换效率研究、传质过程研究和交换工艺设计的一项重要研究内容[7-8]。对于氢氘交换体系,目前已有一些相关实验数据报道,但关于含氚体系氢同位素交换的热力学实验数据鲜见报道。本工作通过量子化学理论计算研究氢-水同位素交换反应热力学,获得氢-水同位素交换反应的热力学函数和平衡常数,为研究有关催化交换的效率和传质计算提供理论参数。
1 理论方法
氢-水同位素交换反应实际上分两步进行,即气相反应和气-液交换反应,以HD(g)/H2O(l)反应体系为例,可分别表示为:


由于反应(2)实际上是氢同位素水分子气-液间的物理交换过程,其平衡常数可直接由氢同位素水的饱和蒸汽压计算,因此,确定气相反应的平衡常数(Kg)是获得整个同位素交换过程分离因子的关键。
在非相对论量子力学中,对一个含有n个电子和N个原子核的多电子分子体系,其Schrödinger方程可表示为:






根据BO近似原理,并忽略很小的微扰项,可分别得到描述电子和原子核运动的Schrödinger方程:

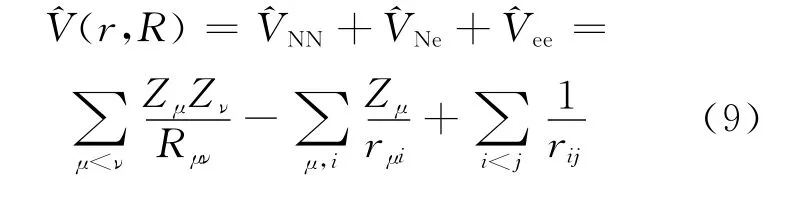

根据Hartree-Fock理论,采用自洽场(SCF)迭代法求解方程(8),可得到定核近似下的φ(r,R)及Et(R)。Et(R)为分子势能函数,即核运动的势能函数,在原子核坐标R固定时为常数,在某一电子态下,它又是原子核坐标的函数。
由于同位素分子的电子结构相同,它们具有相同的电子本征函数和电子本征能量,同位素分子内部的能级差主要来源于分子的振动和转动,因此,对于各同位素分子,式(8)的解相同,而式(10),即描述原子核运动的Schrödinger方程则不同。如果忽略原子核之间振转的相互作用,则分子的核运动由振动和转动两部分组成,可分解为:


将Et(R)、式(11)和(12)代入式(10)中,引入谐振子和刚性转子模型,并进行非谐性和非刚性校正,可得到双原子氢同位素分子的振动和转动能量[9]。引入简正坐标,即可简便地求解式(10)而得出其振动能量;氢同位素水分子无三重以上的对称轴,其转动Schrödinger方程的解很复杂,通常需将其转动惯量分解为3个轴向的主转动惯量,并引入惯量椭球的概念来求解其转动能量[10]。
至此,已得到了求解同位素分子热力学性质所需的分子内部的振动和转动能级结构。对于类似于式(1)的氢同位素交换反应,一般是在温度远高于绝对零度的条件下进行的,因此还需考虑分子平动能对热力学函数的影响。在压力不太高时,近似按理想气体计算,依据统计力学理论可得到同位素分子平动、振动和转动配分函数以及3种运动的总配分函数。再由配分函数计算出分子的内能(E)和熵(S)等热力学函数,则反应(1)的焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)可表示为:



式中:ΔEe和ΔSe分别为反应过程中电子能量和电子熵的变化,对于类似于式(1)的氢同位素交换反应,ΔEe和ΔSe均为零,式(1)中的ΔnRT也为零;ΔEtγ和ΔStγ分别为分子平动能和平动熵的变化;ΔEν和ΔEγ分别为分子振动能和转动能的变化;ΔSν和ΔSγ分别为分子振动熵和转动熵的变化。因此,通过上述热力学关系式便可求出类似于反应(1)的Kg。
量子化学理论计算采用从头计算法(ab initio)在Gaussian 98上进行。选6-311g**作为基函数,采用b3p86密度泛函方法分两步进行计算:首先进行几何结构优化;第二步进行振动频率和力常数分析,可得到反应(1)中各反应物和产物分子的平动、振动和转动配分函数以及3种分子运动的内能(E)和熵(S)等热力学函数,再由热力学函数计算反应平衡常数。
2 结果与讨论
在298.2K、0.1MPa时对6种氢同位素分子(H2、HD、D2、HT、DT和T2)及相应的6种氢同位素水分子(H2O、HDO、D2O、HTO、DTO和T2O)进行几何结构优化,结果表明:H2、HD、D2、HT、DT和T2分子的键长相等,Re=0.745 3×10-10m,与文献值[11-12]0.741 6× 10-10m和实验值0.742×10-10m一致;计算得出的6种同位素水分子的键长和键角相等,键长Re=R1=R2=0.959 6×10-10m,键角θ=103.8°,与实验值Re=0.96×10-10m,θ=104.5°很接近。说明本文所采用的计算法是正确的,选择6-311g**作为基函数也是恰当的。
6种氢同位素分子在298.2K、0.1MPa时的部分振动频率ωe和转动常数Be列于表1,氢同位素水分子振动频率计算结果列于表2。由表1可见:计算结果与文献值[11-12]一致;氢同位素分子的振动频率和转动常数均随同位素质量的增大而减小。由表2可见:在298.2K、0.1MPa时氢同位素水分子的3个简正振动频率的变化也很明显,总的变化趋势也随同位素质量的增大而减小,但同位素对称分子(H2O、D2O、T2O)和同位素不对称分子(HDO、HTO、DTO)的3个简正振动频率变化趋势有差异。同位素对称分子的3个简正振动频率随同位素质量的增大而减小的幅度基本一致,同位素不对称分子的3个简正振动频率随同位素质量的增大而减小,但变化幅度不同。

表1 氢同位素分子振动频率与转动光谱常数Table 1 Vibration frequencies and rotational constants of hydrogen isotopic molecules

表2 氢同位素水分子振动频率计算结果Table 2 Calculation results of vibration frequencies for hydrogen isotopic water molecules
由于氢同位素分子和相应的同位素水分子的质量相差悬殊,所以其振动和转动能级有明显差异,这正是导致各种同位素交换反应平衡常数差异的主要原因。因为同位素分子电子结构相同,计算结果也表明它们具有相同的电子能量,如果不考虑其核振动和转动的能级差异,同位素交换反应过程中断开化学键所需的总能量与生成化学键放出的总能量相同,反应物分子与产物分子的能量也相同,因此同位素交换反应的平衡常数均应为1。
在0.1MPa、298.2K下计算得到的6种氢同位素分子及相应氢同位素水分子的热力学函数列于表3。从表3可看出:1)所有分子的平动能均相等,Etγ=3.720kJ/mol,这一结果与理想气体的平动能仅与温度有关的结论相吻合,但平动熵却随同位素质量的增大而增大,说明平动对同位素交换反应平衡常数的影响主要来源于同位素分子平动熵的差异;2)氢同位素分子的转动能Eγ=2.481kJ/mol,氢同位素水分子的Eγ=3.720kJ/mol,两者均不随同位素分子的质量而变化,而它们的转动熵却都随同位素分子质量的增加而增大,表明转动能级对氢同位素交换的影响与平动类似,主要体现在转动熵的差异上;3)振动能在分子的总内能中所占的比重最大,而且它们随同位素分子质量的变化也最大,相反,所有氢同位素分子的振动熵均为0,相应氢同位素水分子的振动熵也近似为0,所以对同位素交换反应平衡常数的校正,主要应考虑振动能级的差异。
表4列出了0.1MPa、298.2K下,6种氢-水同位素交换反应热力学函数的变化量及平衡常数的理论计算结果。从表4可看出,Kg随同位素质量差的增加而增大。HT/H2O同位素交换反应体系的同位素质量差最大,其Kg=6.773最大;T2/DTO体系的同位素质量差最小,其Kg=1.592也最小。这一结果与理论预测的情况及文献[8,13]报道的实验结果完全吻合。

表3 氢同位素分子及其相应水分子热力学函数的理论计算结果Table 3 Calculation results of thermochemistry quantities of hydrogen isotopic molecules

表4 氢-水同位素交换反应热力学函数ΔH、ΔS、ΔG及平衡常数Kg理论计算结果Table 4 Calculation values ofΔH,ΔS,ΔGand Kgfor hydrogen-water isotopic exchange reactions
表5为HD/H2O同位素交换反应Kg的理论计算结果和实验结果[8,13]。从表5可看出:当压力为0.1MPa时,在283.2~373.2K范围内Kg的理论计算值和实验结果相吻合,最大相对偏差为6%。两个重要的氢同位素交换反应体系HD/H2O和DT/D2O的Kg随温度的变化示于图1。由图1可见:ln Kg与温度的倒数(1/T)呈直线关系,Kg随温度的升高而减小;两个反应体系ln Kg-1/T直线的斜率明显不同,HD/H2O体系的直线斜率明显大于DT/D2O体系的直线斜率,表明反应体系中同位素质量差越大,其同位素交换反应平衡常数受温度的影响越大。

表5 平衡常数理论计算值与实验结果Table 5 Comparison of calculated Kgand experimental data from reference

图1 平衡常数随温度的变化Fig.1 Equilibrium constant vs temperature
3 结论
氢同位素分子的电子结构和电子能量相同,但它们的平动、振动及转动能级有差异,因此可用量子化学从头计算法进行氢-水同位素交换反应热力学函数和平衡常数的理论计算。研究结果表明:平衡常数的理论计算值与文献[13]报道的实验结果一致,两者在压力为0.1MPa、温度为283.2~373.2K时的最大相对偏差小于6%;氢-水同位素交换反应的平衡常数随着反应体系中同位素分子质量差的增加而增大。
[1] SPAGNOLO D A,EVERATT A E,SETO P W K,et al.Choice of a process design for simultaneous detritiation and upgrading of heavy water for the advanced neutron source[J].Fusion Technology,1988,14:501-506.
[2] MILLER A I,SPAGNOLO D A,DEVORE J R.Enrichment and volume reduction of tritiated water using combined electrolysis catalytic exchange[J].Nuclear Technology,1995,112:204-213.
[3] SIENKIEWICZ C J,LENTZ J E.Recovery of tritium from water[J].Fusion Technology,1988,14:444-449.
[4] PAUTROT G P.The tritium extraction facility at the Institute Laue-Langevin[J].Fusion Technology,1988,14:480-483.
[5] MILLER J M,GRAHAM W R C,CELOVSKY S L,et al.Design and operational experience with a pilot-scale CECE detritiation process[J].Fusion Science and Technology,2002,41:1 077-1 081.
[6] ALEKSEEV I A,BONDARENKO S D,FEDORCHENKO O A,et al.The CECE experimental industrial plant for reprocessing of tritiated water wastes[J].IBID,2002,41:1 097-1 101.
[7] BUTLER J P,ROLSTON J H,STEVENS W H.Novel catalysts for isotopic exchange between hydrogen and liquid water,ACS symposium series,No.68[R].USA:American Chemical Society,1978.
[8] ROLSTON J H,BUTLER J P,HARTOG J D.The deuterium isotope separation factor between hydrogen and liquid water[J].J Phys Chem,1976,80:1 064-1 067.
[9] 赫兹堡G.分子光谱与分子结构,Ⅰ:双原子分子光谱[M].王鼎昌,译.北京:科学出版社,1983:49-109,424-427.
[10]赫兹堡G.分子光谱与分子结构,Ⅱ:多原子分子的红外光谱与喇曼光谱[M].王鼎昌,译.北京:科学出版社,1986:39-74,262-264.
[11]HUBER K P,HERZBERG G.Molecular spectra and molecular structure,Ⅳ:Constants of diatomic molecules[M].New York:Van Nostrand Reinhold Company,1979:240-271.
[12]张莉,钟正坤,朱志艳,等.氢同位素双原子分子的解析势能函数[J].化学物理学报,2003,16(6):455-458.
ZHANG Li,ZHONG Zhengkun,ZHU Zhiyan,et al.Analytic potential energy functions for hydrogen isotopic molecules[J].Chinese Journal of Chemical Physics,2013,16(6):455-458(in Chinese).
[13]BARDO R D,WOLFSBERG M A.Theoretical calculation of the equilibrium constant for the isotopic exchange reaction between H2O and HD[J].J Phys Chem,1976,80:1 068-1 070.
Thermodynamics Study on Hydrogen and Water Isotopic Exchange Reaction
ZHONG Zheng-kun1,ZHANG Li2,SUN Ying1,ZHU Zheng-he2,CHEN Yin-liang1
(1.China Academy of Engineering Physics,P.O.Box919-214,Mianyang621900,China;2.Institute of Atomic and Molecular Physics,Sichuan University,Chengdu610065,China)
Thermochemical quantities and equilibrium constants for six isotopic exchange reactions between hydrogen and water vapor were obtained through the geometrical optimization and vibration frequency calculations by ab initio.The results show that the calculated equilibrium constants of HD-H2O isotopic reaction agree well with existing literature data within a reasonable relative deviation of less than 6%under the conditions of 283.2-373.2Kand 0.1MPa.
hydrogen isotopic exchange;thermodynamics;ab initio
TL278;TQ131.11
A
1000-6931(2015)02-0250-05
10.7538/yzk.2015.49.02.0250
2013-10-22;
2014-04-21
钟正坤(1965—),男,四川什邡人,研究员,博士,氢同位素化学专业
