含左归丸鼠血清对3T3-L1前脂肪细胞芳香化酶mRNA表达的影响
2015-05-14胡翔王静陆华
胡 翔 王 静 陆 华
(1成都中医药大学,成都,610075;2成都中医药大学第二附属医院,成都,610041)
中医学认为女性绝经前后诸症主要以肾阴虚证为主[1],临床实践证明中医补肾填精法对潮热心悸[2]、阴道干涩、烦躁易怒、记忆力下降等低雌激素症状体征有明显改善[3-4]。左归丸出自明代医家张景岳的《景岳全书·新方八阵》,为补益肾阴经典方,临床上可用于治疗女性绝经前后诸症[5-6]。
现代研究发现:绝经后女性卵巢功能衰退,体内主要通过性腺外组织(脂肪组织间充质细胞[7]等)以肾上腺皮质产生的雄烯二酮为底物通过芳香化酶(Romatase Cytochrome P450,P450arom)的催化作用生成雌酮,再转化为活性强的雌二醇(Estradiol,E2)发挥作用。脂肪是女性绝经后体内雌激素合成的主要部位之一[8],健康绝经后女性的内脏脂肪在制造和转化雌酮上比外周脂肪更为重要[9]。3T3-L1前脂肪细胞是Green和Kehinde于1974年从Swiss3T3小鼠胚胎中分离克隆所得,是目前国际上公认的研究成脂过程的细胞株,能较好地模拟活体脂肪组织的功能[10-11],可作为研究脂肪组织芳香化酶表达的体外实验载体[12]。本研究以3T3-L1前脂肪细胞为平台,观察含左归丸去势大鼠血清对体外培养的3T3-L1前脂肪细胞芳香化酶mRNA表达的影响,探索左归丸改善绝经后低雌激素水平症状的作用机理。
1 材料与方法
1.1 实验动物及环境 育龄期雌性♀SD大鼠,(230±30)g,77只;购于成都中医药大学实验动物中心,饲养于二级动物实验室,合格证:SCXK(川)2004-11。室温22~25℃,湿度45% ~65%,昼夜明暗交替时间为12∶12 h。
1.2 主要药物和试剂 左归丸(上海雷允上封滨制药有限公司),成人剂量18 g/d,批号:040810;倍美力(惠氏艾尔斯特制药公司艾尔斯特药厂生产),规格:0.625 mg/片,批号:PKG0404001;戊巴比妥钠(上海化学试剂公司进口分装),批号:F20020405;雌二醇试剂盒(Alpha Diagnostic International公司),批号:05114-B;3-异丁基 -1-甲基黄嘌呤(Isobuthyl-methylxan-thine,IBMX)、地塞米松(Dexamethasone,Dex)、胰岛素(Insulin,Ins)均购于 Sigma公司;RT-PCR试剂盒:Takara,Lot:BK3101;Mouse Aromatase Primer:上海申能博彩生物科技有限公司。
1.3 主要仪器 CK40倒置显微镜(日本OLYMPUS);BB5060 CO2培养箱(德国HERAEUS);MK3酶标仪(美国Thermo);Allegra 64R高速冷冻离心机、DU640紫外分光光度计(BECKMAN);HBPX220PCR仪(Hybaid);凝胶成像系统及图象分析软件(Kodak EDAS 290及Kodak 1D3.5)等。
1.4 动物造模及分组 除正常组(20只)外,所有大鼠均腹腔注射麻醉剂戊巴比妥钠(30 mg/kg,1 mL/100 g),麻醉成功后腹位固定,消毒手术区域。假手术组(17只)大鼠去除卵巢周围部分脂肪组织(体积如卵巢大小),其余40只大鼠行去卵巢手术。术后注射抗生素预防感染,观察去卵巢大鼠阴道涂片5 d,去势成功大鼠阴道涂片无动情周期表现。将去势成功的大鼠随机分为模型组(8只)、阳性对照组(11只)、左归丸高剂量组(左高组,6只)、左归丸低剂量组(左低组,9只),正常组、假手术组、模型组每天灌服生理盐水,左高组、左低组分别灌服左归丸混悬液(0.6 g/100 g,0.15 g/100 g),阳性对照组灌服倍美力水溶液(62.5μg/100 g)[13],每组动物灌胃体积均为1 mL/100 g,3 d称取一次体重,调整给药剂量。连续灌胃11周,每天阴道涂片观察阴道上皮细胞角化率。末次灌药1 h后股动脉放血处死,所得血液静置2 h后,离心3 000 r/min,15 min,取上层血清以酶联免疫法测定E2值;剩余血清分组混匀,以0.22μm的微孔滤膜过滤除菌,保存于-70℃冰箱;将大鼠解剖后取得完整子宫称取湿重。以大鼠子宫重量和血清E2值将正常组、假手术组大鼠分为正常组动情期、正常组动情间期、假手术组动情期、假手术组动情间期。
1.5 3T3-L1前脂肪细胞的培养和诱导分化 小鼠3T3-L1前脂肪细胞由地奥集团d然药物筛选中心提供。冻存细胞复苏后以含10%新生小牛血清(New Bron Calf Serum,NCS)、青霉素100 μ/L、链霉素100 μ/L的高糖DMEM培养液培养,置于CO2培养箱中,48 h更换一次培养液。待细胞增殖至对数增长期后,将细胞接种于24孔培养板内,数量约5×104个/孔,培养1 d后,参照文献方法[14]进行诱导分化。
1.6 各类鼠血清培养3T3-L1前脂肪细胞 小鼠3T3-L1前脂肪细胞诱导分化48 h后,更换培养液:高糖DMEM培养液中含胰岛素10 mg/L、丙酸睾酮10μL/mL和2%各类鼠血清。以无鼠血清组(含2%NCS、胰岛素和丙酸睾酮)、无丙酸睾酮组(含2%NCS和胰岛素)为对照。各组细胞培养48 h后,镜下观察细胞形态变化;取细胞培养液200μL,3 000 r/min,离心5 min后,取上清液测定E2值。
1.7 各类鼠血清对3T3-L1前脂肪细胞芳香化酶表达的影响 总RNA提取方法参照文献[15]进行,1%琼脂糖凝胶电泳判断RNA质量。参照文献[16]设计小鼠芳香化酶上游引物5'CCTTCCAGCCTTGTCAGGAAACA 3',下游引物:5'CTCCTTGAGGGAAACTCATGCTCC 3'(435bp)。以小鼠甘油醛-3-磷酸脱氢酶(Glyceraldehyde Phosphate Dehydrogenase,GAPDH)为内对照(321 bp)。以总RNA 2μg,按cDNA试剂盒说明书操作,逆转录体系为20μL,合成cDNA保存于-20℃待用。按照RT-PCR试剂盒说明书,以Taq DNA聚合酶进行PCR扩增,反应体系20 μL。具体反应条件参照文献[17],产物经1.5%琼脂糖凝胶电泳,紫外灯下观察并照相。采用KODAK 1D图像分析软件分别检测样品P450arom目的带和GAPDH内对照带的光密度值,并以P450arom/GAPDH比值半定量分析P450arom mRNA表达水平。
1.8 统计学方法 采用SPSS 10.0统计软件进行分析,计量资料以(¯x±s)表示,组间比较采用单因素方差分析。高组前脂肪细胞P450arom mRNA表达低于模型组(总RNA均为2μg),高于阳性对照组(总RNA 4μg时仍未能成功扩增)。

表1 灌服左归丸高低剂量11周对去势雌鼠体重差的影响(¯x±s)
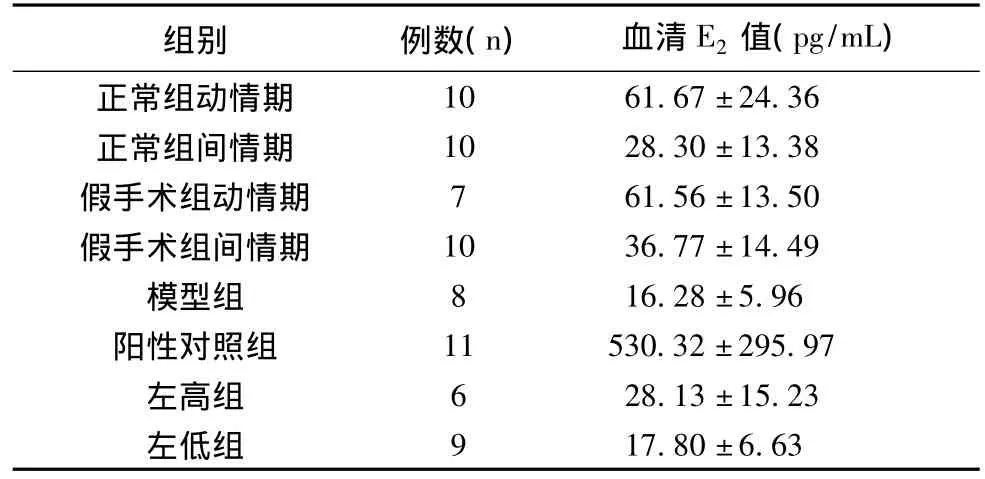
表2 灌服左归丸高低剂量11周对去势雌鼠血清E2值的影响(¯x±s)
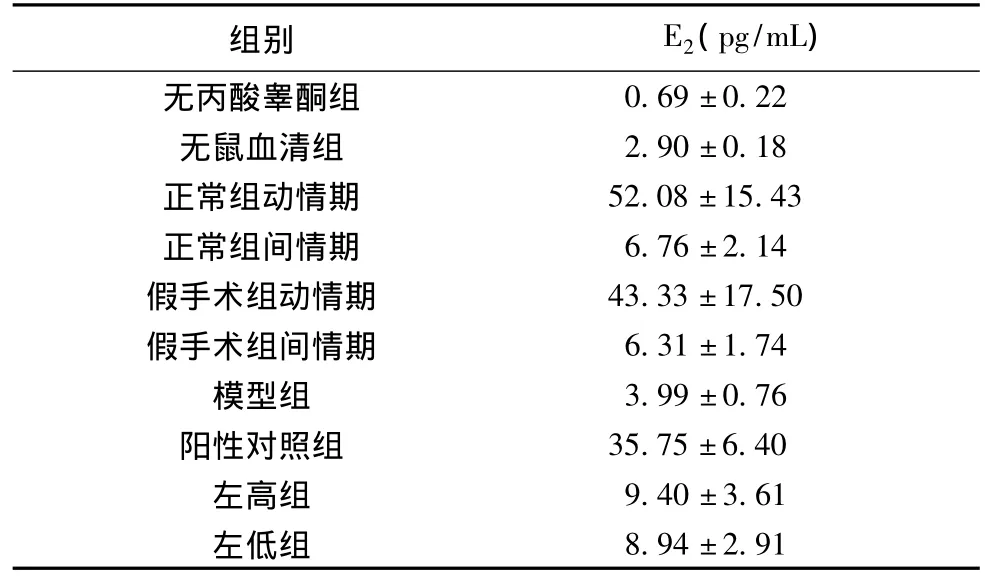
表3 2%各类鼠血清培养3T3-L1前脂肪细胞48h后细胞上清E2值(pg/mL,¯x±s)
2 结果
给予左归丸11周后,左高组、左低组与模型组比较,给药前后体重差异无统计学意义(P>0.05)。给予左归丸11周后,左高组、左低组与模型组比较,血清E2值差异无统计学意义(P>0.05)。2%各类鼠血清培养3T3-L1前脂肪细胞48h后,左高组、左低组与模型组比较,血清E2值略有升高。各类鼠血清培养诱导分化后的3T3-L1前脂肪细胞48 h后,左

图1 2%各类鼠血清对3T3-L1前脂肪细胞P450arom mRNA表达的影响
3 讨论
3.1 左归丸与外源性雌激素作用于去势雌鼠脂肪组织的机制可能不同 本研究发现左归丸作用去势雌性大鼠11周后,并不引起大鼠外周血中E2明显升高;与模型组相比,有增加大鼠体重的趋势,但无明显统计学意义。前期研究证实左归丸对去势大鼠子宫无明显影响[18],也说明左归丸对雌激素靶器官的作用并非通过提高外周血中雌激素来实现。后续研究表明补肾中药山茱萸内所含成分齐墩果酸可明显增加分化后的3T3-L1前脂肪细胞的E2分泌[19],本研究也证实含左归丸鼠血清培养分化中的3T3-L1前脂肪细胞,细胞上清液中E2值有升高的趋势,说明左归丸对3T3-L1前脂肪细胞生成E2有一定促进作用。在机体内,性腺外合成的雌激素是以旁分泌、细胞内或细胞外自分泌的方式作用于局部组织细胞[20-21],局部的雌激素总量可能很少,但浓度高,生物学效应强。推测左归丸可能通过某种途径作用于脂肪细胞,在一定程度上能够促进脂肪细胞增殖和分泌雌激素,但作用比较微弱。
很多研究认为在未给予外源性雌激素的情况下,雄激素向雌激素的转化与人体脂肪量、超重程度呈高度正相关[22],肥胖者脂肪组织较多,激素的转化也增多[23]。而本研究中给予外源性雌激素的去势雌鼠,外周血E2远高于正常组、假手术组、模型组和中药组,给药前后体重差远低于正常组、假手术组、模型组和中药组,说明循环雌激素较高的情况下可能会抑制脂肪细胞增殖。
3.2 左归丸不增加3T3-L1前脂肪细胞的芳香化酶mRNA表达,可能通过增强芳香化酶的活性起作用
研究发现脂肪组织中的芳香化酶主要在未分化间充质细胞中合成[22]。有学者认为女性绝经后体内雌激素水平降低而脂肪组织的芳香化酶表达增强[22],芳香化酶的转录水平与酶活性无明显相关,可能酶活性降低,而芳香化酶转录水平反而升高[23]。含左归丸鼠血清培养诱导分化中的3T3-L1前脂肪细胞后,细胞P450arom的mRNA表达低于模型组,而细胞上清液中E2值升高,说明左归丸不增加3T3-L1前脂肪细胞的芳香化酶mRNA表达,可使P450arom的活性增强。
[1]罗元恺,郑国平.以补肾为主治疗更年期综合征临床研究[J].中国医药学报,1990,4(2):23-25.
[2]吴晶,张兰,侯秀环.滋阴补肾更年方治疗围绝经期综合征临床观察[J].吉林中医药,2008,28(2):108-109.
[3]阮豪骥,吴昆仑.围绝经期肾阴虚证妇女经中医治疗前后血清性激素水平的变化[J].检验医学,2011,26(2):88-90.
[4]阮豪骥,吴昆仑.滋阴补肾法治疗围绝经期肾阴虚证58例[J].陕西中医,2010,31(7):797-798.
[5]罗颂平,谈勇.中医妇科学[M].2版.北京:人民卫生出版社,2012:112.
[6]张鸿宇,罗晓.左归丸合逍遥丸治疗围绝经期综合征[J].中国实验方剂学杂志,2012,18(12):295-297.
[7]Simpson ER,Zhao Y,Agarwal VR,et al.Aromatase expression in health and disease[J].Rec Prog Horm Res,1997,52:185-214.
[8]Kerry J.McInnes,Kristy A.Brown,Kevin C.Knower,et al.Characterisation of aromatase expression in the human adipocyte cell line SGBS Breast[J].Cancer Research and Treatment,2008,112(3):429-435.
[9]Lise Warming,Pernille Ravn,Claus Christiansen.Visceral fat is more important than peripheral fat for endometrial thickness and bone mass in healthy postmenopausal women[J].American Journal of Obstetrics& Gynecology,2003,188(2):349-353.
[10]Green H,Kehinde O.Spontaneous heritable changes leading to increased adipocyte conversion in 3T3 cells[J].Cell,1976,7(1):105-113.
[11]Longcope C,Pratt JH,Schneider SH,et al.Aromatization of androgens by muscle and adipose tissue in vivo[J].Clinical Endocrinology Metabolism,1978,46:146-152.
[12]Zhou J,Gurates B,Yang S,et al.Malignant Breast Epithelial Cells Stimulate Aromatase Expression via Promoter II in Human Adipose Fibroblasts:An Epithelial-Stromal Interaction in Breast Tumors Mediated by CCAAT/Enhancer Binding Protein β1[J].Cancer Research,2001,61:2328-2334.
[13]满玉晶,张楠,王秀霞,等.坤宁安对围绝经期模型大鼠性腺形态影响[J].辽宁中医药大学学报,2013,15(5):5-7.
[14]Jianbei Deng,Kunjie Hua,Steven S.Lesser,et al.Harp.Activation of Signal Transducer and Activator of Transcription-3 during Proliferative Phases of 3T3-L1Adipogenesis[J].Endocrinology,2000,141(7):2370-2376.
[15]黄培堂.分子克隆实验指南[M].3版.北京:科学出版社,2005:518-522.
[16]Chow JD,Price JT,Bills MM,et al.A doxycycline-inducible,tissuespecific aromatase-expressing transgenic mouse[J].Transgenic Res,2012,21(2):415-28.
[17]Spanic T,Fabjan T,Majdic G.Expression levels of mRNA for neurosteroidogenic enzymes 17β-HSD,5α-reductase,3α-HSD and cytochrome P450 aromatase in the fetal wild type and SF-1 knockout mouse brain[J].Endocr Res,2015,40(1):44-8.
[18]陆华,胡翔,王静.左归丸对去势雌性大鼠子宫和阴道的影响[J].中医杂志,2009,50(6):544-546.
[19]万谦,王兆会,李启佳,等.齐墩果酸对分化后的3T3-L1脂肪细胞的作用[J].中华中医药杂志,2013,28(1):68-71.
[20]Simpson E,Rubin G,Clyne C,et al.The role of local estroge n-biosynthesis in males and females[J].Trends Endocrinol Metab,2000,11(5):184-188.
[21]Labrie F,Belanger A,Cusan L,et al.Marked decline in serum concentrations of adrenal C19 sex steroid precursors and conjugated androgen metabolites during aging[J].J Clin Endocrinol Metab,1997,28(8):2386-2402.
[22]李琦,张绍芬,张国福,等.绝经后早期妇女体脂分布与雄激素水平的相关性[J].中华妇产科杂志,2011,46(5):372-373.
[23]Trant JM,Lehrter J,Gregory T,et al.Expression of cytochrome P450 aromatase in the channel catfish,Ictalurus punctatus[J].J Steroid Biochem Mol Biol,1997,61(3-6):393-397.
