泡菜中高产蛋白酶乳酸菌的筛选鉴定及其酶学特性初步研究*
2015-05-12胡玲萍裘迪红王鑫钰
胡玲萍,裘迪红,王鑫钰
1(宁波大学,浙江宁波,315211)2(浙江医学高等专科学校,浙江杭州,310053)
泡菜发酵过程中有多种微生物参与,乳酸菌作为优势菌种,在泡菜的整个发酵过程中起到非常重要的作用[1-3]。Pederson 和 Albury 等[4-5]发现,在酸白菜、酸黄瓜等泡菜的发酵早期明串珠菌非常活跃,接着是短乳杆菌、啤酒片球菌和植物乳杆菌大量产酸,最后是植物乳杆菌结束发酵过程。乳酸菌胞外产物很多,目前研究的大多是胞外多糖的性质[6],而对胞外蛋白酶研究较少。乳酸菌胞外酶通过水解作用,使多糖、蛋白质、核酸等天然高聚物裂解,逐步变为可穿过细胞质膜而被吸收利用的小分子物质,通常1株乳酸菌菌株可以分泌一种或多种胞外蛋白酶[7-8]。温度、pH、金属离子、有机物等因素都会影响胞外酶的活性。
在实际生产中,乳酸菌一般被认为是安全的细菌(generally regarded as safe,GRAS)[9,因此乳酸菌在食品中应用时可省去后提取等繁琐工艺从而提高经济效益。乳酸菌作为发酵菌种的几个重要指标能力分别是:产酸能力,产香能力,蛋白质水解能力,产生带有黏性的胞外多糖能力以及抑菌能力。因此,筛选用于发酵食品的菌株应符合食品的全面的感官性质,在考虑产酸速度和产酸量的同时,还要注意对发酵乳制品风味有重要影响的风味化合物的形成[10]。
本研究从传统发酵泡菜中分离乳酸菌,通过脱脂牛乳平板试验并结合福林酚法测定蛋白酶活力,筛选出高产蛋白酶菌株,从中提取胞外蛋白酶并对其酶学特性进行了初步的研究,目的是通过了解其蛋白质的水解能力,为该乳酸菌发酵剂的制备提供理论依据,为泡菜中植物乳酸菌胞外蛋白酶在新型发酵行业中的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
从传统泡菜中分离得到的乳杆菌。
1.1.2 主要试剂及培养基
CaCO3、福 林 酚 试 剂、NaH2PO4· 12H2O、Na2HPO4·12H2O、Na2CO3、三氯醋酸(TCA);酸化MRS琼脂培养基、脱脂牛乳平板、MRS肉汤;dNTP、TapDNA聚合酶、10×buffer、Mg2+等,大连宝生物公司;PCR产物回收试剂盒、氨苄青霉素(Ampicillin,Amp)、胰蛋白胨(Tryptone)、酵母提取物(Yeast Extract)、NaCl、琼脂粉、牛血清蛋白、考马斯亮蓝R-250、葡聚糖Sephadex-75等,上海生工生物工程技术服务有限公司。
1.1.3 主要仪器设备
H-205R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;QHZ-12A组合式恒温振荡培养箱;紫外分光光度计,上海泸西分析仪器厂有限公司;LDZX-50KB立式高压灭菌锅,上海申安医疗器械厂;DYY-Ⅲ垂直板电泳仪,北京六一仪器厂。
1.2 实验方法
1.2.1 泡菜中乳杆菌的分离纯化
将泡菜汁进行10倍梯度稀释,选取适宜的稀释度,用经灭菌并冷却到45~50℃的含有Ca2CO3的酸化MRS琼脂培养基倾倒平板,30℃培养48 h,挑取有溶钙圈的菌落,在MRS平板上反复划线,直到得到单菌落;在平板上划线分离,反复纯化,经革兰氏染色,挑出革兰氏阳性菌。
1.2.2 产蛋白酶乳杆菌的初筛
将实验室从泡菜中分离得到的乳杆菌菌株进行复壮,然后各取10 mL培养液5 000 r/min离心10 min,取50 μL上清液添加到脱脂牛乳琼脂培养基的孔里,孔径为6.0 mm,随后将其置于35℃培养48 h,最后挑选出在脱脂牛乳平板上产生透明圈较大的乳杆菌保存,每株乳杆菌进行3个平行实验[11]。
1.2.3 产蛋白酶乳杆菌的复筛
将初筛选择的菌株接种至20 mL新鲜的MRS肉汤于35℃培养72 h,取5 mL发酵液于8 000 r/min、4℃下离心20 min,所收集的上清液即为粗酶液,进行蛋白酶活力的测定。每株菌进行3次平行实验,取其平均值。确定高产蛋白酶的乳杆菌株[10]。
1.2.4 蛋白酶活力的测定
粗酶液和纯化的酶液都采用福林酚法[13]测定蛋白酶活性。在680 nm处测定样品酶液的吸光值,进而换算成蛋白酶活性。蛋白酶活性单位定义为:1 mL酶液在40℃、pH7.5的条件下,每分钟催化分解蛋白质生成1 μg酪氨酸所需的酶量为1个酶活性单位,以U/mL表示。
1.2.5 菌株L4的PCR鉴定
实验直接用菌体作为模板,不进行基因组DNA的提取步骤。用无菌移液器挑取适量活化后的单菌落L4,加入20 μL PCR水中,充分振荡后稍离心,作为PCR模板,反应体系见表1。
PCR循环参数:94℃预变性3 min,94℃ 60 s(变性),50 ℃ 60 s(退火),72 ℃ 120 s(延伸),30个循环,72℃延伸10 min。反应完毕取5 μL反应液进行1.0%琼脂糖凝胶电泳,在凝胶成像系统下分析结果。

表1 PCR反应体系Table 1 The components of PCR reaction
目的片段与载体的连接:参照大连宝生物工程有限公司的pMD18-T Vector试剂盒说明书。在微量离心管中配制下列连接反应体系(见表2),16℃下过夜。
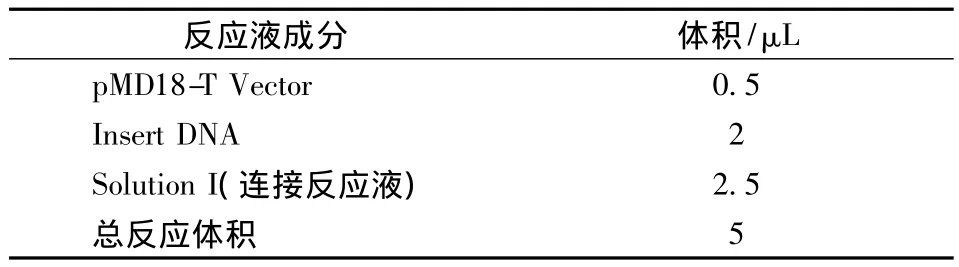
表2 连接反应体系Table 2 The components of ligation reaction
重组质粒的转化:将5 μL的过夜连接反应液加入到30 μL感受态细胞中,在冰中静置30 min,42℃水浴45 s,再冰中静置1min,加入300 μL LB(Amp-)培养液,37℃、140 r/min摇床培养60 min。
阳性克隆的初步筛选:将120 μL菌液加入含有Amp的LB琼脂平板,均匀涂布,待完全吸收后倒置于37℃培养箱中,12~16 h后观察有无白色单菌落生长。
PCR法直接筛选重组阳性克隆:PCR反应体系扩大到150 μL和反应程序与PCR扩增相同,产物做凝胶电泳检测以筛选重组阳性克隆。
序列测定:将经过鉴定符合的阳性菌落加到含Amp的LB培养液中过夜培养,加甘油保存菌液,由上海英骏生物技术有限公司测定序列。
1.2.6 植物乳杆菌胞外蛋白酶的提取
将发酵液4 500 r/min离心12 min后除去菌体,测上清液pH值。用0.22 μm/0.45 μm滤膜过滤,滤液存放于-20℃冰箱中备用。将上述培养过滤液取出置室温融化后,缓慢加入(NH4)2SO4粉末至80%饱和度,4℃过夜,10 000 r/min离心15 min,收集沉淀。将沉淀溶解于40 mL 0.02 mol/L pH7.8的Tris-HCl缓冲液,4℃透析24 h(每8 h换透析液1次),12 000 r/min离心20 min,上清液即为粗蛋白液,其间充分换水并搅动。
1.2.7 胞外蛋白酶纯化
将收集的上述酶溶液充分透析,并用PAEG浓缩至体积为6 mL左右,然后加入到用0.02 mol/L pH7.8 Tris-HCl平衡的Sephadex G-75柱,用相同缓冲液洗脱,流速15 mL/h,每管1 mL收集洗脱液,测定蛋白吸收和酶活力。收集酶活力集中部分,冷冻干燥。
1.2.8 胞外蛋白酶分子量确定
将SDS-聚丙烯酰胺凝胶装配好,注入足量的SDS-PAGE电泳缓冲液;取20 μL样品加入5 μL 5×SDS-PAGE上样缓冲液混匀;于沸水浴中处理2~5 min;离心 (10 000 g,1 min),取20 μL 上清液加到加样孔中;将电压调至160 V(恒压),当染料电泳至底部即可停止。
将电泳完毕的凝胶转移至干净的中型培养皿,加入20 mL考马斯亮蓝染色液,室温缓慢振荡15~20 min(适当加热可加速),倾去染色液,蒸馏水洗1次;加入50 mL脱色液,于室温缓慢振荡20~30 min或直至脱色完全为止。
1.2.9 胞外蛋白酶酶学特性分析
经过纯化的ECPase于55、100℃下分别处理5、10、20、35、50 min,测定酶活力。将 ECPase 分别于在0,20,30,37,50,56,60,70,80,90 和 100 ℃ 下处理 1 h,再测定其酶活性,绘制酶活性变化曲线。
分别用pH 2.2的碳酸氢钠-柠檬酸缓冲液,pH 11.0的甘氨酸-氢氧化钠缓冲液,pH 8.0的Tris-HCl缓冲液配成 pH 值分别为 2.5,3,4,5,6,6.5,7,7.5,8,9,10,11 的缓冲液,加纯化的 ECPase,测活力变化曲线。
选择性抑制剂50 mmol/L金属螯合剂乙二胺四乙酸(EDTA)、100 mmol/L丝氨酸蛋白酶抑制剂苯甲基磺酰氟(PMSF)与纯酶液以1∶1(V/V)混合,于26℃温浴1 h后,以1%的酪蛋白为底物,15%的三氯乙酸终止反应,测酶活性。
将浓度为 1 mmol/L 的 CoCl2、ZnSO4、MnCl2、BaCl2、FeCl3、CuSO4及 MgCl2等金属盐溶液分别和ECPase作用,32℃下处理0.5 h,再测定其酶活性。对照组为不加金属盐的ECPase样品,空白则为经过沸水浴灭活的样品。
2 结果
2.1 泡菜中乳杆菌的分离结果
通过平板分离培养,从酸化MRS培养基上挑取产生Ca2CO3溶解圈,乳白色或黄色,菌落直径1~3 mm,表面光滑,边缘较整齐的菌落在MRS培养基上反复划线,挑取单菌落进行革兰氏染色、镜检。选择G+菌,呈杆状,以单生、成对或短链排列的菌株,从而共分离出16株,分别标记为L1-L16,保藏于斜面。
2.2 产蛋白酶乳杆菌的筛选
通过脱脂牛乳平板试验,从分离得到的16株乳杆菌菌株中筛选出12株产蛋白酶乳杆菌,结果见图1。

图1 脱脂乳平板上产生的透明圈Fig.1 The transparent circles on skim-milk culture
将初筛得到的12株产蛋白酶的菌株按1.2.4的方法培养,采用福林酚法测定其蛋白酶活性,结果如表3所示。不同的菌株产蛋白酶活性存在差异,其中尤其以L4菌株的蛋白酶活性最高,达到25.12 U/mL。因此,本研究以L4菌株作为研究菌株,并对其进行PCR鉴定。

表3 产蛋白酶菌株的筛选结果Table 3 Results of screening of the protease-producing bacterial strains
2.3 菌株L4的PCR鉴定
2.3.1 PCR扩增结果
以L4菌体为模板,利用引物:5’-GTAGCGGTGAAATGCGTAGATATATGGAA-3’和 5’-GTGATC-CAGCCGCAGGTTCTCC-3’对L1的16S rDNA片段进行PCR扩增,结果见图2。从图2可以看出,PCR反应得到的扩增产物分子量在800bp左右,符合16S rDNA片段大小,说明所选用的PCR反应体系和反应程序都可达到预期目的。

图2 PCR扩增结果Fig.2 PCR product
2.3.2 PCR产物重组阳性克隆的筛选
从图3凝胶成像图中可以看出,PCR反应得到的扩增产物的分子量在800 bp左右,且扩增效果较好,证明所挑取的克隆菌确实含有插入的目的片段,说明本次克隆操作是成功的,没有发生污染。
2.3.3 测序结果
使用NCBI网站对该菌的16S rDNA序列与数据库中各种菌的16S rDNA序列进行比对,并使用BLAST在数据库中进行同源性搜索,发现该菌株的碱基序列与多株植物乳杆菌(JX025073.1、JQ236622.1、JN680707.1、AB362759.1、EU559598.1 等)相应 16S rDNA序列99%相似,可以鉴定L4为植物乳杆菌。
2.4 培养时间对蛋白酶活力的影响
将L4菌株接种于MRS培养基,置于30℃培养48 h,并且在培养时间为4、8、12、16、20 和24 h 处测其粗蛋白酶活力。结果如图5所示。
随着培养时间的延长,菌株产生的蛋白酶活力不断增强,在20 h左右达到最高,此后呈下降趋势。

图5 培养时间对产蛋白酶的影响Fig.5 Effect of culture time on protease production
2.5 胞外蛋白酶分子量确定
电泳完毕后的凝胶用考马斯亮蓝染色液染色、脱色液脱色后用凝胶成像仪成像分析,确定胞外蛋白酶的分子量为40 kDa。成像后的图片见图6。

图6 纯化ECPase的PAGE图谱Fig.6 PAGE electrophore-togram of the purified ECPase
2.6 酶活力标准曲线绘制
用福林酚法在680 nm处测OD值建立胞外蛋白酶酶活力标准曲线。标准曲线方程为Y=0.006X+0.002(R2=0.999)。
2.7 pH对胞外蛋白酶酶活性的影响
将胞外蛋白酶在37℃与不同pH缓冲液都作用1 h,用福林酚法测蛋白酶680 nm处OD值,绘制酶活力曲线。从图7可以看出胞外蛋白酶的最适pH为9,pH低于5或高于10酶活性受到很大影响,处于一个较低水平。

图7 pH对ECPase活性的影响Fig.7 Effect of pH on activity of ECPase
2.8 温度对胞外蛋白酶活性影响
纯化的ECPase在pH9条件下,55、100℃分别处理5、10、20、35、50 min 后发现 ECPase在 55 ℃ 下作用50 min,其活性并没有大幅度的下降,但在100℃下处理30 min后其活性则基本丧失。将ECPase分别在 0、20、30、37、50、56、60、70、80、90 和 100 ℃下处理1 h,再测定其酶活性,绘制酶活性变化曲线(图8),结果表明酶活性于50~60℃最佳,温度过低过高酶活性都将降低。

图8 温度对ECPase活性的影响Fig.8 Effect of temperature on activity of ECPase
2.9 金属离子对胞外蛋白酶活性影响
将浓度为 1 mmol/L 的 CaCl2、ZnSO4、MnCl2、BaCl2、FeCl3、CuSO4及 MgCl2等金属盐溶液分别和纯化的ECPase作用,32℃下处理0.5 h,再测定其酶活性。结果如图10所示,Mg2+、Cu2+对胞外蛋白酶活力影响不大,其他离子对胞外蛋白酶均有不同程度的抑制作用。
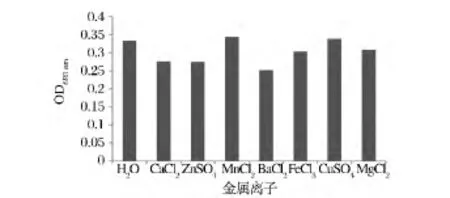
图9 金属离子对ECPase活性的影响Fig.9 Effect of metal anions on activity of ECPase
2.10 抑制剂对胞外蛋白酶活性影响
纯酶液与选择性抑制剂以1∶1(V/V)混合,于26℃温浴1 h后,测680 nm处OD值,计算蛋白酶活力。实验结果如图10所示,PMSF对胞外蛋白酶活力影响不大,而DETA则能大大降低蛋白酶活力。
3 讨论
本实验从传统泡菜中分离得到16株乳杆菌,通过脱脂乳平板试验筛选出12株产蛋白酶的菌株,结合福林酚法测定12株乳杆菌分泌的蛋白酶活力。其中以菌株 L4产蛋白酶活力最高,粗酶活力可达25.12 U/mL。利用分子生物学方法对该菌株进行PCR鉴定,并对其产酶条件进行了研究。结果显示,该菌株的碱基序列与多株植物乳杆菌(JX025073.1、JQ236622.1、JN680707.1、AB362759.1、EU559598.1等)相应的16S rDNA序列99%相似,可以鉴定其为植物乳杆菌。由纯化的胞外蛋白酶的图谱可以得出该胞外蛋白酶的分子量为40 kDa。胞外酶活力最适pH为9,在50~60℃范围酶较稳定,该胞外蛋白酶在55℃下作用50 min,其活性并没有大幅度的下降,但在100℃下处理30 min后其活性才基本丧失。抑制试验发现Ca2+、Ba2+、Zn2+、EDTA能大大抑制该蛋白酶活性,而 Mg2+、Mn2+、Cu2+、PMSF 对胞外蛋白酶活力影响不大。
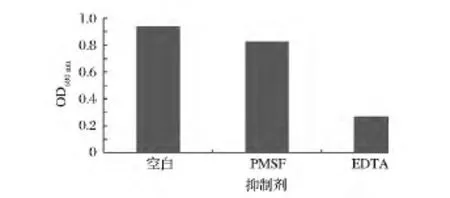
图10 抑制剂对ECPase活性的影响Fig.10 Effect of Inhibitor on activity of ECPase
植物乳杆菌属于乳杆菌科中的乳杆菌属,兼性异型乳酸发酵。据资料研究表明植物乳杆菌在乳中发酵存在一些生长限制因子,几乎不能在乳中单独生长繁殖、发酵产酸。其中的原因可能是植物乳杆菌不编码细胞壁蛋白水解酶,植物乳杆菌存在OPP和DTPT转运系统和一些胞内肽酶(内肽酶,氨肽酶,脯氨酸特异性酶,二肽酶,三肽酶),由于植物乳杆菌缺乏细胞壁表面的蛋白水解酶,不能很好利用酪蛋白,因此在牛乳发酵中周期较长[15]。目前,植物乳杆菌在发酵乳制品中的应用仅限于将植物乳杆菌作为辅助菌株,与干酪发酵剂同时加入促进干酪风味形成或增加产品益生功能。因此,利用本实验得到的高产蛋白酶的植物乳杆菌制成发酵剂发酵蛋白质食品,可以使蛋白质等大分子物质被降解成氨基酸等有利于人体吸收的小分子物质,提高食物营养资源的利用率。因此,本实验的研究可以为充分发掘传统发酵食品中丰富的微生物资源,制备优质发酵剂打下基础,具有良好的应用价值。
[1] 徐丹萍,蒲彪,卓志航.传统泡菜中乳酸菌对风味的影响[J].食品与发酵工业,2014,40(2):170-173.
[2] Heui Dong Park,Chang Ho Rhee.Antimutagenic activity of L.plantarum KLAB21 isolated from kimchi Korean fermented vegetables[J].Biotechnology-Letters,2001,23(19):1 583-1 589.
[3] Neethiselvan N,Jasmine G Indra,Jeyasekeran G.Lactic acid fermented of minced meat of Leiognaths a plendens using different bacterial sources[J].Fishery Technology,2002,12(11):39 -43.
[4] PedersonCS,Albury MN.The effect of pure culture inoculation fermentation of cucumbers[J].Food Technology,1961,15:351 ~4.
[5] 毕金峰.自然发酵酸菜汁中乳酸菌的分离、鉴定及发酵剂的筛选[J].沈阳农业大学学报,2000,31(4):346 -349.
[6] Neethiselvan N,Jasmine G Indra,Jeyasekeran G.Lactic acid fermented of minced meat of Leiognathsa plendens using different bacterial sources[J].Fishery Technology,2002,12(11):39 -43.
[7] 李林柯.蛋白酶产生菌的筛选及其ap基因的克隆和表达[D].郑州:河南农业大学,2006.
[8] 孙俊良.酶制剂生产技术[M].北京:科学出版社,2004.
[9] 王迎华,曹郁生,高丹丹.乳酸菌胞外多糖代谢工程[J].中国乳品工业,2008,36(3):35-37.
[10] 宋园亮,张忠华,熊骏.元阳豆豉中高产蛋白酶乳酸菌的筛选及其产酶条件的研究[J].中国微生态学杂志,2011,23(1):8 -12.
[11] 韩娇娇,裘迪红,宋绍华.电子鼻检测植物乳杆菌发酵草鱼中的风味物质[J].食品科学,2012,33(10):208-211
[12] 卢燕云,林建国,李明,等.复合诱变选育酸性蛋白酶高产菌株[J].中国酿造,2009(1):49-51.
[13] 姚小飞,范萌,曹晓玲,等.益生枯草芽胞杆菌B15的性能检测及培养条件研究[J].中国微生态学杂志,2009,21(7):591 -597.
[14] 陈惠源,蔡俊鹏.罗非鱼肠道蛋白酶高产菌株及其适应力研究[J].水利渔业,2005,25(4):86-87.
[15] 陈臣,任靖,周方方,等.植物乳杆菌比较基因组学研究[J].中国生物工程杂志,2013,33(12):35-44.
