蚕丝丝素肽的制备及其自由基清除性能的研究
2015-05-11宋希雨谢孔良
张 凯, 宋希雨, 谢孔良
(东华大学 化学化工与生物工程学院,上海 201620)
研究与技术
蚕丝丝素肽的制备及其自由基清除性能的研究
张 凯, 宋希雨, 谢孔良
(东华大学 化学化工与生物工程学院,上海 201620)
丝素肽是蚕丝蛋白的基本组成成分,在纺织品功能整理和生物技术领域有重要的潜在应用。采用三元溶剂溶解法和蛋白酶Alcalase水解法将蚕丝水解制得一定相对分子质量的丝素肽,以茚三酮比色法和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)测定Alcalase蛋白酶法水解丝素的水解度及制得的丝素肽的相对分子质量分布。通过正交试验,确定的Alcalase酶法水解家蚕丝最佳工艺为:蚕丝丝素质量分数4%,酶与底物质量比为2.0%,pH值8,水解温度55 ℃,时间6 h。酶水解最佳工艺下水解产物的水解度为18.3%,得到的丝素肽相对分子质量分布在5~14 kD。文章研究了丝素肽对2,2-联苯基-1-苦基肼自由基(DPPH)的清除性能,其对DPPH自由基的清除率为50%时,丝素肽的质量-体积浓度为1.85 mg/mL,丝素肽表现出良好的自由基清除功能。研究为开发丝素肽功能材料提供了一定的理论基础。
丝素蛋白;水解度;茚三酮比色法;SDS-PAGE凝胶电泳;自由基消除
蚕丝是蛋白质纤维,它由丝胶蛋白和丝素蛋白组成,其中丝素蛋白的含量约占70%~80%。作为蚕丝蛋白的重要组成部分,丝素蛋白是一种天然的高分子蛋白质[1]。近年来,丝素蛋白在纺织、食品、化妆品及生物材料等领域的应用越来越多,丝素蛋白的分离提纯、结构与性能的研究受到了广泛关注。
家蚕丝素蛋白结构由三部分组成,包括重链、轻链及辅助蛋白结构[2]。作为一种天然的生物大分子,实际应用中往往需要将其降解为具有生物活性的小分子多肽。生物活性多肽由于具有免疫调节、激素调节、降血压、降血脂、抗疲劳、抗氧化等生理调节功能,成为当前国际医药、食品、生物化工及生物功能材料等领域的热门研究课题[3]。
目前,关于蚕丝丝素肽的制备方法,文献报道的方法主要包括酸水解、碱水解及酶水解等。酸水解可使丝素蛋白充分水解,但使色氨酸全部破坏,丝氨酸、酪氨酸和苏氨酸部分破坏[4];碱水解会引起消旋作用,从而降低丝素肽的营养价值[5];酶水解由于反应条件温和,对氨基酸破坏小,而成为降解丝蛋白的最有前途的方法[6-7]。Alcalase酶是一种重要的蛋白酶,可以有效控制蛋白质的水解程度[8]。本文采用Alcalase酶水解家蚕丝蛋白,得到一定相对分子质量的丝素肽产品,以茚三酮比色法测试丝素肽的水解度,采用SDS-PAGE凝胶电泳法测定所得丝素肽的相对分子质量分布,并研究丝素肽对DPPH自由基的体外清除性能。
1 实 验
1.1 材料和仪器
材料:家蚕丝生丝(浙江嘉欣丝绸股份有限公司),透析袋(截留相对分子质量,MWCO:14 kD,上海绿鸟科技发展有限公司)。
试剂:乙醇、冰醋酸、盐酸、甲醇、氯化钙、脲、丙烯酰胺(ACR)、甲叉双丙烯酰胺(BIS)、三羟甲基氨基甲烷(Tris)、三(羟甲基)甲基甘氨酸(Tricine)、十二烷基硫酸钠(SDS)、N,N,N′,N′-四甲基乙二胺(TEMED)、抗坏血酸(分析纯,国药集团化学试剂有限公司),2,2-联苯基-1-苦基肼(DPPH自由基,Alfa Aesar,95%),Alcalase碱性蛋白酶(食品级,丹麦诺维信),蛋白质Marker标准品(BM523,上海生工生物工程股份有限公司)。
仪器:U-2910紫外可见分光光度计(日本日立公司),RY-25012常温振荡染色机(上海龙灵电子科技有限公司),低温冷冻干燥机(Ilshinbiobase, Korea),DYY-6C双稳定时电泳仪(北京六一仪器厂),超纯水仪(PURELAB Option, ELGA)。
1.2 方 法
1.2.1 蚕丝的溶解
蚕丝脱胶:在质量分数0.5%的Na2CO3溶液中,脱胶液的体积(mL)与蚕丝的质量(g)之比为50,煮沸30 min,重复2次。
脱胶完成后,用三元溶剂体系(氯化钙,水,乙醇)对蚕丝进行溶解,三者的摩尔比为n(CaCl2)︰n(H2O)︰n(C2H5OH)=1︰8︰2,所用蚕丝与三元溶剂的质量比为1︰10,溶解温度为(78±2) ℃[9]。蚕丝可以完全溶解,得到蚕丝的丝素蛋白溶液。
将丝素蛋白的盐溶解液转移到处理过的透析袋中,为了防止蛋白质的变性和避免透析时微生物的生长,采用低温4 ℃下透析。用自来水透析2 d后,用蒸馏水透析1 d,以此达到充分去除钙离子、氯离子及溶剂小分子的目的。最后离心分离,取上清液即是丝素蛋白水溶液。
1.2.2 丝素肽的制备
丝素蛋白水溶液采用酶法水解,其具体工艺为:家蚕丝水溶液→Alcalase碱性蛋白酶水解→透析除盐→丝素肽水溶液。
影响酶水解的主要因素包括水解时间A、pH值B、酶与底物的质量比C、底物质量分数D及温度E。试验中以这5个因素为主要考察因素,利用正交试验设计对蚕丝水解的工艺条件进行优化。采用5因素4水平进行正交试验,如表1所示。

表1 Alcalase碱性蛋白酶的作用水平与因素Tab.1 Effect factors and levels of Alcalase alkaline protease
1.2.3 水解度的测定
以茚三酮比色法[10]测定不同丝素蛋白的水解度,水解度DH的计算见下式[11]:
DH=h/htot×100%
(1)
式中:h为水解后1 g蛋白质被裂解的肽键毫摩尔数,htot为1 g原料蛋白质的肽键毫摩尔数,n为水解液中游离氨基的含量,n0为蛋白质原液中的游离氨基的含量,N为再生丝素蛋白水解液中的蛋白质含量(注:10.2 mmol为1 g丝素蛋白含有的肽键毫摩尔数[7])。
1.2.4 凝胶电泳(SDS-PAGE)
1.2.4.1 电泳储存液的配制
SDS-PAGE凝胶电泳参照文献[12-13]的方法进行。电泳缓冲液和凝胶贮存液的配制分别如表2和表3所示。

表2 SDS-PAGE电泳缓冲液Tab.2 SDS-PAGE electrophoretic buffer solution
注:a.以HCl调节pH值;b.pH值无需调节,缓冲液的pH值约为8.25。

表3 SDS-PAGE凝胶贮存液Tab.3 SDS-PAGE gel storage solution
注:T代表ACR和BIS的总质量分数;C代表交联度,表示BIS质量占ACR和BIS总质量的百分数。
1.2.4.2 凝胶的制备
分离胶在电泳系统中起分子筛和载体的作用,据文献[14]当分离胶总质量分数T=15%(C=5%~7.5%)时,凝胶分子间隙最小,对蛋白质的分离效果好。所以本文选用的分离胶质量分数T=15%,交联度C=6%;浓缩胶的制备方法与一般的SDS-PAGE相似。分离胶和浓缩胶的组成如表4所示。

表4 分离胶和浓缩胶的组成Tab.4 Composition of separation gel and stacking gel
电泳槽的内、外槽分别装阴、阳极缓冲液见表2,在起始电压为60 V的条件下开始电泳,当样品前沿(溴酚蓝)进入分离胶后,将电压调整为100 V,直至样品中染料迁移至离下端1 cm左右时,停止电泳。
电泳结束后,将凝胶放在盛有染色液的染色槽中浸泡1 h左右,然后倒去染色液,用蒸馏水清洗一次,然后加入脱色液,放在摇床上振荡使其脱色,更换几次洗脱液,直至蛋白质区带清晰为止。脱色结束后,测量蛋白质标准品各个条带的迁移距离,得到各蛋白质的相对迁移率Rf(Rf为分离胶上沿至溴酚蓝的距离与蛋白质移动的距离的比值)。SDS-PAGE凝胶电泳中蛋白质相对分子质量的对数值与其在SDS-PAGE凝胶中的相对迁移率存在线性关系,如下式所示:
LogMw=mRf+n
(2)
式中:Mw为蛋白质的相对分子质量;Rf为蛋白质在凝胶中的相对迁移率;m,n分别为以LogMw对Rf作直线拟合时直线的斜率及直线在Y轴上的截距。
1.2.5 DPPH自由基消除性能
丝素肽的固体样品通过低温真空冷冻干燥后得到,其对DPPH自由基的消除试验参照文献[15]的方法。
DPPH甲醇溶液的配制:取0.004 g DPPH自由基用甲醇定容于100 mL的容量瓶中,得到0.1 mmol/L的DPPH甲醇溶液。
丝素肽水溶液的配制:取0.10 g丝素肽固体粉末溶于10 mL的蒸馏水中,配制成10 mg/mL的丝素肽水溶液。
试验中以标准抗氧化物抗坏血酸(维生素C)的DPPH自由基清除能力作参照。称取10 mg的维生素C溶于10 mL的蒸馏水中,配制成1 mg/mL的维生素C水溶液。
取2 mL丝素肽样品稀释液,加人2 mL 0.1 mmol/L DPPH甲醇溶液,摇匀后于暗处放置30 min,测定体系在517 nm处的吸光度值,记为A。以样品溶液加甲醇作为对照组,其在517 nm处的吸光度,记为A对照;测定2 mL DPPH甲醇溶液和2 mL水的混合溶液在517 nm处的吸光度值,记为A空白。
自由基清除率(SC,%)的计算公式如下:
(3)
SC50为自由基清除率为50%时的样品质量浓度,可经线性回归后计算出。
2 结果与讨论
2.1 丝素蛋白的酶法水解
为了更好地进行水解,脱胶后的蚕丝可以被氯化钙、水、乙醇的三元溶剂体系溶解,得到蚕丝的丝素蛋白溶液。酶水解由于反应条件温和,可以有效控制蛋白质的水解程度,Alcalase酶被应用于丝素蛋白溶液的降解。通过正交试验对酶法水解丝素蛋白的条件进行了优化。正交试验中以底物质量分数、酶与底物质量比、温度、pH值及水解时间为主要考察因素,以水解度为响应因素,试验结果如表5所示。

表5 正交试验结果Tab.5 Results of orthogonal experiment
从表5的正交试验结果可知,Alcalase酶水解的最佳工艺为B2C4A3E2D1,即丝素质量分数4%,水解温度55 ℃,酶与底物质量比为2%,pH值为8.0,反应时间6 h。采用最佳工艺条件对丝素水解液进行酶水解,以茚三酮比色法测定水解度为18.3%
2.2 丝素肽的相对分子质量分布
SDS-PAGE凝胶电泳谱可以测定丝素肽蛋白质的相对分子质量分布。在SDS-PAGE电泳试验中,使用的蛋白质标准品BM523的组成如表6所示。

表6 蛋白质标准品 BM523的组成Tab.6 Components of protein marker BM523
SDS-PAGE凝胶电泳谱图如图1所示,样品a为蛋白质标准品BM523,样品b为三元溶剂体系溶解后的丝素蛋白水溶液,样品c为酶水解制备的丝素肽溶解液,d为酶空白试验样品(体系中仅存在酶及缓冲液)。

图1 不同样品的SDS-PAGE凝胶电泳图谱Fig.1 SDS-PAGE gel electrophoretogram of different test samples
对图1中的蛋白质标准品谱带进行分析,通过测量求得蛋白质标准品各个条带的相对迁移率Rf,然后以各标准蛋白质相对分子质量Mw的对数值LogMw对Rf作图,并进行直线拟合,如图2所示。
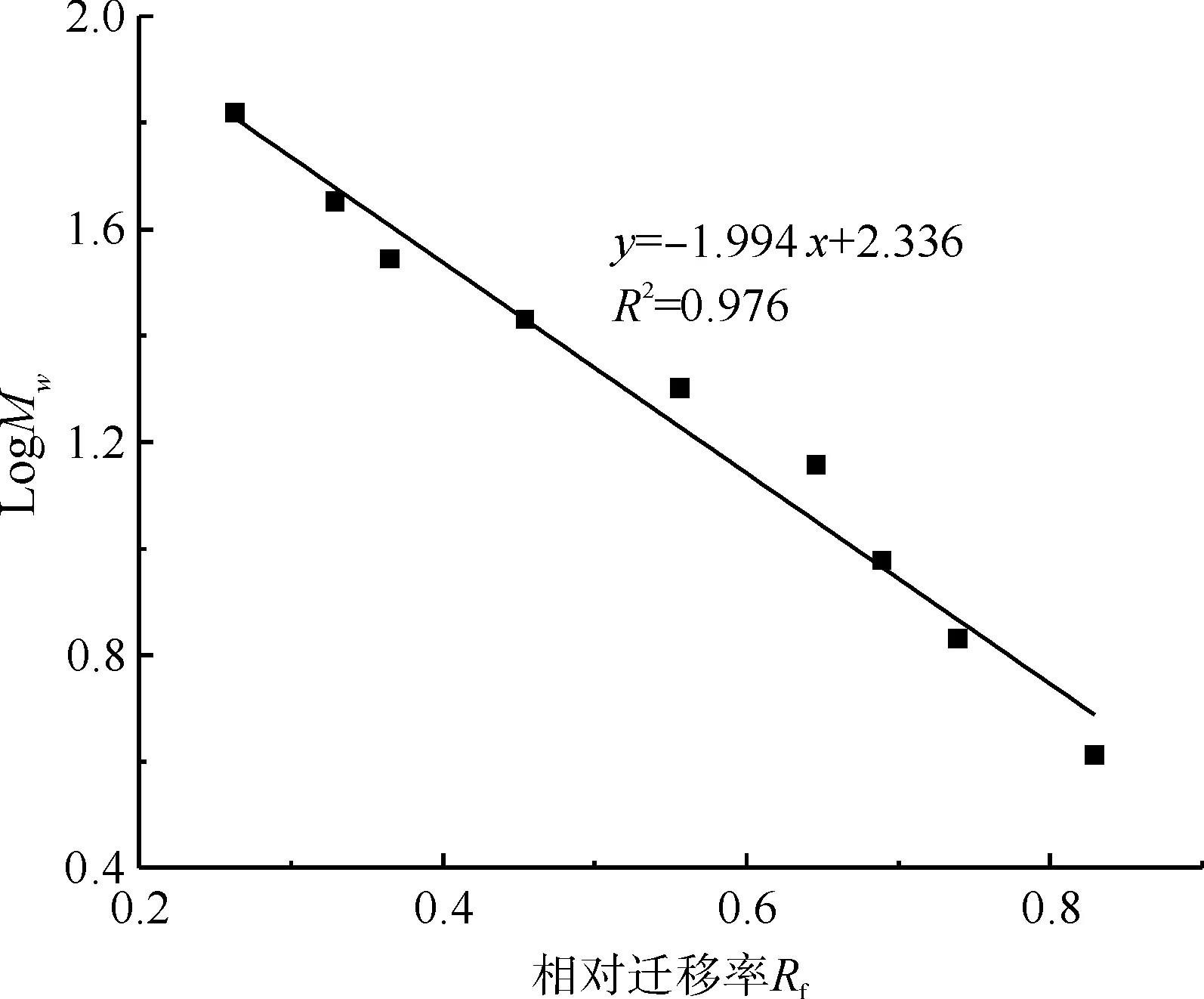
图2 蛋白质标准品SDS-PAGE数据的线性拟合Fig.2 Linear fitting of SDS-PAGE data of protein marker
SDS-PAGE凝胶电泳测定蛋白质相对分子质量时,通过计算得到凝胶电泳后的未知蛋白质在聚丙烯酰胺凝胶上的相对迁移率,然后利用图2中的拟合直线方程式进行运算,便可求得未知蛋白质的相对分子质量。结合图1和图2对数据进行分析可知:酶空白实验的电泳图上不显示任何区带,这说明在酶用量很低的情况下,酶本身对测试结果没有干扰;三元溶剂溶解后得到的再生丝素蛋白的相对分子质量分布很宽;酶水解条件下制备的丝素肽的相对分子质量分布较集中,相对分子质量也较小,主要分布在5~14 kD的相对分子质量区间内。由此可见,丝素蛋白经过Alcalase酶法水解后,丝素蛋白大分子被降解成相对分子质量较小的丝素多肽,接下来以丝素肽为研究对象,研究丝素肽的DPPH自由基清除性能。
2.3 丝素肽的自由基清除性能
2,2-联苯基-1-苦基肼自由基有单电子,在517 nm处有一强吸收峰,其醇溶液呈紫色。当有自由基清除剂存在时,由于自由基清除剂与其单电子配对,而使其在517 nm处的吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用分光光度计进行定量分析自由基清除性能[16]。DPPH法自由基清除率测试的原理如图3所示。

图3 DPPH自由基清除机理Fig.3 Mechanism of DPPH radical scavenging
丝素肽和维生素C的DPPH自由基清除性能通过分光光度计进行定量的测定,维生素C的DPPH自由基清除性能被用来作为参照对比。它们的自由基清除性能及线性拟合方程如图4所示。
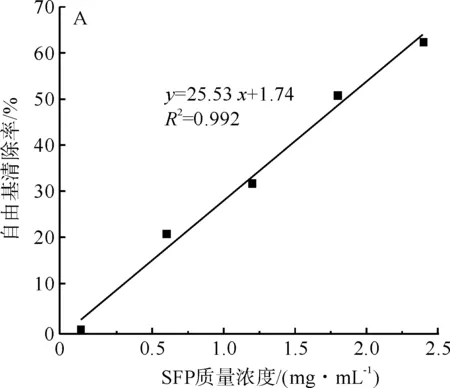
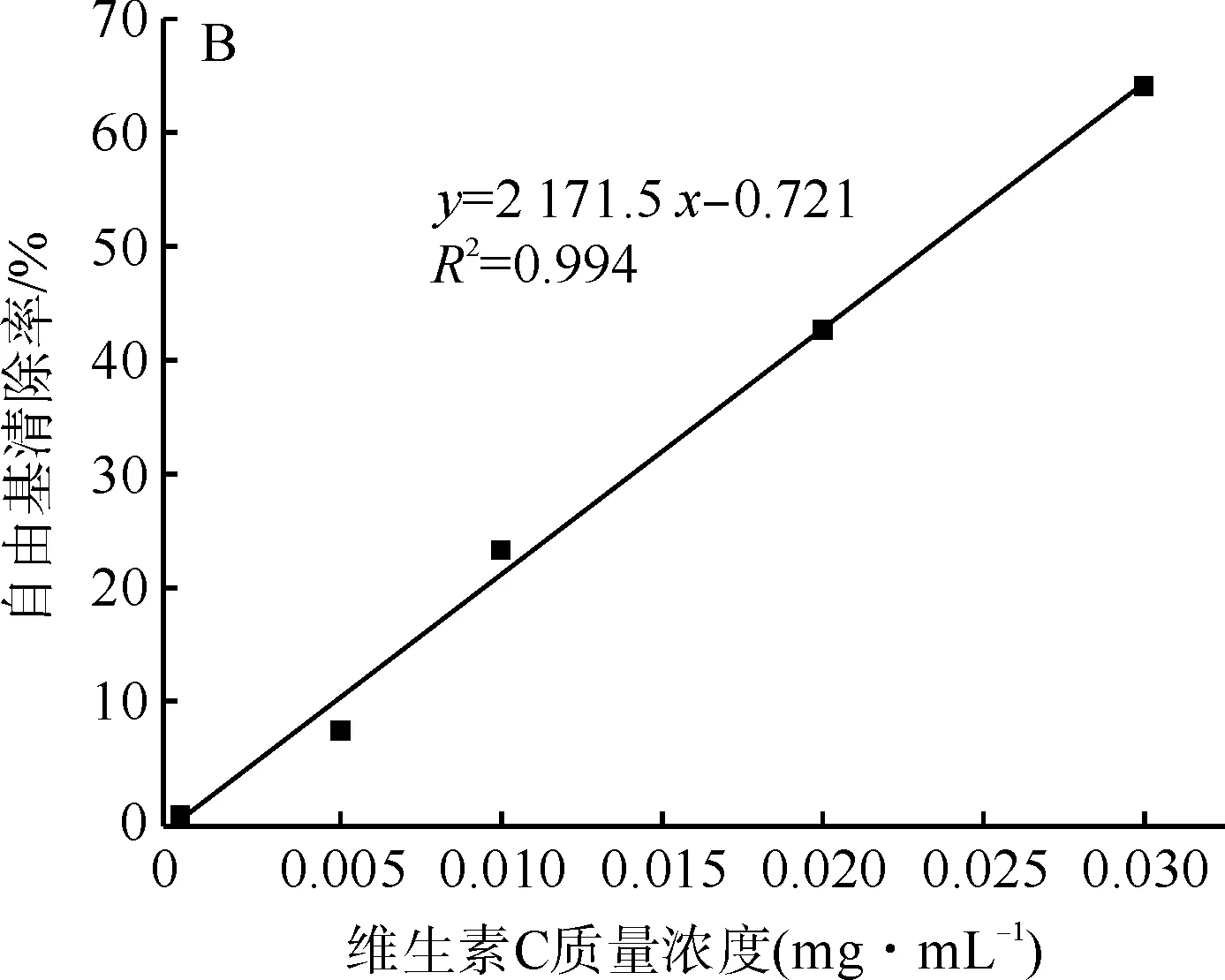
图4 丝素肽(A)和维生素C(B)的DPPH自由基清除能力Fig.4 DPPH radical scavenging ability of fibroin peptide (A) and Vitamin C (B)
从图4可以看出,DPPH的自由基清除率随着丝素肽质量-体积浓度的增大而提高,维生素C的自由基清除率试验也表现出相同的趋势。SC50是表征自由基清除能力的重要指标,为自由基清除率为50%时样品的质量-体积浓度。丝素肽和维生素C的SC50可以通过图4中的线性拟合方程求得两者的DPPH自由基清除率的SC50分别为1.85 mg/mL和0.024 mg/mL。Aranya Manosroi等[16]研究了不同丝胶水解产物对DPPH自由基的清除率,研究认为丝胶水解产物、维生素C及亚油酸对DPPH自由基清除率的SC50分别为34.3、0.42、218.9 mg/mL。由于DPPH自由基试验操作方法不同,因此文献中的数据与本文数据存在差异,维生素C对DPPH自由基的清除能力是一定的,所以两组数据中丝素肽和丝胶水解产物相对于维生素C的相对值可以间接反映本文中制备的丝素肽与文献中丝胶水解产物的DPPH自由基清除能力间的差异。本文中丝素肽的DPPH自由基清除率的SC50是维生素C的77倍,而文献中报道的丝胶水解产物的SC50是维生素C的81倍。由此可知Alcalase酶水解制备的丝素肽与文献中的丝胶水解产物具有相近的DPPH自由基清除能力。综上分析可知,采用Alcalase酶水解制备的丝素肽具有良好的自由基清除能力,这类由蚕丝获得的丝素肽分子在生物功能材料、功能纺织面料及化妆品领域有潜在的应用价值。
3 结 论
1)酶水解丝素制备丝素肽的最佳工艺为:丝素质量分数4%,水解温度55 ℃,酶与底物质量比为2%,pH值为8.0,反应时间6 h。以茚三酮比色法测定了丝素水解产物的水解度为18.3%。
2)采用SDS-PAGE凝胶电泳法测定了丝素蛋白的相对分子质量分布。三元溶剂溶解后的丝素蛋白水溶液的相对分子质量很大且分布很宽,Alcalase酶水解后制备的丝素肽相对分子质量,主要分布在5~14 kD。
3)丝素肽和维生素C对DPPH自由基清除率的SC50分别为1.85 mg/mL和0.024 mg/mL,丝素肽具有良好的DPPH自由基清除性能,在化妆品、功能纺织品等领域有良好的应用前景。
[1]孔祥东,朱良均,闵思佳.丝素蛋白在生物材料上的研究和应用[J].功能材料,2001,32(6):583-585. KONG Xiangdong, ZHU Liangjun, MIN Sijia. Research and utilization of fibroin protein on biomaterials[J]. Journal of Functional Materials,2001,32(6):583-585.
[2]SUZUKI Y , MATSUI H, Tsujimoto Y, et al. Enzymatic degradation of fibroin fiber by a fibroinolytic enzyme of Brevibacillus thermoruber YAS-1[J]. Journal of Bioscience and Bioengineering,2009,108(3):211-215.
[3]TONG L M, SASAKI S, MCCLEMENTS D J, et al. Mechanisms of the antioxidant activity of a high molecular weight fraction of whey[J]. Journal of Agricultural and Food Chemistry,2000,48(5):1473-1478.
[4]谢瑞娟,李明忠,卢神州,等.丝素肽的制备[J].丝绸,2008(2):18-20. XIE Ruijuan, LI Mingzhong, LU Shenzhou, et al. Preparation of silk fibroin peptide[J]. Journal of Silk,2008(2):18-20.
[5]王方林,韩艳霞,陈伟.蚕丝蛋白水解工艺及作为化妆品添加剂的应用研究[J].化学世界,2006,47(9):541-543,547. WANG Fanglin, HAN Yanxia, CHEN Wei. Study of application of silk fibroin as cosmetic additives[J]. Chemical World,2006,47(9):541-543,547.
[6]周凤娟,许时婴,杨瑞金,等.Alcalase水解丝素蛋白的特性[J].纺织学报,2007,28(5):13-15. ZHOU Fengjuan, XU Shiying, YANG Ruijin, et al. Properties of alcalase hydrolyzing silk fibroin[J]. Journal of Textile Research,2007,28(5):13-15.
[7]黄雷,王学英,崔霞,等.酶法水解丝素蛋白最佳条件的研究[J].安徽农业科学,2006,34(3):428-429. HUANG Lei, WANG Xueying, CUI Xia, et al. Optimum condition of silk fibroin hydrolysed with enzymes[J]. Journal of Anhui Agricultural Sciences,2006,34(3):428-429.
[8]李圣春,张学松,徐水.丝素肽开发应用及其前景[J].蚕学通讯,2008,28(4):39-43. LI Shengchun, ZHANG Xuesong, XU Shui. Preparation and application of fibroin peptide and the prospect of its development[J]. Newsletter of Sericultural Science,2008,28(4):39-43.
[9]解谷声.丝素用氯化钙/乙醇水溶液溶解[J].辽宁丝绸,1999(3):39-40. XIE Gusheng. Fibroin dissolved with CaCl2-C2H5OH-H2O solution[J]. Liaoning Silk,1999(3):39-40.
[10]何静,吴玉英,于先茸,等.金甲陆虾蛋白酶水解液水解度的测定[J].北京林业大学学报,1997,19(2):84-87. HE Jing, WU Yuying, YU Xianrong, et al. Determination of degree of hydrolysis of land shrimp proteins enzyme hydrolytic liquid[J]. Journal of Beijing Forestry University,1997,19(2):84-87.
[11]ADLER-NISSEN J. Limited enzymic degradation of proteins: a new approach in the industrial application of hydrolases[J].Journal of Chemical Technology and Biotechnology,1982,32(1):138-156.
[12]SCHAGGER H, JAGOW G V. Tricine-sodium dodecyl sulfate-polyacryl-amide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J]. Analytical Biochemistry,1987,166(2):368-379.
[13]王旭,何冰芳,李霜,等.Tricine-SDS-PAGE电泳分析小分子多肽[J].南京工业大学学报,2003,25(2):79-81. WANG Xu, HE Bingfang, LI Shuang, et al. Analysis of low molecular peptides by Tricine-SDS-PAGE[J]. Journal of Nanjing University of Technology,2003,25(2):79-81.
[14]江龙法,钱志刚,杨海麟,等.用于分离小分子肽的凝胶电泳的改进研究[J].化学世界,2007(4):200-202. JIANG Longfa, QIAN Zhigang, YANG Hailin, et al. Improvement on gel electrophoresis method for separating small molecule polypeptide[J]. Chemical World,2007(4):200-202.
[15]李莹,刘敏,崔春,等.酱油抗氧化能力评价及聚类分析[J].食品与发酵工业,2008,34(1):14-19. LI Ying, LIU Min, CUI Chun, et al. Antioxidant activity assessmemt and cluster analysis of retail soy sause products[J]. Food and Fermentation Industries,2008,34(1):14-19.
[16]Manosroi1 A, Boonpisuttinant K S, Manosroi W et al. Free radical scavenging and tyrosinase inhibition activity of oils and sericin extracted from Thai native silkworms(Bombyx mori)[J]. Pharmaceutical Biology,2010,48(8):855-860.
Preparation of Silk Fibroin Peptide and Study on Its Free Radical Scavenging Property
ZHANG Kai, SONG Xiyu, XIE Kongliang
(College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai 201620,China)
Silk fibroin peptide (SFP) is the basic composition of silk fibroin protein. It has important potential application in textile and biotechnology. In this paper, ternary solvent dissolution method and protease Alcalase hydrolysis were adopted to hydrolyze silk to gain fibroin peptide with certain molecular weight. Ninhydrin colorimetric method and SDS-PAGE were used to determine hydrolysis degree of Alcalase protease and molecular weight distribution of fibroin peptide. The optimal process of Alcalase alkaline proteinase hydrolysis was determined by orthogonal experiment: silk fibroin concentration 4%, mass-volume concentration of enzyme dosage and substrate 2.0%, pH value 8, hydrolysis temperature 55 ℃,and time 6 h. Under the best process of enzyme hydrolysis, hydrolysis degree of hydrolysate was 18.3%, and molecular weight distribution of fibroin peptide was between 5 kD and 14 kD. The scavenging property of silk fibroin peptide on DPPH free radical was investigated in this paper. The results show that 1.85 mg/mL fibroin peptide could scavenge 50% DPPH free radical. SFP showed good free radical scavenging property. This paper offers certain theoretical basis for developing SFP functional materials.
silk fibroin; hydrolysis degree; ninhydrin colorimetric method; sds-page gel electrophoresis; free radical scavenging
2015-03-10;
2015-06-26

TS149
A
1001-7003(2015)10-0001-06 引用页码: 101101
doi.org/10.3969/j.issn.1001-7003.2015.10.001
