Lewis大鼠急慢性期风湿性心脏炎模型的比较
2015-05-11李文婷曾志羽郑慧蕾黄伟强
李文婷,曾志羽,桂 春,郑慧蕾,李 靖,韦 恒,文 宏,黄伟强
(广西医科大学第一附属医院,南宁 530021)
Lewis大鼠急慢性期风湿性心脏炎模型的比较
李文婷,曾志羽,桂 春,郑慧蕾,李 靖,韦 恒,文 宏,黄伟强
(广西医科大学第一附属医院,南宁 530021)
目的比较3种急慢性期风湿性心脏炎模型,找出理想的动物模型。方法抗原Ⅰ、Ⅱ分别为灭活溶血性链球菌(GAS)与完全弗氏佐剂(CFA)、不完全弗氏佐剂(IFA)混合的乳化剂。Lewis雌鼠随机分成四组:实验A、B、C组首次后足垫注射0.2 mL抗原Ⅰ,随后分别注射抗原Ⅰ、Ⅱ、未灭活GAS免疫刺激建立模型,对照组D组分别对应ABC组各6只,GAS替换为生理盐水免疫刺激。于第7、12、24周末处死每组各6只,行血液生化及心脏HE染色检查。结果 C组死亡率25%;A组心脏炎发生率最高,12周A、C组急性期损伤心肌、瓣膜弥漫性炎症细胞浸润,心肌间质风湿细胞聚集,较B组明显;24周慢性期损伤A组瓣膜纤维化程度及比率较B、C组高;D组心肌、瓣膜均无病理改变。结论 A组CFA与GAS1:1混合乳化剂免疫大鼠5次,之后GAS连续刺激,能为急慢性期风湿性心脏病的实验研究提供较好的可复制的动物模型。
A族溶血性链球菌;Lewis大鼠;风湿性心脏炎;风湿性心脏病
风湿热由革兰阳性A组乙型溶血性链球菌(GAS)咽部感染所引起,长期、反复发作的风湿热最终导致30% ~40%的病人严重并发症风湿性心脏病(RHD)的发生[1]。近年来在发展中国家和一些发达国家贫困地区,风湿性心脏病的发病率、致残率及致死率仍然较高[2],给人们的生活和经济带来了沉重的负担[3-4],但其发病机制和有效防治策略尚未完全明确,且目前没有稳定并能被广泛应用的风湿性心脏病动物模型供后续的研究。本研究采用三种造模方法对急慢性期风湿性心脏炎成模率进行比较,为RHD的实验研究提供较为理想的动物模型。
1 材料和方法
1.1 实验动物和主要试剂
8周龄SPF级Lewis雌性大鼠78只,体重150~180 g,购自北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】,动物饲养于广西医科大学动物中心SPF(specific pathogen free,SPF)级实验动物房【SYXK(桂)2014-0003】。完全弗氏佐剂、不完全弗氏佐剂均购自Sigam公司。
1.2 细菌培养、灭活
复苏-20℃甘油中的A组乙型溶血性链球菌标准菌株,接种于羊血平皿上,37℃培养48 h,见细菌生长良好,刮取菌落接种于 1L脑心浸液(Biomerieux,法国)中,37℃,110 r/min快速震荡培养24 h,4000 r/min,5 min离心收取细菌。灭菌生理盐水洗涤3次,挑取细菌接种于羊血平皿培养,48 h后观察无杂菌。均分细菌悬液,一份储存于4℃,一份离心后于10 mL 40 g/L多聚甲醛溶液中灭活6 h,洗涤5次并再次挑取细菌接种于羊血平皿培养,48 h后观察无细菌生长。
1.3 抗原制备
①配制目标浓度细菌悬液:酶标仪600 nm波长检测相应灭活菌悬液OD值,根据公式Y(细菌总数)Y=51.102X(OD值)-3.931[5]检测细菌悬液浓度(×108CFU/mL),并配置成浓度1×1011菌落形成单位(colonyforming unit,CFU)/mL悬液,置于冰中超声破碎;②制备抗原:无菌条件下,灭活细菌悬液分别与弗氏完全佐剂(CFA)、弗氏不完全佐剂(IFA)按1∶1混合,超声细胞破碎仪乳化(40%,4 mL,10 min)制备成抗原Ⅰ、抗原Ⅱ;取浓度为1× 1011CFU/mL活菌悬液即为抗原Ⅲ。
1.4 模型诱导方法
实验A、B、C组,对照组D组:A、B、C组各有大鼠18、18、24只,分别首次后足垫(掌面皮下)注射抗原Ⅰ0.2 mL。初次足垫部位免疫后,A、B组每周1次于腹部皮下注射抗原Ⅰ0.5 mL共4次,第5周A组(CFA组)给予灭活GAS,B组(IFA组)给予抗原Ⅱ,量及部位同前,C组(活菌组)每周1次于尾静脉注射抗原Ⅲ(活菌)0.5 mL共4次,第5周始不予任何处理。对照组D组18只,每6只对应各实验组,同样方法注射,将GAS换成生理盐水。
1.5 实验室检查
观察大鼠体征,分别于第7、12、24周末水合氯醛腹腔注射麻醉后解剖动物,每次每组6只。取眼球后静脉血测抗链球菌溶血素O(ASO)、类风湿因子(RF)、超敏C-反应蛋白(CRP),检测方法采用免疫比浊法,试剂购自上海执诚生物科技股份有限公司。取心脏于中性福尔马林固定,按常规石蜡切片和HE染色,进行病理观察。
1.6 统计方法
所有数据均以均数±标准差(x-±s)表示,统计软件使用SPSS16.0,用单因素方差分析及两独立样本资料的t检验进行统计学处理,以P<0.05为差异具有统计学意义。
2 结果
2.1 C组24只,存活18只,死亡率25%,死亡大鼠不被列入观察对象。初次免疫后,各组大鼠后足部出现红肿热,2周后消失,实验A、B、C组于之后的免疫过程中出现其它关节部位红肿,未见畸形。
2.2 实验室检查
A、B、C、D各组大鼠第7、12、24周CRP均为阳性,RF为阴性,各组检测结果比较差异无统计学意义(均P>0.05)。A、B、D组各时间段ASO均为阴性,C组ASO第7、12周为阳性,24周为阴性,较D组明显增高(P<0.05)(表1)。
2.3 心脏组织病理结果
D组心肌、瓣膜均未见有病理改变(表2及彩插5图1)。A、B、C各组第7、12、24周心肌和瓣膜均有炎性改变,但发生率不同。A组心肌炎和瓣膜炎发生率均较其它组高(表2),7周各组心肌细胞间质水肿,有散在淋巴细胞、浆细胞浸润,偶见黏液样变性(彩插6图2a)。12周A、C组可见心肌及瓣膜弥漫性炎症细胞浸润(彩插6图2b,c),心肌细胞间质血管旁风湿细胞聚集(彩插6图2d),B组心肌及瓣膜炎症细胞浸润程度未及A、C组明显,多呈散在分布,1只出现风湿细胞聚集。24周A组6只中5只瓣膜纤维化(表2及彩插6图2e,f),B、C组瓣膜纤维化不明显。
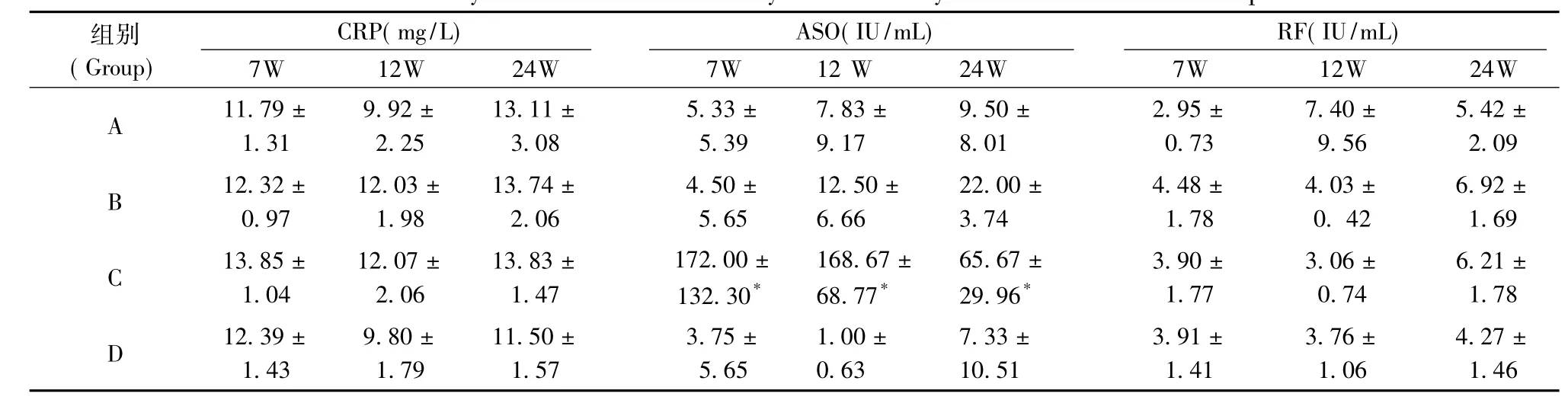
表1 不同时间段四种免疫方法诱导大鼠各项实验室检查Tab.1 Laboratory results of rats induced by four immunity methods at different time periods

表2 不同时间段Lewis大鼠心肌炎和瓣膜炎发生率比较Tab.2 Comparation of incidence of myocarditis and valvulitis in Lewis rats at different time periods
3 讨论
本研究中采用的Lewis大鼠属近交系,具有高度纯合,个体差异小,重复性好等优势,而且对于自身免疫性疾病易感,此外,RHD患者多为女性,因此选择雌性Lewis大鼠较适合于风湿性心脏病动物模型研究。大鼠首次接受免疫后足部红肿热,2周后消失,之后的实验过程中对侧后足部甚至前肢出现红肿,无畸形,该体征与风湿热多发性关节炎有很大的相似度。CRP各组均为阳性,主要考虑为皮下注射对大鼠自身的刺激所引起,RF均为阴性,此二者对风湿热的诊断不具特异性。C组ASO在第7、12周检测为阳性,第24周为阴性但较其它组增高,A、B组采用无活性GAS免疫未能引起ASO增高,而C组尾静脉注射未灭活的GAS,在急性期ASO增高,非风湿活动期降低为阴性。仅从生化检查分析,C组较为符合急慢性期风湿性心脏炎发生发展结果。
风湿病根据病变发展过程大致分为以下三期:变质渗出期,增生期,瘢痕期。前二者属于急性期心脏病理损伤,后者瘢痕期即心脏纤维化期属于慢性期损伤。虽然在风心病动物模型制造方面国内外有一些探索性的研究,但很少且不全面。Cunningham MW工作组[6]首次通过腹腔注射重组链球菌M6蛋白免疫Lewis大鼠,大鼠17 d后出现心脏炎,证实了Lewis大鼠诱导风湿性心脏病的可行性,但是发生率较低。Lymbury RS等[7]用链球菌M5蛋白保守区肽段于Lewis大鼠上诱导出心瓣膜炎,但未见典型风湿细胞。此两种方法证实在诱发实验性风湿性心脏炎过程中M蛋白发挥的重要作用,但没有考虑到 GAS抗原完整性的影响。Brimberg L等[8]用GAS抗原与CFA混合乳化剂成功诱导大鼠类似儿童链球菌感染后神经系统损伤性舞蹈病。这一系列动物模型验证了保持GAS抗原完整的重要性,风心病的发生是因GAS抗原的长久而持续的刺激所引起,所以对于以上造模方法需要进行改良。本研究利用了链球菌抗原的完整性,A组即CFA组类似于余步云[9]的方法,但是增加了乳化剂腹部皮下免疫的次数,动物模型实验结果较为满意,7周处死的大鼠心肌组织见黏液样变性,淋巴细胞、浆细胞、单核细胞浸润呈散在或灶状分部,发生心肌炎及瓣膜炎的概率为83.3%(5/6)、100% (6/6),12周发生心肌炎及瓣膜炎的概率均为100%,12周心肌间质血管旁见风湿细胞聚集,24周大鼠6只中有5只瓣膜纤维化,表明急慢性期风湿性心脏炎已成功诱导。据报道CFA能够促使大量IL17产生[10-11],而IL17对自身免疫性疾病的发生发展有很大影响[12],从结果分析来看,加大佐剂CFA的刺激次数后,CFA组成模率已较余步云[9]大大提高,无论是急性期心肌炎及瓣膜炎的发生率,还是慢性期大鼠心脏瓣膜纤维化发生率及程度,并且较为符合临床风湿性心脏病的发展历程。
此外,本研究 B组即 IFA组,于第4周给予GAS+CFA乳剂刺激之后,第5周开始每周持续给予GAS+IFA乳剂免疫Lewis大鼠,第7、12周处死的6只大鼠中4只出现心脏炎,但炎症细胞呈散在分布,12周大鼠1只心肌间质有类似风湿细胞,24周大鼠2只发生少量瓣膜纤维化。或许是因IFA能增加IL10大量分泌[10-11],且Yang S等[13]的自身免疫心肌炎体外研究发现IL10使炎性细胞对心肌的浸润明显减少,能有效抑制抗原呈递和促炎因子释放。持久的IFA与GAS乳化剂刺激未能引起心脏瓣膜明显炎性改变,与IL10的大量分泌存在一定的关系。因此,B组并未能更好地诱导出动物风心病模型。
另外,国内外学者采用未灭活GAS来诱导风湿性心脏病动物模型,最早Unny SK等[14]采用皮内注射溶血性链球菌,但是诱导出风湿热病变却很少;之后宋志刚等[15]经家兔耳缘静脉注射GAS,并于GAS免疫后第二天肌注青霉素缓解家兔症状,但以上的探索均未能提高动物风心病的发生率。本研究实验C组中采用Lewis大鼠尾静脉注射未灭活的GAS,血清ASO检查利于A族溶血性链球菌感染的诊断,表明12周前存在风湿热活动,病理结果心肌及瓣膜于各个时间段均有不同程度病变,病理变化结合血生化检查结果提示此法诱导风湿性心脏病模型是可行的。然而,该组大鼠死亡率25%,并且多于尾静脉注射活菌后1 d死亡,主要考虑为溶血性链球菌急性感染所致,因此如何降低GAS急性感染死亡率,是否使用青霉素及其用量多少,这些问题均有待解决,因而此法尚不能作为风心病造模方法首选。
综上所述,A组完全弗氏佐剂与灭活GAS1:1混合超声乳化后免疫大鼠5次,然后给予灭活的GAS连续刺激,该造模方法所诱导的风湿性心脏病与人类该疾病相似度大,且成模率高,能为急慢性期风湿性心脏病的实验研究提供较好的可复制的动物模型。
[1]Guilherme L,Fae K,Oshiro SE,et al.Molecular pathogenesis of rheumatic fever and rheumatic heart disease[J].Expert Rev Mol Med,2005,7:1-15.
[2]Marijon E,Mirabel M,Celermajer DS,et al.Rheumatic heart disease[J].The Lancet,2012,379:953-964.
[3]Iung B,Vahanian A.Epidemiology of Acquired Valvular Heart Disease[J].Canadian Journal of Cardiology,2014,30:962-970.
[4]Manjunath CN,Srinivas P,Ravindranath KS,et al.Incidence and patterns of valvular heart disease in a tertiary care highvolume cardiac center:a single center experience[J].Indian Heart J,2014,66:320-326.
[5]罗映辉,邬国军,余俊龙,等.细菌繁殖与计数新方法的实验研究[J].实用预防医学,2003,10:828-829.
[6]Quinn A,Kosanke S,Fischetti VA,et al.Induction of autoimmune valvular heart disease by recombinant streptococcal m protein[J].Infect Immun,2001,69:4072-4078.
[7]Lymbury RS,OliveC,PowellKA,etal.Induction of autoimmune valvulitis in Lewis rats following immunization with peptides from the conserved region of group A streptococcal M protein[J].J Autoimmun,2003,20:211-217.
[8]Brimberg L,Benhar I,Mascaro-Blanco A,et al.Behavioral,Pharmacological, and Immunological Abnormalities after Streptococcal Exposure:A Novel Rat Model of Sydenham Chorea and Related Neuropsychiatric Disorders [ J].Neuropsychopharmacology,2012,37:2076-2087.
[9]Xie XJ,Zhou HJ,Huang JL,et al.An animal model of chronic rheumatic valvulitis induced by formalin-killed streptococci[J].Rheumatology International,2010,30:1621-1625.
[10]Nikoopour E,Schwartz JA,Huszarik K,et al.Th17 Polarized Cells from Nonobese Diabetic Mice Following Mycobacterial Adjuvant Immunotherapy Delay Type 1 Diabetes[J].Journal of Immunology,2010,184:4779-4788.
[11]Yoshizaki A,Yanaba K,Ogawa A,et al.Immunization With DNA Topoisomerase I and Freund’s Complete Adjuvant Induces Skin and Lung Fibrosis and Autoimmunity via Interleukin-6 Signaling[J].Arthritis and Rheumatism,2011,63:3575-3585.
[12]Komiyama Y,Nakae S,Matsuki T,et al.IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis[J].Journal of Immunology,2006,177:566-573.
[13]Yang S,Li W,Liu W,et al.IL-10 gene modified dendritic cells induced antigen-specific tolerance in experimental autoimmune myocarditis[J].Clin Immunol,2006,121:63-73.
[14]Unny SK,Middlebrooks BL.Streptococcal rheumatic carditis[J].Microbiol Rev,1983,47:97-120.
[15]宋智钢,刘维永,晏培松,等.实验性风湿性心脏炎动物模型的建立[J].第四军医大学学报,2002,23:1853-1856.
A comparative study of different animal model of acute and chronic rheumatic carditis in Lewis rats
LI Wen-ting,ZENG Zhi-yu,GUI Chun,ZHENG Hui-lei,LI Jing,WEI Heng,WEN Hong,HUANG Wei-qiang
(The First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China)
Objective To make comparisons of the three models of acute and chronic rheumatic carditis to find out an optimal animal model.Methods AntigenⅠwas a emulsifier mixed by complete freund’s adjuvant(CFA)and Group A streptococcus(GAS).AntigenⅡwas mixed by incomplete freund’s adjuvant(IFA)and GAS.Female Lewis rats were randomly divided into four groups:A,B,C treatmeat groups were immuned with antigenⅠat the foot pad firstly.Subsequently,rats in group A、B、C were injected antigenⅠ,antigenⅡand activated GAS respectively to make the models of RHD.Rats in control group D were immunized with the same protocol outlined as treatment groups but without GAS.Respectively 7,12,24 weeks the rats were sacrificed 24(each group was 6).The blood biochemical item and Hematoxylin-eosin(HE)staining of hearts were detected.Results In group C the mortality was 25%.In group A,the incidence of carditis was the highest.Histopathological manifestations of group A,C was not only revealed acute damage such as inflammatory cell infiltrate as well as group B,but also the Aschofflike cells in the myocardial cells interstitial.But in group A and C there had a great degree of the inflammatory cells infiltration than group B.At 24th week rats in group A detected the rate and degree of valve fibrosis in chronic damage were higher than group B and C.None of rats in group D presented carditis or valvulitis.Conclusion In group A,giving the GAS with continuous stimulation after using the mixedemulsification of CFA and GAS to immune Lewis rats for five times was a appropriate method which could provide an optimal animal model for experimental study of acute and chronic rheumatic heart disease.
Group A streptococcus;Lewis rat;Rheumatic carditis;Rheumatic heart disease
R-332
A
1671-7856(2015)07-0030-04
10.3969.j.issn.1671.7856.2015.007.007
国家自然科学基金(81260067)。
李文婷(1988-),女,硕士生,专业:心血管内科学。Email:lwt2010liebe@163.com。
曾志羽(1965-),男,主任医师,研究方向:心血管疾病诊治与研究。Email:zhiyuzeng@163.com。
2015-06-10
