不同条件环磷酰胺建立小鼠免疫力低下模型的比较及偏最小二乘法(PLS)数学建模分析
2015-05-11侯衍豹孙启慧王桂美张成博
高 敏,侯衍豹,杨 勇,2,孙启慧,王桂美,张成博
(1.山东中医药大学,济南 250355;2.山东省经方研究重点实验室,济南 250355)
不同条件环磷酰胺建立小鼠免疫力低下模型的比较及偏最小二乘法(PLS)数学建模分析
高 敏1,侯衍豹1,杨 勇1,2,孙启慧1,王桂美1,张成博1
(1.山东中医药大学,济南 250355;2.山东省经方研究重点实验室,济南 250355)
目的通过比较4种不同剂量、周期的环磷酰胺建立小鼠免疫力低下模型,并采用偏最小二乘法(PLS)建模分析筛选出最优方案。方法 雄性昆明小鼠58只随机分成5组,分别为正常组10只,每日注射生理盐水;模型1组12只,按照40 mg/kg的剂量连续注射环磷酰胺溶液10 d;模型2组12只,按照80 mg/kg的剂量连续注射环磷酰胺溶液3 d;模型3组12只按照40 mg/kg的剂量注射2次环磷酰胺溶液,每次间隔(2~3)d;模型4组12只按照50 mg/kg的剂量连续注射环磷酰胺溶液7 d。监测不同剂量和不同周期给予小鼠环磷酰胺后,模型小鼠的饮食、饮水、体重等日常代谢指标的变化;测定小鼠胸腺、脾等脏器指数以及血常规等免疫指标的变化;采用SIMCA-P软件处理小鼠的终体重、终肛温、脏器指数、血常规等指标,应用偏最小二乘法(PLS)综合评价免疫力低下小鼠模型的建立。结果 与正常组相比,模型组小鼠体重和肛温降低且差别有显著性意义(P<0.05);日平均饮食、饮水量降低且差异有显著性(P<0.01);脾指数和胸腺指数降低且差别有极显著性意义(P<0.01);模型组嗜碱细胞绝对值和嗜碱细胞百分比均降低且差异有显著性(P<0.05),模型组平均RBC血红蛋白浓度、大血小板比率均升高且有显著性差异,模型1组、模型2组、模型4组的白细胞、淋巴细胞绝对值均降低且差异有显著性(P<0.05)。PLS分析处理表明,模型1组、模型2组、模型4组与正常组比较差异都具有显著性(P<0.01),其中模型1组差异最大。结论 通过PLS分析方法综合不同指标,模型1组按照40 mg/kg的剂量连续注射10 d为最佳造模方法,为建立稳定的免疫力低下模型提供实验依据。
环磷酰胺;免疫抑制;血常规;数学建模;免疫力低下模型
免疫力是人体识别和排除异己的生理反应,维护体内环境稳态,抵抗外来侵袭的能力。免疫力低下是免疫系统不能正常发挥保护作用,导致人体极易招致细菌、病毒、真菌等感染而患病。免疫系统是抵御病原菌侵犯最重要的保卫系统,由免疫器官(骨髓、脾脏、胸腺、淋巴结)、免疫细胞(淋巴细胞、单核吞噬细胞、中性粒细胞、嗜碱粒细胞、嗜酸粒细胞、肥大细胞)、血小板以及免疫分子组成。环磷酰胺是临床上常用的一种广谱抗肿瘤药,可干扰DNA及RNA功能,它与DNA发生交叉联结,抑制DNA合成,导致细胞死亡。环磷酰胺具有较强的免疫抑制功能,是建立免疫抑制动物模型的常用阳性药物[1]。
偏 最 小 二 乘 回 归 (Partial least-squares regression,PLS)是一种新型的多元统计数据分析方法,主要用来解决多元回归分析中的变量多重相关性或解释变量多于样本点等实际问题,理论研究进展非常迅速,其应用不断扩展,涉及化工、机械、生物、医学、药物学等领域[2]。本研究是通过监测环磷酰胺4种不同用药剂量和用药周期对模型小鼠体重、肛温、小鼠脏器指数、血常规等指标影响变化,采用SIMCA-P软件的偏最小二乘法回归(PLS)进行数据统计建模分析,通过PLS分析方法对免疫抑制模型进行综合评价,来确定建立小鼠免疫抑制的最佳条件,为建立稳定的免疫力低下的动物模型提供实验依据。
1 材料和方法
1.1 实验材料
1.1.1 动物:昆明小鼠,雄性,(20±2)g,SPF级,由山东鲁抗动物实验中心提供,动物许可证号SCXK(鲁)20080002,室温(22±4)℃,相对湿度65%~70%。使用许可证号:SYXK(鲁)20130002。
1.1.2 试剂与药物 注射用环磷酰胺(江苏恒瑞医药股份有限公司,批号H32020857);氯化钠注射液(辰欣药业股份有限公司,批号1309222143)。
1.1.3 仪器智能恒温控制仪(成都泰盟科技有限公司),01193-YP601N型电子天平(上海精密科学仪器有限公司),XS1000i血液分析仪(日本Sysmex公司)。
1.2 实验方法
1.2.1 动物分组:小鼠适应性饲养3 d后按体重随机分成正常组(10只)、4个模型组(各12只)。
1.2.2 造模方法:环磷酰胺干粉用生理盐水稀释配成8 mg/mL浓度的环磷酰胺溶液,现用现配。采用腹腔注射,正常组每日注射生理盐水;模型1组按照40 mg/kg的剂量连续注射环磷酰胺溶液10 d;模型2组,按照80 mg/kg的剂量连续注射环磷酰胺溶液3 d;模型3组按照40 mg/kg的剂量注射2次环磷酰胺溶液,每次间隔(2~3)d;模型4组按照50 mg/kg的剂量连续注射环磷酰胺溶液7 d。
1.2.3 测量指标:造模过程中每天测量并记录各组小鼠体温、体重、饮食重量、饮水重量。动物处死前先称体重,解剖后称量脏器重量(包括:胸腺、脾脏、肺、心脏、肝、肾、肾上腺、睾丸、精囊腺)。计算脏器指数(脏器指数(%)=脏器重量/体重 ×100%)。动物处死前摘眼球取血,EDTA-K2抗凝管抗凝,做血常规分析。
1.3 统计学方法
1.3.1 单因素方差分析:实验数据用SPSS 17.0软件统计分析,计量数据均以±s表示,组间比较采用单因素方差分析(one-way ANOVA)LSD检验,P<0.05为有统计学意义。
1.3.2 偏最小二乘法分析:采用SIMCA-P软件的偏最小二乘法(PLS)对各组数据进行分析,详细数据结果见实验结果部分。
2 结果
2.1 小鼠体重及肛温变化
2.1.1 小鼠体重和肛温的比较:由表1可见,与正常组相比,模型组小鼠的终体重都降低且均差异具有极显著性(P<0.01),模型1组小鼠的终肛温与正常组相比显著降低且差异有极显著性(P<0.01),其他组差异有显著性(P<0.05)。
2.1.2 小鼠体重的变化:由图1可见,正常组小鼠的体重持续增长;模型1组、模型2组、模型4组小鼠的体重先增长缓慢后逐渐降低,且终体重较第1天体重有不同程度的降低,自造模第4天起模型1组和模型4组与正常组比较差异出现显著性(P<0.05),第 5天开始差异出现非常显著性(P<0.01);自造模第3天起模型2组较正常组差异有显著性(P<0.05),第4天出现差异非常显著性(P<0.01);模型3组小鼠的体重增长缓慢,自第5天起模型3组与正常组相比差异出现非常显著性(P<0.01)。
2.2 小鼠饮食和饮水的变化
由图2中可以看出模型组的饮食较正常组减少,整体上模型组饮食较正常组有差异非常明显的显著性P<0.01;由图3中可以看出模型组的饮水较正常组减少,整体上模型组较正常组有差异非常明显的显著性P<0.01;
2.3 环磷酰胺对模型组免疫器官指数的影响
从图4和图5看出,环磷酰胺引起小鼠胸腺和脾脏的萎缩,使得模型组小鼠的胸腺指数和脾脏指数较正常组减小且均差异具有显著性(P<0.01)。其中模型1组、模型4组与正常组的差异尤其明显。
2.4 环磷酰胺对小鼠血液学指标的影响
由表2可见,与正常组相比,模型1组和模型4组小鼠的白细胞计数、淋巴细胞绝对值、嗜碱细胞绝对值、嗜碱细胞百分比、血小板比积均有不同程度的降低且差异具有显著性(P<0.05),单核细胞百分比、中性粒细胞百分比、平均RBC血红蛋白浓度、大血小板比率有不同程度的升高差异且有显著性(P<0.05);模型2组小鼠白细胞计数、淋巴细胞绝对值、嗜碱细胞绝对值、嗜碱细胞百分比均有不同程度的降低且差异具有显著性(P<0.05),平均RBC血红蛋白浓度、红细胞、大血小板比率有不同程度的升高且差异有显著性(P<0.05);模型3组小鼠嗜碱细胞绝对值、嗜碱细胞百分比有不同程度升高且差异有显著性(P<0.05),单核细胞百分比、血小板比积、平均RBC血红蛋白浓度、红细胞、大血小板比率有不同程度的升高且差异有显著性(P<0.05)。
表1 小鼠终体重和终肛温的比较(±s)Tab.1 ComParison of final body weight and final anal temPerature in the mice(±s)
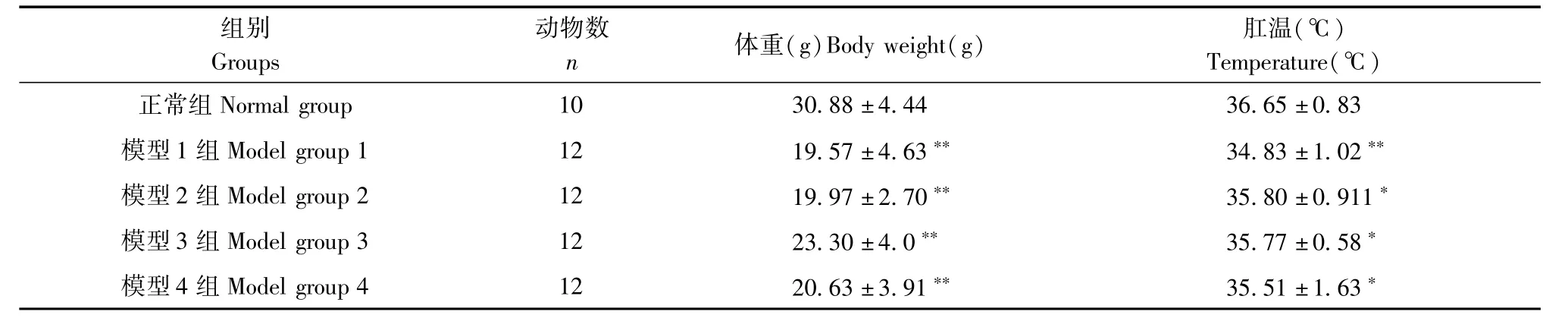
表1 小鼠终体重和终肛温的比较(±s)Tab.1 ComParison of final body weight and final anal temPerature in the mice(±s)
注:与正常组相比*P<0.05,**P<0.01Note.ComPared with the normal grouP,*P<0.05,**P<0.01.
体重(g)Body weight(g) 肛温(℃)TemPerature(℃)正常组Normal grouP 10 30.88±4.44 36.65±0.83模型1组Model grouP 1 12 19.57±4.63** 34.83±1.02**模型2组Model grouP 2 12 19.97±2.70** 35.80±0.911*模型3组Model grouP 3 12 23.30±4.0** 35.77±0.58*模型4组Model grouP 4 12 20.63±3.91** 35.51±1.63*组别GrouPs动物数n
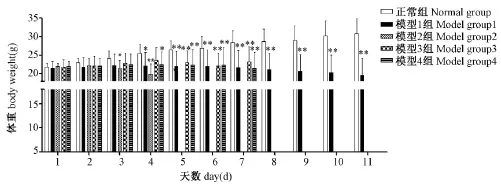
图1 环磷酰胺对模型小鼠体重的影响Note.ComPared with normal grouP,*P<0.05,**P<0.01Fig.1 Effect of CTX on the daily body weight in mice
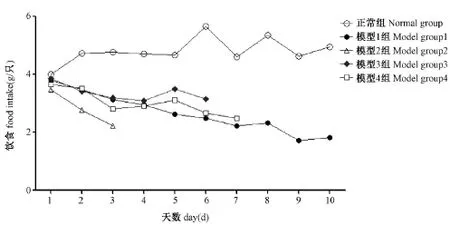
图2 环磷酰胺对模型小鼠饮食的影响Note:ComPared with the normal grouP,*P<0.05,**P<0.01.Fig.2 Effect of CTX on the food intake in mice

图3 环磷酰胺对模型小鼠饮水的影响Note.ComPared with the normal grouP,*P<0.05,**P<0.01Fig.3 Effect of CTX on the water intake in mice
表2 环磷酰胺对模型小鼠血液学指标的影响(±s)Tab.2 Effect of CTX on the haematological Parameters in mice(±s)
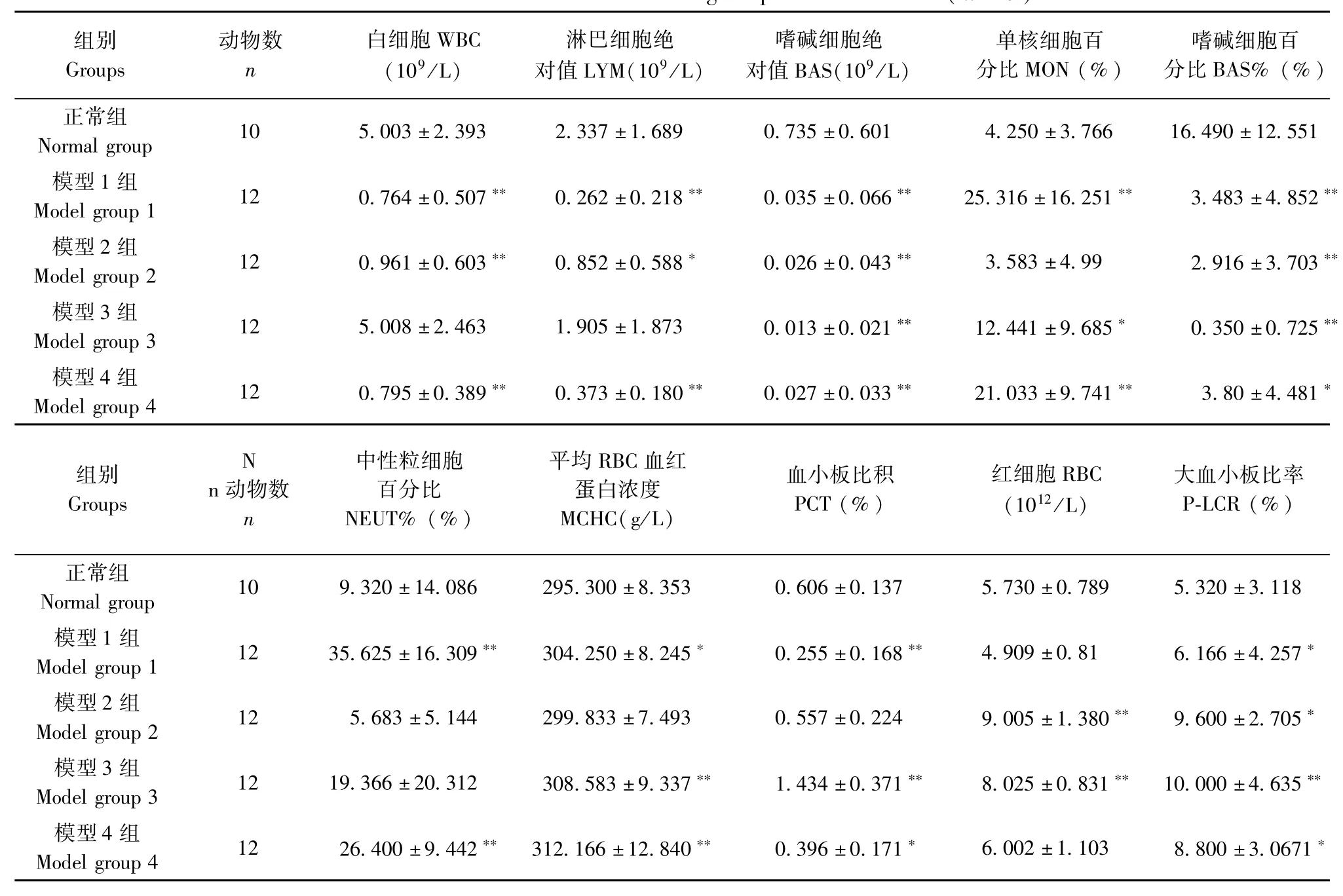
表2 环磷酰胺对模型小鼠血液学指标的影响(±s)Tab.2 Effect of CTX on the haematological Parameters in mice(±s)
组别GrouPs动物数n白细胞WBC (109/L)淋巴细胞绝对值LYM(109/L)嗜碱细胞绝对值BAS(109/L)单核细胞百分比MON(%)嗜碱细胞百分比BAS%(%)正常组Normal grouP 10 5.003±2.393 2.337±1.689 0.735±0.601 4.250±3.766 16.490±12.551模型1组Model grouP 1 12 0.764±0.507** 0.262±0.218** 0.035±0.066** 25.316±16.251** 3.483±4.852**模型2组Model grouP 2 12 0.961±0.603** 0.852±0.588* 0.026±0.043** 3.583±4.99 2.916±3.703**模型3组Model grouP 3 12 5.008±2.463 1.905±1.873 0.013±0.021** 12.441±9.685* 0.350±0.725**模型4组Model grouP 4 12 0.795±0.389** 0.373±0.180** 0.027±0.033** 21.033±9.741** 3.80±4.481*组别GrouPs N n动物数n中性粒细胞百分比NEUT%(%)平均RBC血红蛋白浓度MCHC(g/L)血小板比积PCT(%)红细胞RBC (1012/L)大血小板比率P-LCR(%)正常组Normal grouP 10 9.320±14.086 295.300±8.353 0.606±0.137 5.730±0.789 5.320±3.118模型1组Model grouP 1 12 35.625±16.309** 304.250±8.245* 0.255±0.168** 4.909±0.81 6.166±4.257*模型2组Model grouP 2 12 5.683±5.144 299.833±7.493 0.557±0.224 9.005±1.380** 9.600±2.705*模型3组Model grouP 3 12 19.366±20.312 308.583±9.337** 1.434±0.371** 8.025±0.831** 10.000±4.635**模型4组Model grouP 4 12 26.400±9.442** 312.166±12.840** 0.396±0.171* 6.002±1.103 8.800±3.0671*
2.5 采用偏最小二乘法(PLS)对各组药效综合分析
2.5.1 对本实验5个组的检测指标进行标准化处理,自变量表见表3。
2.5.2 得分图及 VIP(variable imPortance in the Projection)变量投影重要性指标(图6)。VIP变量投影重要性指标用来描述自变量对因变量的解释能力,VIP值越大,自变量x对 y的解释能力越强(图7)。
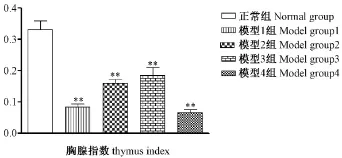
图4 环磷酰胺对模型小鼠胸腺指数的影响Note.ComPared with the normal grouP,*P<0.05,**P<0.01.Fig.4 Effect of CTX on the thymus index in mice
2.5.3 各组小鼠综合药效得分表及比较见表4,图8。
采用 SIMCA-P软件的偏最小二乘法回归(PLS)对模型小鼠的终体重、终肛温、脏器指数、血常规等指标进行数据统计建模分析,模型1组、模型2组、模型4组较正常组差异都有非常显著性(P<0.01),其中模型1组尤其明显是较佳的造模方法。
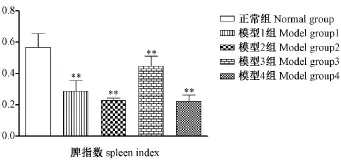
图5 环磷酰胺对模型小鼠脾指数的影响Note.ComPared with the normal grouP,*P<0.05,**P<0.01Fig.5 Effect of CTX on the sPleen index in mice
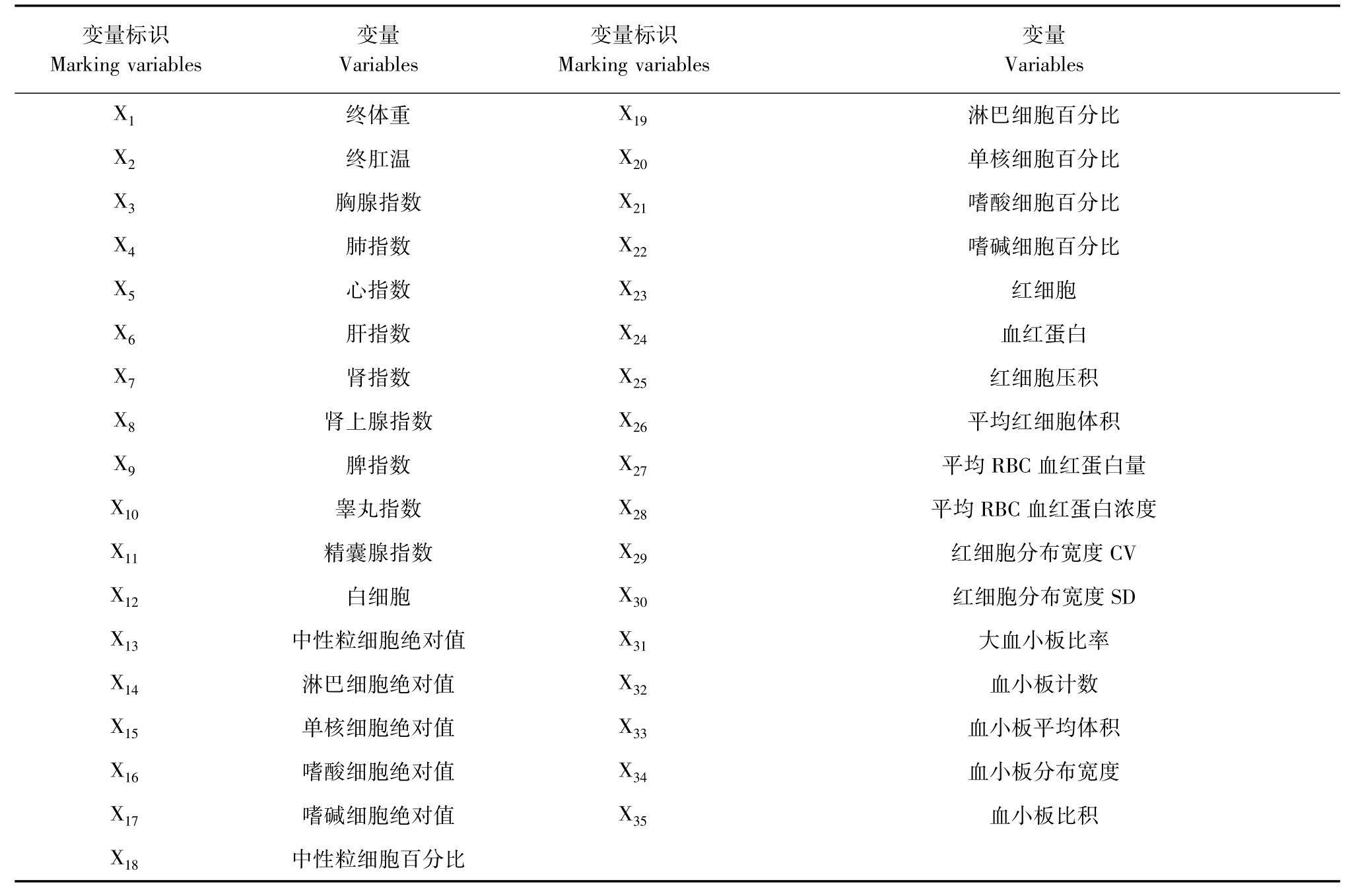
表3 自变量表Tab.3 Table of indePendent variables
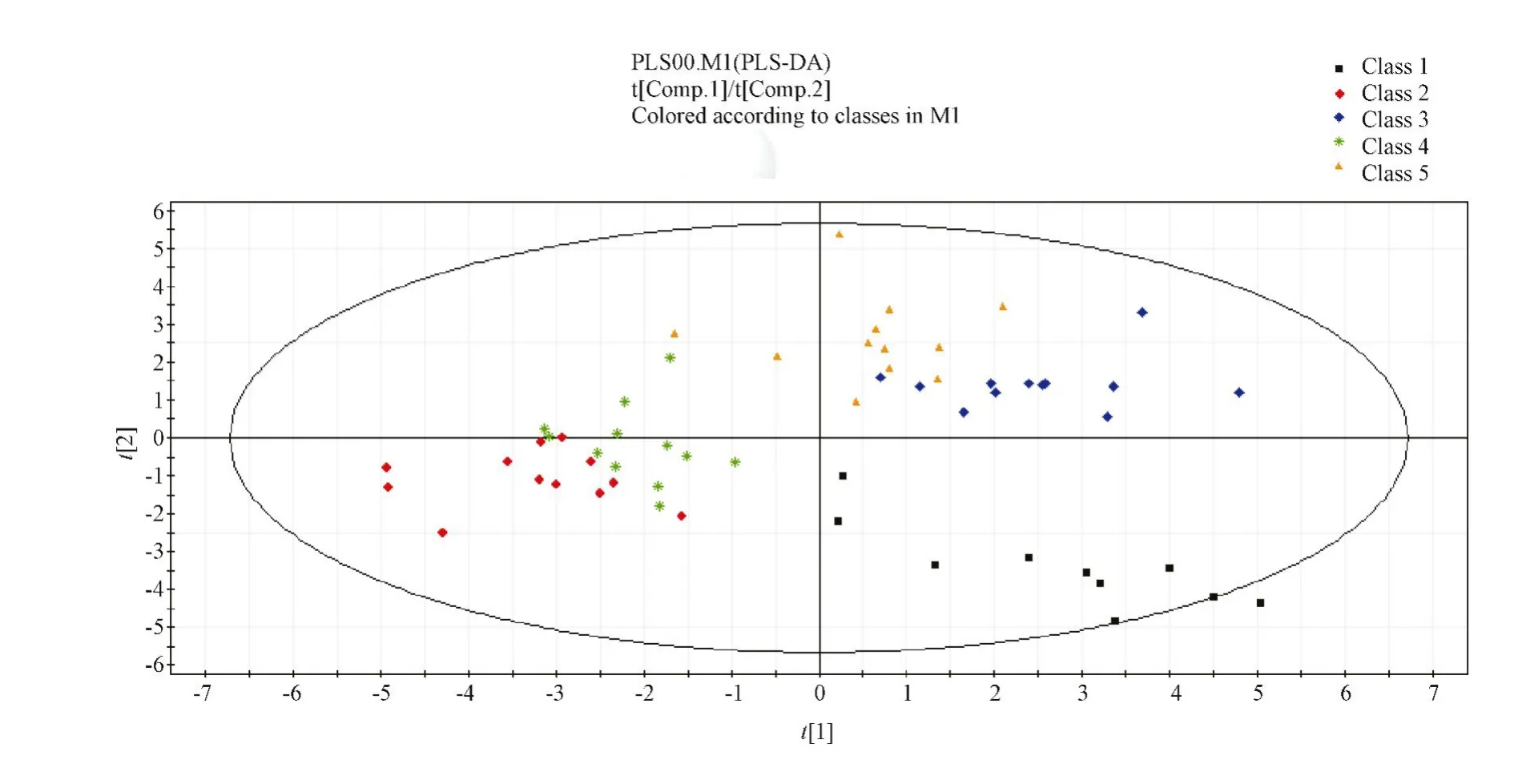
图6 各组小鼠综合得分图Note.Class1 is the normal grouP,class 2 is the model grouP 1,class 3 is the model grouP 2,class 4 is the model grouP 3,class 5 is the model grouP 4.Fig.6 General factor scores in the mice
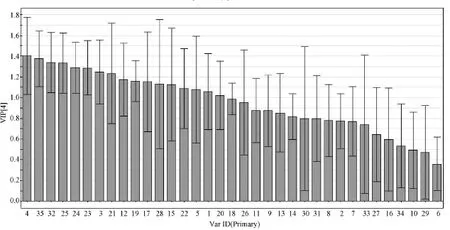
图7 正常组和模型组VIP得分图Fig.7 Scores of VIP in the mice
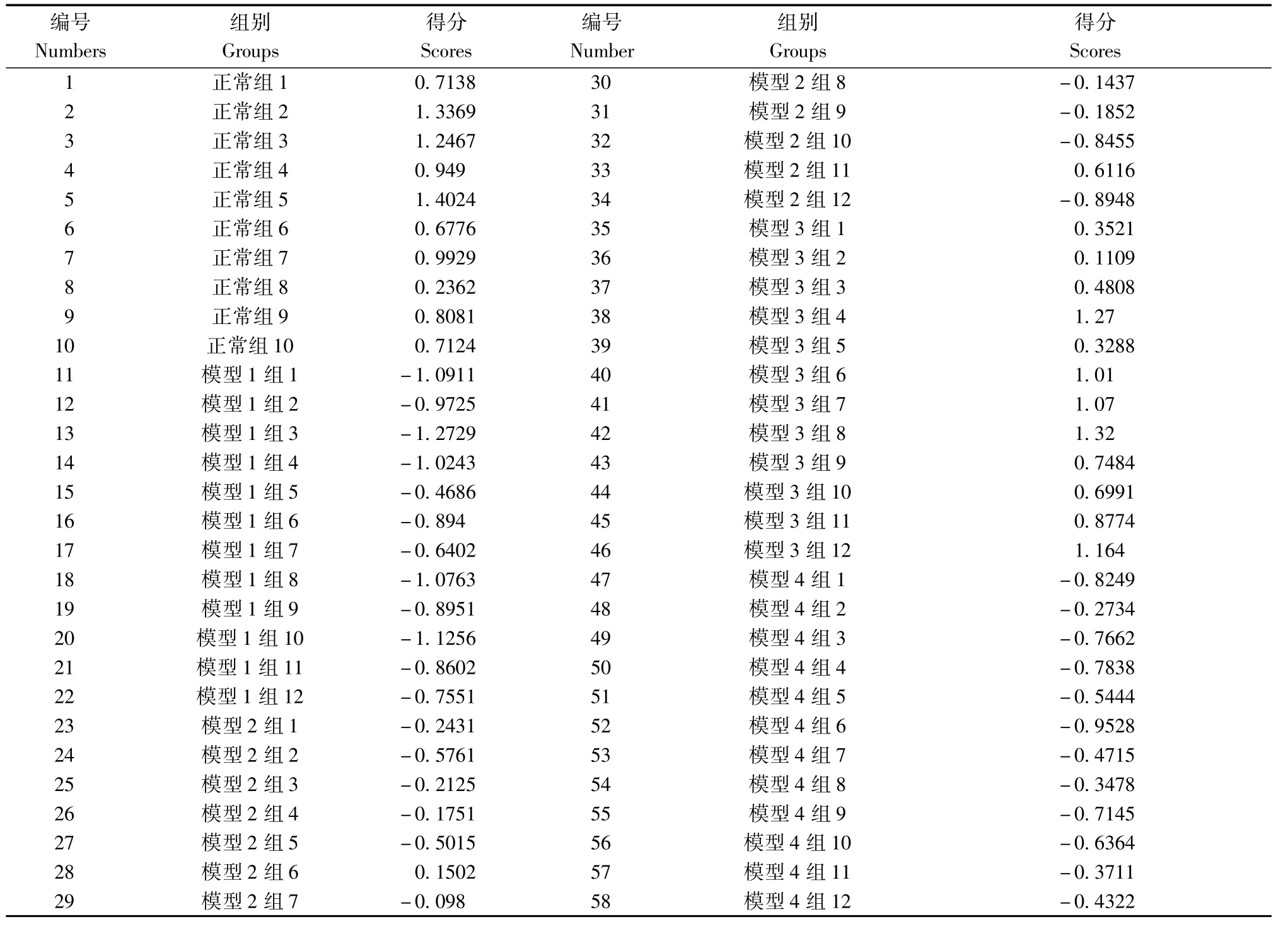
表4 各组小鼠综合药效得分表Tab.4 General factor scores in mice
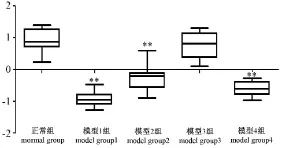
图8 各组小鼠综合药效得分比较图(±s)Note:ComPared with normal grouP,p*<0.05,p**<0.01Fig.8 ComParison of general factor scores between different grouPs(±s)
3 讨论
在免疫毒理学中,常用的免疫抑制药物有环磷酰胺、氢化可的松、地塞米松等[3,4],已有研究表明,环磷酰胺能够造成小鼠体重、免疫器官重量、白细胞计数及其淋巴细胞百分比等指标的下降,造成较为突出的免疫抑制作用[5,6],环磷酰胺其作为阳性药物是适宜的。
本实验结果显示,与正常组相比,模型组小鼠表现出精神萎靡、体毛稀疏脱落、活动减少、体重和肛温降低等状态,这和环磷酰胺建立免疫力低下小鼠的相关文献描述一致[7];环磷酰胺能损害小鼠的免疫器官,导致胸腺指数、脾指数降低;生殖系统对化学毒物的作用十分敏感,环磷酰胺长期使用会损伤生殖器官[8],使精子减少,精囊腺变小,导致小鼠精囊腺指数降低。环磷酰胺使白细胞、淋巴细胞等免疫细胞受到损害数目降低;环磷酰胺可能会引起模型小鼠的应激反应,导致红细胞数目增多;大血小板比率升高说明环磷酰胺具有明显的骨髓抑制作用,导致血小板的成熟程度降低,血小板数量减少,从而使得大血小板比率升高。
本实验的研究显示,选用环磷酰胺四种不同的剂量和周期,对于小鼠的免疫抑制的效果是不同的,通过采用偏最小二乘法(PLS)对模型小鼠的体重、肛温、脏器指数、血常规等指标进行数据统计建模,筛选出按照40 mg/kg的剂量连续腹腔注射10d为最佳造模方法。本实验为建立免疫力低下模型提供一定的依据,为以后免疫力低下的研究提供建立动物模型的参考。
[1]Pel áez B, CamPillo JA, LóPez-Asenjo JA, et al.CycloPhosPhamide induces the develoPment of early myeloid cells suPPressing tumor cell growth by a nitric oxide-dePendent mechanism[J].J Immunol,2001;166(11):6608-6615.
[2]王惠文,吴载斌.偏最小二乘回归的线性与非线性方法[M].北京:国防工业出版社.2006:9.
[3]李振鲁,白慧玲,赵粤萍,等.白癜丸对小鼠免疫功能的影响[J].医药导报,2002,21(10):619-620.
[4]陈艳芬,臧建伟,唐春萍.六味地黄汤生物制剂对氢化可的松模型的药理作用研究[J].时珍国医国药,2008,19(5):1035-1036.
[5]宋雁,贾旭东,崔文明,等.不同途径和剂量环磷酰胺建立小鼠免疫抑制模型的对比研究[J].中国食品卫生杂志.2013,25(3):218-225.
[6]齐丽娟,宋雁,王伟,等.用环磷酰胺建立免疫抑制动物模型[J].卫生研究,2010,39(3):313-315.
[7]周立峰,邱玉华,程刚,等.圣愈汤对环磷酰胺诱导的免疫力低下小鼠T细胞亚群和细胞因子的影响[J].现代实用医学,2009,21(8):808-813.
[8]贾庆军,刘天鹏,郭魁亮,等.环磷酰胺对小鼠遗传和生殖毒性影响的研究(2)—对雄性小鼠生殖细胞的影响 [J].白求恩军医学院学报,2006,4(2):70-71.
Cyclophosphamide-induced immunosuppressive mouse models established under different conditions and mathematical modeling analysis with partial least squares
GAO Min1,HOU Yan-bao1,YANG Yong1.2,SUN Qi-hui1,WANG Gui-mei1,ZHANG Cheng-bo1
(1.Shandong University of Traditional Chinese Medicine,Jinan 250355;2.Key Laboratory of Shandong Classical PrescriPtion Research,Jinan 250355)
Objective ComParingfourgrouPsofimmunosuPPressivemousemodelsestablished by cycloPhosPhamide administration in different doses and Periods,we used Partial least squares(PLS)analysis to evaluatethe immunosuPPressive mouse models comPrehensively and select the aPProPriate way to establish this model.Methods In this exPerimental study,58 male KM mice were randomly divided into five grouPs:normal grouP(10 mice)were given normal saline daily by i.P.injection,model grouP 1(12 mice)was given 40 mg/kg CTX daily by i.P.injection for 10 days,model grouP 2(12 mice)was given 80 mg/kg CTX daily by i.P.injection for 3 days,model grouP 3(12 mice)was given 40 mg/kg CTX daily by i.P.injection twice for a week,model grouP 4(12 mice)was given 50 mg/kg CTX daily by i.P.injection for 7 days.After the injection of cycloPhosPhamide,the daily metabolic activities were detected everyday such as body weight,water intake,and food intake,organ index and immunological indexes such as blood RT of the model mice were measured as well.Using Partial least squares(PLS)analysis to the models and analyzing the final weight,final anal temPerature,organ index,and blood routine examination in order to evaluate the immunosuPPressive mouse models comPrehensively.Results ComPared with the normal grouP,different dosages of CTX reduced the weight and anal temPerature of model mice(P<0.05),the food intake and water intake(P<0.01),and the sPleen index and thymus index(P<0.01).Besides,the amount and Percentage of basoPhilic granulocytes decreased(P<0.05),and the Percentage of MCHC,macroPhage went uP,as well as the absolute value of WBC and lymPhocytes were decreased in the model grouPs 1,2,and 4(P<0.05).According to the PLS analysis,there were significant differences among models 1,2,and 4 when comPared with the normal grouP,esPecially the most different in the model grouP 1.Conclusions After the PLS analysis of different indexes,the oPtimal way to establish immunosuPPressive mouse models is the Procedure with 40 mg/kg CTX daily injected i.P.for ten days.Our findings Provide exPerimental evidence for the establishment of immunosuPPressive mouse models.
CycloPhosPhamide;ImmunosuPPression;Blood,routine examination;Mathematical modeling;ImmunosuPPressive mouse models
R-33 < class="emphasis_bold">【文献标识码】A
A
1671-7856(2015)09-0062-08
10.3969.j.issn.1671.7856.2015.009.012
国家自然科学基金项目(81273626);国家科技重大专项(2014ZX09509001-001);山东省高校中医药抗病毒协同创新中心资助项目(XTCX2014B-02);山东省中医药科技发展计划(2013-026)。
高敏(1989-),女,硕士研究生,从事中药及复方药理和毒理研究。E-mail:1057850512@qq.com。
杨勇,博士,副教授,从事经方的现代研究。E-mail:yy7204@163.com。
2015-07-08
