洗液对ELISA法检测梅毒螺旋体特异性抗体结果的影响
2015-05-10闫朝春
闫朝春
(连云港市东方医院检验科,江苏 连云港222042)
酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)由于灵敏度高、特异性强、重复性好、操作简单且不需要特别昂贵的仪器设备而被临床实验室广泛应用[1,2],目前梅毒螺旋体特异性抗体 (Treponema pallidum specific antibody,TPAb)的检测大多就采用此方法。ELISA法是一种固相载体包被的免疫标记检验技术,其本身存在诸多影响因素,如标本处理、试剂盒选择、温育条件、洗板方式等等[3,4],一旦哪一步操作不好,结果就有可能产生偏差。本文就ELISA法检测TP-Ab试验中的洗液对检验结果的影响进行了一番探讨,旨在寻找最佳的洗涤方式,以便规范试验操作,提高检测结果的准确性和可靠性。
1 材料与方法
1.1 标本的选择 选取TP-Ab阳性标本68例(OD>1.000),阴性标本 24 例(OD<0.010),标本均无溶血和脂血。
1.2 试剂与仪器 试剂为北京万泰生物药业股份有限公司生产的梅毒螺旋体抗体诊断试剂盒(酶联免疫法),批号为 N20140203,有效期为 2015-01;仪器为Addcare ELISA 600型酶免分析工作站,由烟台艾德康生物科技有限公司提供;质控品购自江苏省临床检验中心,规格为12mIU(2NCU)/ml,批号为201311003。
1.3 实验方法 将选取的临床阳性标本用混合血清(OD小于0.005)稀释至S/CO于0.8~1.3范围内进行试验,分别用蒸馏水、纯净水和自来水配制三种洗液,以平行试验改变三种洗液对92例样本(阴性24例,弱阳性42例,强阳性26例)进行平行试验。并以蒸馏水将洗液配制成不同浓度(浓度1:1:5,浓度 2:1:20,浓度 3:1:40,浓度 4:1:80)对 92 例样本(阴性24例,弱阳性42例,强阳性26例)进行试验。洗板过程中注液体积为350μl,均浸泡30s。
1.4 统计处理 结果在Stata 9.2统计软件包上进行处理,计量资料均数比较采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同水质的洗液对ELISA法检测TP-Ab结果的影响 纯净水组与蒸馏水组弱阳性标本的S/CO值比较无统计学差异(P>0.05),自来水组弱阳性标本的S/CO值高于蒸馏水组(P<0.05),详见表1;自来水组的阳性率分别高于蒸馏水组和纯净水组(P<0.05),而纯净水组与蒸馏水组检测阳性率无统计学差异(P>0.05),详见表 2。
2.2 以蒸馏水配制不同浓度的洗液对ELISA法检测TP-Ab结果的影响 高浓度的洗液造成试验结果OD值偏低,阳性率降低;低浓度的洗液则使OD值升高,阳性率升高。结果详见表3和表4。
2.3 不同洗液对ELISA法检测梯度浓度TP-Ab质控结果的影响 自来水配制的洗液结果高于蒸馏水,蒸馏水配制的洗液以1:20为标准,浓度越高,OD值偏低,浓度越低,OD值偏高。结果详见表5。

表1 不同水质的洗液对ELISA法检测TP-Ab的OD值变化结果
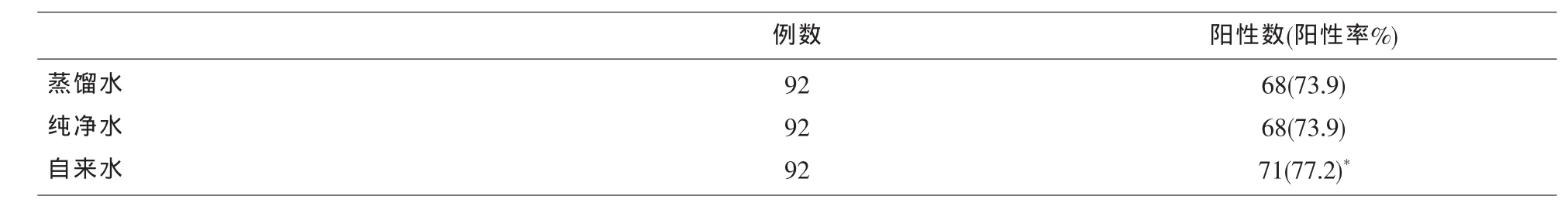
表2 不同水质的洗液对ELISA法检测TP-Ab的结果阳性率
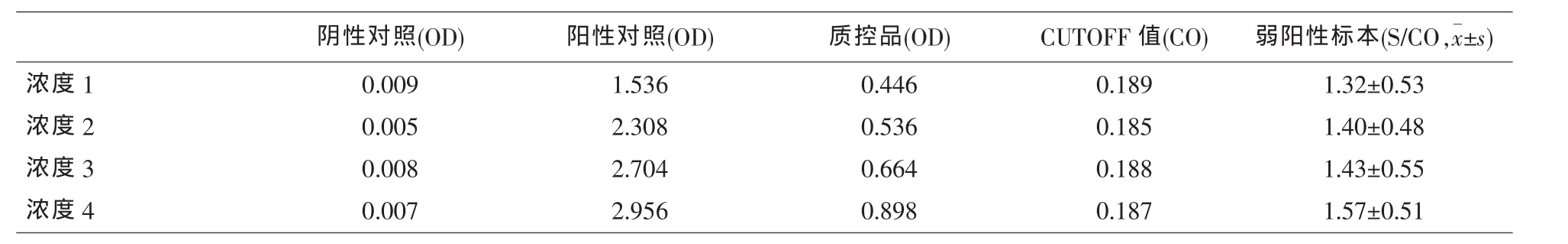
表3 不同浓度的洗液ELISA法检测TP-Ab的OD值变化结果
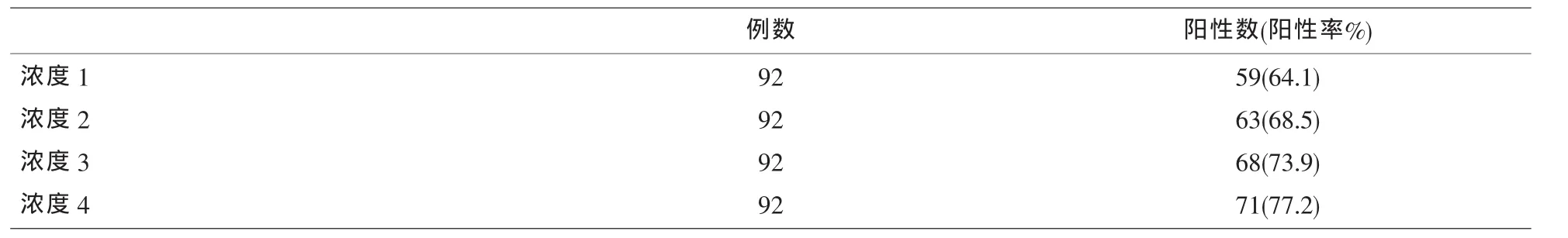
表4 不同浓度的洗液ELISA法检测TP-Ab的结果阳性率
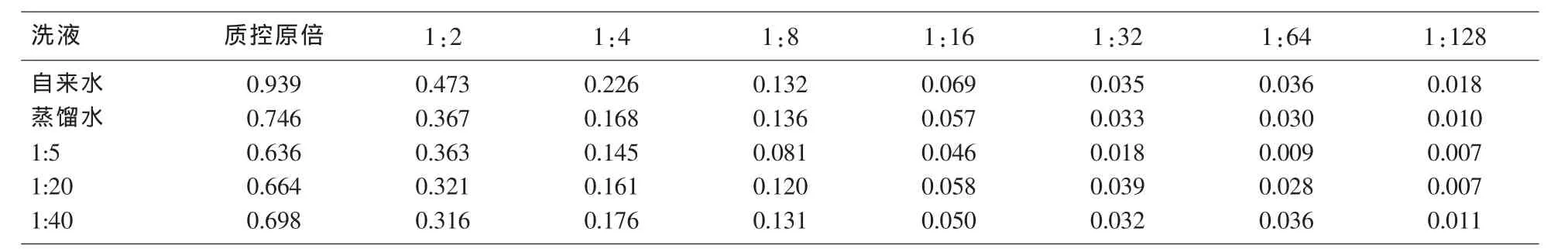
表5 不同洗液对ELISA法检测梯度浓度TP-Ab质控结果(OD值)分析
3 讨论
ELISA法操作简单,灵敏度和特异性高,但影响因素也较多,如加样量、洗板和温度等等[5]。该方法为非均相免疫测定技术,需要洗去非特异性结合或过量的抗原抗体反应物,从而保证检测结果的特异性[6],所以洗板也是其关键的一步,尤其是洗液的正确配制直接关系到洗板的质量。
TP-Ab ELISA法检测一般采用双抗原夹心法,原理是将抗原预先包被在固相载体表面,其后按不同的步骤分别加入待检抗体和酶标抗原,充分反应后经适当的洗涤,使未与固相载体上包被的抗原结合的抗原抗体-酶标抗原复合物完全洗去,待加入相应的底物后通过酶对底物的催化显色程度来对标本中的抗体进行定性或定量[2,7]。在整个试验过程中,洗涤起了重要作用,如果洗涤不充分(次数不够或洗涤不干净),残留在微孔板上的酶标抗体中的酶会使后来加的无色底物液变成有色产物,产生了非特异性显色反应,出现假阳性的结果[8,9],并且洗涤次数越少越容易造成假阳性,尤其值得注意的是,试剂盒洗液的配制是由试剂厂家反复试验验证的,人为改变洗液配制的水质及比例容易影响洗涤效果,使一些非特异性结合物没有洗掉而造成假阳性;也可能造成固相结合的抗原-抗体复合物脱离,使检测吸光度值降低造成假阴性[7]。本实验佐证了用自来水配制洗涤液比用蒸馏水配制的容易造成假阳性结果(P<0.05),而纯净水与蒸馏水无明显差异(P>0.05)。原因也许就是谢毅[10]认为的在一定范围内洗液离子强度高低与非特异性反应的出现呈负相关而影响检测结果。所以,洗液成分[4]改变会造成与固相结合的抗原/抗体脱离的程度不同,从而影响检测的灵敏度,使样本检测的OD值改变[11]。本实验中用蒸馏水配制不同浓度的洗液检测结果是高浓度的洗液造成OD值偏低,阳性率降低;低浓度的洗液则使OD值升高,阳性率升高,也证实了上述观点。也有部分实验室用自来水配制洗液,更有甚者直接以自来水代替洗液,此种做法都很危险,应引起大家足够的重视[12-15]。
[1]季育华,陶义训.影响酶联免疫吸附试验结果的操作因素[J].检验医学,2006,21(增刊)47-49.
[2]陶义训主编.免疫学与免疫学检验[M].北京:人民卫生出版社,1995:71-74.
[3]周艳萍.酶联免疫吸附试验检测法的质量控制[J].检验医学与临床,2009,6(14):1206-1207.
[4]白占杰.论酶联免疫吸附试验中影响因素解决方法[J].实验与检验医学,2012,30(2):185-186.
[5]陈仁杰,胡海燕,严银燕.ELISA一步法检测梅毒抗体钩状效应三例[J].实验与检验医学,2008,26(02):215.
[6]孙家志.2种洗板方式对HBsAg检测结果的影响[J].国际检验医学杂志,2010,31(1):92-96.
[7]马凤莲,张志民,史慧霞.增加洗板次数对HBsAb ELISA检测结果的影响[J].中国误诊学杂志,2008,8(9):2103.
[8]谭立明.ELISA法检测的影响因素及其对策[J].实验与检验医学,2013,31(4):300-305.
[9]杨娜.酶联免疫吸附试验检测影响因素探讨[J].检验医学与临床,2010,7(22):2558-2559.
[10]谢毅,宋琳,喻方敏,等.ELISA检测HBsAg的非特异反应因素分析[J].洛阳医专学报,2002,20(3):186-188.
[11]马凤莲,史惠霞.洗液成分不同对HbsAg ELISA检测结果的影响[J].中国中医药现代远程教育,2010,8(14):176-177.
[12]丁文,薛庆欢,吴文金,等.人为操作因素对酶联免疫吸附法检测乙肝病毒血清标志物影响的探讨[J].中国实验诊断学,2010,14(7):1019-1022.
[13]余晓慧.酶联免疫反应加速仪在二步法乙肝病毒表面抗原检测中的应用[J].实验与检验医学,2011,29(1):97-98.
[14]刘祖勇.增加洗板次数对HBsAg ELISA检测结果的影响[J].中国输血杂志,2006,19(2):135-136.
[15]谢碌,崔江龙,王宏碧.ELISA法对乙肝六项检测结果的影响及处理对策[J].实验与检验医学,2011,29(1):83-84.
