支原体感染后慢性咳嗽病儿FeNO水平及意义
2015-05-09乔凌燕孙广荣马少春
乔凌燕,孙广荣,马少春
(青岛市妇女儿童医院儿内科,山东 青岛 266034)
支原体感染后慢性咳嗽病儿FeNO水平及意义
乔凌燕,孙广荣,马少春
(青岛市妇女儿童医院儿内科,山东 青岛 266034)
目的 探讨肺炎支原体(MP)感染后慢性咳嗽病儿呼出气一氧化氮(FeNO)的水平及其与外周血嗜酸性粒细胞比例(EOS%)的相关性。方法 选取2014年1—12月于我院呼吸道专业门诊就诊的5~12岁慢性咳嗽病儿92例,其中MP感染58例(MP组),非MP感染34例(非MP组),以来本院体检的正常儿童30例作为正常对照组。比较各组病儿FeNO水平、肺通气功能指标及外周血EOS%,并分析MP组病儿FeNO水平与EOS%的相关性。结果 MP组病儿FeNO水平明显高于非MP组和正常对照组(F=63.187,P<0.01),外周血EOS%明显高于非MP组(t=4.708,P<0.01);MP组病儿FeNO水平与EOS%呈正相关(r=0.362,P<0.01)。MP组和非MP组病儿肺功能参数FEV1、MEF25、MEF50、MEF75比较差异均无统计学意义(P>0.05)。结论 MP感染后慢性咳嗽病儿FeNO水平升高,且其FeNO水平与外周血EOS%有一定的相关性,提示MP感染后慢性咳嗽病儿存在显著的嗜酸性粒细胞性气道炎症。
支原体感染;咳嗽;一氧化氮;儿童
肺炎支原体(MP)属非典型微生物,其在社区获得性呼吸道感染及儿童肺炎中均占重要的病原学地位[1]。近年来,MP感染病儿明显增多,且好发年龄有小龄化趋势[2]。2009年,美国胸科学会-欧洲呼吸学会(ATS/ERS)联合发布声明肯定呼出气一氧化氮(FeNO)作为气道炎症生物指标的临床应用价值,FeNO较其他无创炎症检测技术更简单方便、精确可靠、重复性好,是一种理想的无创评估气道炎症性疾病的检测方法。本研究旨在探讨MP感染后慢性咳嗽病儿FeNO水平及其与外周血嗜酸性粒细胞比例(EOS%)的相关性。
1 对象与方法
1.1研究对象
2014年1—12月,选取于我院呼吸道专业门诊就诊的5~12岁慢性咳嗽病儿92例,其中MP感染病儿58例(MP组),男31例,女27例,均规范应用阿奇霉素治疗3个疗程;非MP感染病儿34例(非MP组),男22例,女12例。以来本院体检的正常儿童30例作为正常对照组(男17例,女13例,年龄6~12岁)。慢性咳嗽病儿纳入标准:①既往无特质性疾病史;②咳嗽为主要或惟一表现,且持续4周以上,肺部听诊及X线表现无明显异常;③排除中国儿童慢性咳嗽诊断与治疗指南(2013年版)所列的其他引起慢性咳嗽的疾病[3-4]。MP感染诊断标准:单份血清特异性MP-IgM抗体滴度持续升高>1∶160,咽拭子PCR MP-DNA阳性。
1.2FeNO测定
采用瑞典Aerocrine公司生产的NIOX型Exhaled NO测定系统检测FeNO。参照ATS/ERS专门委员会推荐的FeNO标准化测定指南[5]进行测试,重复3次,每两次测定时间间隔30 s以上,取3次的均值进行分析。本测试在肺功能检查之前进行,且测定前1 h内禁止食用含氮类食物及饮料等。
1.3肺功能测定
采用德国康讯PowerCube肺功能仪,严格按测定要求进行测试。测试前做好受试者的指导工作,讲解测定过程,以达到最佳配合。所有儿童至少测量3次,取最高值进行分析。
1.4统计学处理
2 结 果
2.1各组FeNO水平比较
正常对照组、非MP组和MP组病儿FeNO水平分别为(10.89±2.35)×10-9、(14.00±2.58)×10-9、(26.17±3.02)×10-9,MP组病儿FeNO水平明显高于非MP组和正常对照组,差异有统计学意义(F=63.187,P<0.01);非MP组病儿与正常对照组比较差异无统计学意义(P>0.05)。
2.2MP组与非MP组肺功能测定结果及EOS%比较
MP组病儿EOS%高于非MP组,差异有统计学意义(t=4.708,P<0.01);两组病儿肺功能参数FEV1、MEF25、MEF50、MEF75比较差异均无显著性(P>0.05)。见表1。
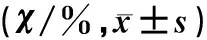
表1 MP组与非MP组EOS%及肺功能测定结果比较
2.3FeNO与EOS%的相关性分析
MP组病儿FeNO水平与外周血EOS%呈正相关(r=0.362,P<0.01),见图1。
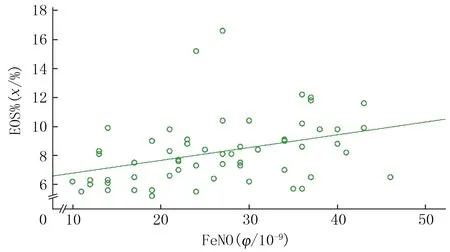
图1 MP组病儿FeNO与EOS%的相关性
3 讨 论
MP是目前儿童呼吸道感染,尤其是社区获得性呼吸道感染的重要病原之一。大量动物实验和临床观察显示,MP可直接损伤呼吸道上皮,导致气道高反应性,促进淋巴细胞、巨噬细胞等多种炎性细胞聚集,释放细胞因子和炎症递质,形成气道慢性炎症的病理基础[6]。但MP在喘息发病中到底能起多大作用尚无定论。FeNO作为一种客观、直接、无创的监测气道炎症指标,近年来备受瞩目。目前已肯定FeNO在支气管哮喘、嗜酸性粒细胞性支气管炎[7]等疾病诊疗过程中的重要指导作用,但尚无研究表明FeNO与MP感染之间存在明确的关系,FeNO水平检测在MP感染中的临床应用价值尚不明了,MP感染后的肺功能改变报道也较少。研究表明,MP侵入呼吸道后,以其尖端特殊结构(顶器)牢固黏附于呼吸道上皮细胞神经氨酸受体上,抵抗黏膜纤毛的清除和吞噬细胞的吞噬,直接引起呼吸道上皮细胞损伤。这一生物学特点决定了其可长期潜伏并刺激气道上皮产生慢性炎症。LIANG等[8]通过支气管黏膜活检证实,MP感染能损伤气道上皮细胞及纤毛超微结构,而NO产生与纤毛的结构、动力密切相关。HARDY等[9]观察了MP感染肺炎病人1~2年,发现其肺部结构异常,小气道阻塞明显高于对照组;他们还建立了BALB/C小鼠模型研究慢性MP感染和呼吸道感染相关肺部疾病的关系,结果与临床研究一致。MP持续感染导致呼气流速下降,气道反应性增加,其可能的机制为支原体难以彻底清除,导致慢性炎症状态。作者在临床工作中也观察到,即使经阿奇霉素规范治疗3个疗程,仍有不少MP感染病儿出现较长期的慢性咳嗽。有研究显示,MP感染后的几个月,仍能从病人的呼吸道抽吸物中培养出MP,即使在应用有效抗生素足疗程治疗之后,亦能从病人的呼吸道分泌物中培养出MP,持续存在的感染导致呼气流速下降以及呼吸道高反应性[10],提示MP感染后即使症状已经消失,其气道炎症仍可能持续存在。2009年,ATS/ERS发布声明[11],肯定了FeNO作为喘息性疾病气道炎症指标的临床应用价值。与其他无创炎症检查指标相比较,FeNO检测操作简便、结果可靠且重复性好,是无创评估气道炎症疾病的理想方法。然而,目前尚无客观数据指标衡量MP感染后较长一段时间内气道炎症的程度。
本文结果显示,MP组病儿FeNO水平显著高于正常对照组,非MP组病儿与正常对照组FeNO水平相比较差异无统计学意义;MP组病儿FeNO水平及EOS%均显著高于非MP组,并且EOS%与FENO水平呈正相关。这表明MP感染后慢性咳嗽病儿存在显著的嗜酸性粒细胞性气道炎症,这与SATO等[12]报道一致。其可能机制如下:MP感染后,Th1/Th2细胞功能失衡,Th2细胞活化,大量分泌白细胞介素(IL)-5、IL-4、IL-13、干扰素-γ等细胞因子或趋化因子,其中IL-5能刺激骨髓嗜酸细胞系祖细胞分化为成熟的嗜酸细胞并释放至外周,同时增强嗜酸细胞活化因子的趋化效应,趋化嗜酸细胞定植到炎症部位,并进一步引起嗜酸性粒细胞的募集和活化,从而导致呼吸道局部嗜酸性粒细胞浸润和外周血嗜酸性粒细胞显著增多,最终诱发气道高反应性[13]。MP感染后1个月甚至几个月病儿,即使已应用大环内酯类抗生素足疗程治疗,FeNO检测仍可发现气道炎症持续存在,故病儿临床上可表现为慢性、顽固性咳嗽,甚至最终诱发喘息发作。提示儿科医师诊治慢性咳嗽病儿时,要考虑近期有无MP感染。有研究显示,MP感染组肺泡灌洗液中嗜酸性粒细胞数量明显高于对照组,说明MP感染促使气道内嗜酸性粒细胞聚集、活化,在哮喘的发病中起一定作用[14]。国内亦有研究表明,MP感染后抗体滴度增高与外周血嗜酸性粒细胞增多呈正相关[15]。因此,MP感染可能会加重气道嗜酸性粒细胞炎症反应,从而引起FeNO水平升高。
有关FeNO与肺功能的关系,多项临床研究结论并不一致,多数认为FeNO或气道炎症与肺功能没有相关性[16-17]。但也有相反结论,PIACENGINI等[18]研究显示,在已应用糖皮质激素治疗的哮喘病儿中,FeNO和肺功能仍有显著的相关性。国内杨男等[19]对稳定期哮喘病儿的研究显示,非糖皮质激素治疗组病儿FeNO水平与FEV1呈显著相关性。本文结果显示,MP组与非MP组病儿肺功能各项参数比较差异均无统计学意义,可能与所选病儿处于病程中不同时期有关。
本研究病例数相对较少,未能在其他水平进行分组研究,且选取对象年龄差异相对较大,对实验结果可能存在一定影响。今后我们将针对MP感染后的不同时间段进行研究,以期明确MP感染后气道炎症的动态变化。
[1] 董晓艳,陆权. 小儿肺炎支原体感染的诊治现状与进展[J]. 实用儿科临床杂志, 2011,26(4):235-238.
[2] 朱美君,赵金华,赵晓冬,等. 儿童肺炎支原体感染肺外并发症临床分析[J]. 齐鲁医学杂志, 2015,30(1):47-48,51.
[3] 苏丽霞. 普米克令舒联合孟鲁司特治疗儿童慢性咳嗽的效果[J]. 青岛大学医学院学报, 2015,51(4):491-492.
[4] 中华医学会儿科学分会呼吸学组慢性咳嗽协作组,中华儿科杂志编辑委员会. 中国儿童慢性咳嗽诊断与治疗指南(2013年版)[J]. 中华儿科杂志, 2014,52(3):184-188.
[5] SOCIETY A T, SOCIETY E R. ATS/ERS recommendation for standardized procedures for the online and off-line measure of exhaled lower respiratory nitric oxide and nasal nitric oxide in adults and children, 2005[J]. Am J Respir Crit Med, 2005,171(8):912-930.
[6] LAI J F, ZINDL C L, DUFFY L B, et al. Critical role of macrophages and their activation via MyD88-NFκB signaling in lung innate immunity to Mycoplasma pneumoniae[J]. PLOS One, 2010,5(12): e14417.
[7] SCHLEICH F N, SEIDEL L, SELE J, et al. Exhaled nitric oxide thresholds associated with a sputum eosinophil count ≥3% in a cohort of unselected patients with asthma[J]. Thorax, 2010,65(12):1039-1044.
[8] LIANG H, JIANG W J, HAN Q, et al. Ciliary ultrastructural abnormalities in Mycoplasma pneumoniae pneumonia in 22 pediatric patients[J]. European Journal of Pediatrics, 2012,171(3):559-563.
[9] HARDY H S, OLSEN K. Aminduces respiratory infection, airway hypenctivity inflammationg:alnurlnmodel of infection-associated chronic reactive airway disease[J]. Infectlmmun, 2002,70(2):649-654.
[10]WAITES K B, BALISH M F, ATKINSON T P. New insights into the pathogenesis and detection of Mycoplasma pneumoniae infections[J]. Future Microbiology, 2008,3(6):635-648.
[11]REDDEL H K, TAYLOR D R, BATEMAN E D, et al. An official American thoracic society/European respiratory society statement: asthma control and exacerbations standardising endpoints for clinical asthma trials and clinical practice[J]. American Journal of Respiratory andCritical Care Medicine, 2009,180(1):59-99.
[12]SATO S, SAITO J, SATO Y, et al. Clinical usefulness of fractional exhaled nitric oxide for diagnosing prolonged cough[J]. Respiratory Medicine, 2008,102(10):1452-1459.
[13]OZDEMIR C, AKDIS M, AKDIS C A. T regulatory cells and their counterparts: masters of immune regulation[J]. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology, 2009,39(5):626-639.
[14]CHEN C J, HUNG M C, KUO K L, et al. The role of eosinophil cationic protein in patients with Mycoplasma pneumoniae infection[J]. Journal of the Chinese Medical Association: JCMA, 2008,71(1):37-39.
[15]滕源,谢娟娟,谢国强,等. 小儿急性支气管肺炎支原体抗体与嗜酸性粒细胞的关系[J]. 天津医药, 2007,35(9):693-694.
[16]舒林华,尚云晓,杨男,等. 儿童呼出气体一氧化氮与肺功能相关性研究[J]. 中国小儿急救医学杂志, 2009,16:154-156.
[17]WILSON N M, BRIDGE P, SPANEVELLO A, et al. Induced sputum in children: feasibility, repeatability, and relation of findings to asthma severity[J]. Thorax, 2000,55(9):768-774.
[18]PIACENTINI G L, BODINI A, COSTELLA S, et al. Exhaled nitric oxide, serum ECP and airway responsiveness in mild asthmatic children[J]. The European Respiratory Journal, 2000,15(5):839-843.
[19]杨男,尚云晓,舒林华,等. 哮喘患儿呼出气一氧化氮水平与肺功能相关性研究[J]. 中国小儿急救医学杂志, 2010,17:34-36.
(本文编辑 马伟平)
THE LEVEL OF EXHALED NITRIC OXIDE AND ITS SIGNIFICANCE IN CHILDREN WITH CHRONIC COUGH AFTER MYCOPLASMA INFECTION
QIAOLingyan,SUNGuangrong,MAShaochun
(Department of Internal Medicine, Qingdao Women & Children’s Hospital, Qingdao 266034, China)
ObjectiveTo investigate the level of exhaled nitric oxide (ENO) and its relation with peripheral blood eosi-nophils proportion (PBEP%) in children with chronic cough after Mycoplasma pneumoniae (MP) infection.MethodsFrom January to December of 2014, 92 children of 5-12 years of age with chronic cough visited our respiratory disease clinic. Of whom, 58 were infected by MP (MP group), 34 with non-MP infection (non-MP group), and 30 healthy children who came for health examination were served as normal control group. The ENO, pulmonary function indicators and PBEP% between each group and the correlation between ENO and PBEP% in the MP group was analyzed.ResultsENO levels in MP group were higher than that in non-MP group and control group (F=63.187,P<0.01), and PBEP% was higher than that in non-MP group (t=4.708,P<0.01). In MP group, the level of ENO was positively correlated with PBEP% (r=0.362,P<0.01). There were no significant statistical differences between MP and non-MP groups in lung function parameters such as FEV1, MEF25, and MEF75 (P>0.05).ConclusionThe level of exhaled nitric oxide elevates in children with chronic cough caused by Mycoplasma pneumoniae infection, and there is a certain correlation between exhaled nitric oxide and peripheral blood eosinophils proportion, which suggestive of marked eosinophilic airway inflammation in children with chronic cough after Mycoplasma pneumoniae infection.
mycoplasma infections; cough; nitric oxide; child
2015-03-29;
2015-08-27
乔凌燕(1984-),女,硕士。
孙广荣(1966-),男,主任医师。
R725.6
A
1008-0341(2015)06-0695-04
