不同构型硒代蛋氨酸对肉鸡的作用效果
2015-05-09王永侠茅慧玲占秀安
王永侠 茅慧玲 占秀安,2*
(1.浙江农林大学动物科技学院,临安311300;2.浙江大学动物科学学院,动物分子营养学教育部重点实验室,杭州310029)
不同构型硒代蛋氨酸对肉鸡的作用效果
王永侠1茅慧玲1占秀安1,2*
(1.浙江农林大学动物科技学院,临安311300;2.浙江大学动物科学学院,动物分子营养学教育部重点实验室,杭州310029)
本试验旨在研究DL-和L-硒代蛋氨酸(Se-Met)对肉鸡的作用效果。选择600只1日龄体重相近罗斯(Ross)308雏鸡,随机分为3组,每组5个重复,每重复40只。3个组分别在基础饲粮(实测硒含量0.04 mg/kg)中添加0.15 mg/kg硒的亚硒酸钠(SS)、L-Se-Met和DL-Se-Met,试验为期42 d。结果表明:与SS相比,不同构型Se-Met均显著提高了血清和组织硒含量及血清三碘甲状腺原氨酸含量(P<0.05),显著降低了宰后24和48 h胸肌滴水损失率及血清四碘甲状腺原氨酸/三碘甲状腺原氨酸(P<0.05);L-Se-Met显著提高了血清免疫球蛋白G(IgG)含量及胰脏淀粉酶和蛋白酶活性(P<0.05);DL-Se-Met显著提高了血清免疫球蛋白A(IgA)和IgG含量及胰脏脂肪酶和淀粉酶活性(P<0.05)。此外,DL-Se-Met组血清IgA和IgG含量及血清、肾脏和肌肉硒含量均显著高于L-Se-Met组(P<0.05)。由此提示,Se-Met较SS能显著增加组织硒沉积,具有改善肉品质、促进消化酶和甲状腺激素分泌和提高免疫力的功效,总体效果为DL-Se-Met优于L-Se-Met。
亚硒酸钠;硒代蛋氨酸;肉鸡;肉质;消化酶;甲状腺激素;免疫
硒是人和动物生命中必需的微量元素,在动物生长发育、繁殖、免疫、抗病、抗氧化和抗应激等方面具有重要的生理功能[1-2]。我国约72%地区属于低硒或缺硒地区,2/3以上地区的饲粮和牧草硒含量小于0.05 mg/kg,同时我国家禽饲粮以玉米-豆粕型为主,通常难以满足其对硒的需要量。因此,饲粮中补硒成为必然。饲用硒源主要分为无机硒和有机硒,常用无机硒源为亚硒酸钠(sodium selenite,SS),有机硒源为酵母硒(Se-enriched yeasts,SY)[3]。与无机硒相比,有机硒具有吸收率高、生物活性强、毒性低、抗氧化功能强和环境污染小等特点[4-5]。
L-硒代蛋氨酸(selenomethionine,Se-Met)是硒在自然界中存在的天然形式,同时也是SY中有机硒的主要存在形式。与其他氨基酸一样,Se-Met也存在D型和L型2种同分异构体,人工合成的Se-Met产品均为DL型(即D-型和L-型各50%的混旋物)。生物体合成的皆为L-Se-Met[6]。与SS比,在饲粮中补充L-Se-Met和SY的有益作用已经得到了肯定[7-9]。目前国内外关于不同构型Se-Met对肉鸡作用效果的研究尚未见报道。为此,本试验以高纯度DL-Se-Met和L-Se-Met为有机硒源,研究不同构型Se-Met对肉鸡的作用效果,旨在为DL-Se-Met的产业化及其应用提供科学依据。
1 材料与方法
1.1 试验材料
SS、DL-Se-Met和L-Se-Met:纯度均为99%,由Sigma公司提供。试验鸡为1日龄平均初始体重为44 g的罗斯(Ross)308商品代肉仔鸡,由浙江正大肉鸡发展有限公司提供。
1.2 试验饲粮
采用玉米-豆粕型基础饲粮,营养水平参考我国行业标准NY/T 33—2004配制。全期分为1~21日龄和22~42日龄2个饲养阶段,基础饲粮组成及营养水平见表1。
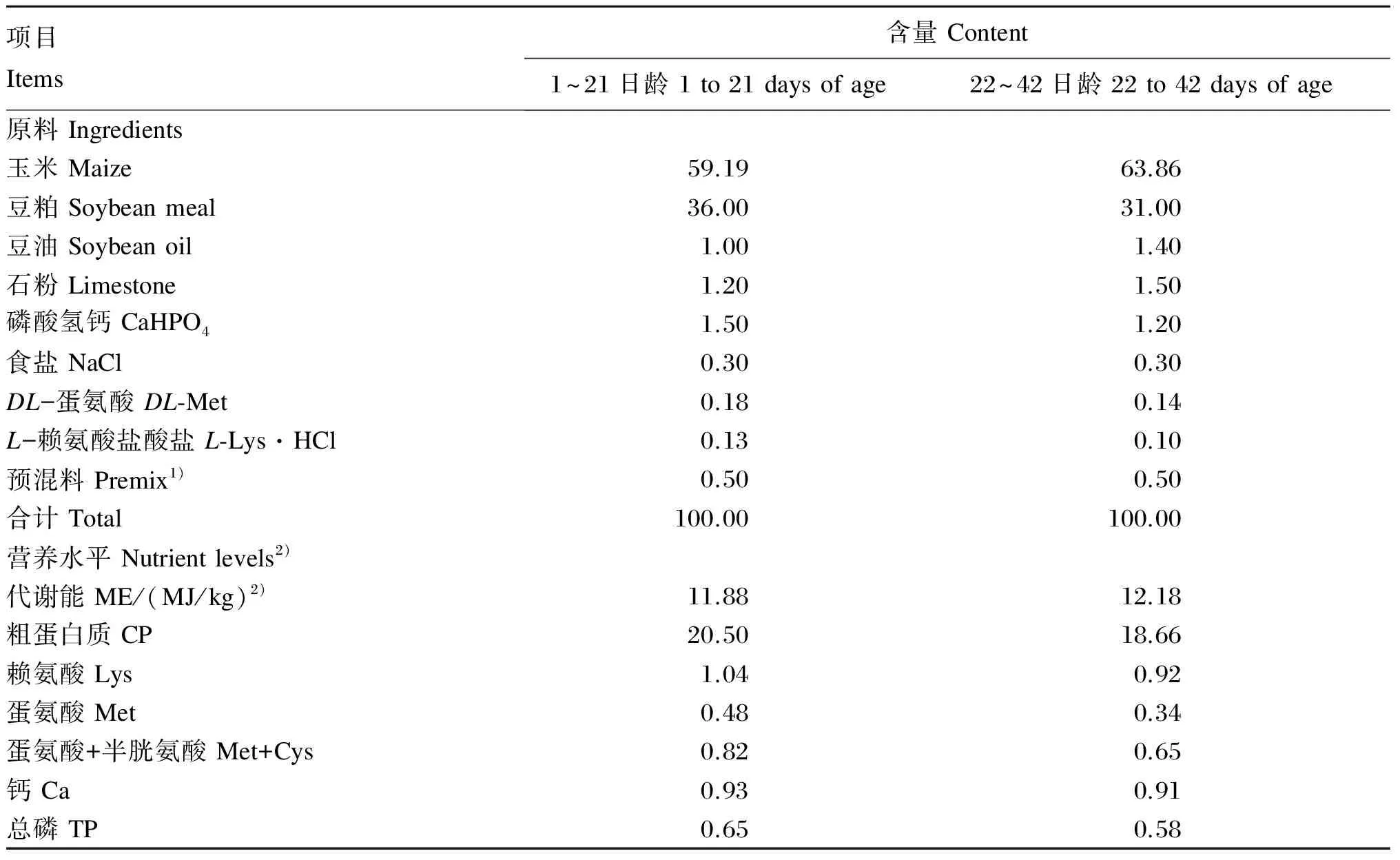
表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of diets:VA 8 000 IU,VD31 000 IU,VE 20 IU,VK30.5 mg,VB28 mg,VB12.0 mg,VB63.5 mg,VB1210 μg,生物素 biotin 180 μg,叶酸 folic acid 0.55 mg,泛酸 pantothenic acid 10 mg,烟酸 niacin 35 mg,Fe 100 mg,Cu 8 mg,Mn 102 mg,Zn 100 mg,I 0.7 mg。
2)代谢能为计算值,其余均为实测值。ME was a calculate value, while the others were measured values.
1.3 饲养试验
选用1日龄健康Ross 308商品代雏鸡混合雏600只,按照饲养试验要求,随机分成3组,每组200只(含5个重复,每个重复40只)。3个组分别为SS组、DL-Se-Met组和L-Se-Met组,均在基础饲粮(硒含量实测值0.04 mg/kg)中添加0.15 mg/kg硒。试验为期42 d。饲养试验期间,自由采食饮水,常规管理,按正常免疫程序免疫。每天记录耗料量和死淘鸡数。于42日龄时,统计各重复耗料、鸡只重和死亡数,并计算平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)。
1.4 样品采集和保存
饲养试验结束后,各组每重复选体重相近公鸡4只,每组20只,共计60只,给水不给料,禁食12 h,翅静脉采血,制备血清于-80 ℃保存,然后屠宰。屠宰取肝脏、肾脏、胰脏和左侧胸肌样品于-80 ℃保存;同时取右侧胸肌样品于-4 ℃保存,用于测定肉质;另取胸腺、脾脏和法氏囊,去除周围结缔组织和脂肪组织,称其鲜重。
1.5 测定指标及方法
1.5.1 肉质指标
1.5.1.1 胸肌滴水损失率测定
取右侧胸肌的中间部分,并将试样修整成长×宽×厚为5 cm×2 cm×1 cm的肉片,用滤纸吸去表面的水分,称重(W0),然后用铁丝钓住肉样的一端,使肌纤维垂直向下,装入充气的塑料袋中,肉样不与袋壁接触,扎好袋口,悬挂于4 ℃冰箱中,分别测定宰后第24和48 h的肉样重(W1),分别计算滴水损失率[10]。
滴水损失率(%)=100×(W0-W1)/W0。
1.5.1.2 胸肌肉色测定
采用SP60 Series色差仪(美国爱色丽公司,密歇根州,美国)测定屠宰后8和16 h胸肌的红度(a*)值。
1.5.1.3 胸肌pH测定
按照国际标准(ISO 2917—1974)方法采用HI 99121N酸度计(意大利哈纳仪器公司,帕多瓦纳,意大利)测定屠宰后8和16 h胸肌pH。
1.5.2 免疫指标
1.5.2.1 免疫器官指数测定
胸腺、脾脏和法氏囊分别称鲜重后,计算免疫器官指数。
免疫器官指数(g/kg)=免疫器官鲜重/宰前活重。
1.5.2.2 血清免疫球蛋白含量
采用上海复星长征医学有限公司生产的试剂盒测定血清免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M,IgM)和免疫球蛋白A(immunoglobulin A,IgA)含量。
1.5.3 胰脏消化酶活性
采用南京建成生物工程研究所试剂盒测定胰脏蛋白酶、脂肪酶和淀粉酶活性及其蛋白质含量。具体操作步骤参照试剂盒说明书。
1.5.4 血清激素指标
采用北京北方生物技术研究所试剂盒测定血清三碘甲状腺原氨酸(triiodothyronine,T3)和四碘甲状腺原氨酸(thyroxine,T4)含量。
1.5.5 硒含量测定
血清、肝脏、肾脏、胰脏和肌肉硒含量测定,采用微波消解法预处理,于AF-610A型原子荧光光谱仪(北京瑞利分析仪器公司,北京)上测定。
1.6 数据统计分析
试验数据采用SPSS 16.0软件进行统计分析,P<0.05为差异显著,结果以平均值±标准差表示。
2 结 果
2.1 不同构型Se-Met对肉鸡生长性能的影响
由表2可见,SS和不同构型Se-Met对肉鸡全期ADG、ADFI和F/G均无显著影响(P>0.05)。
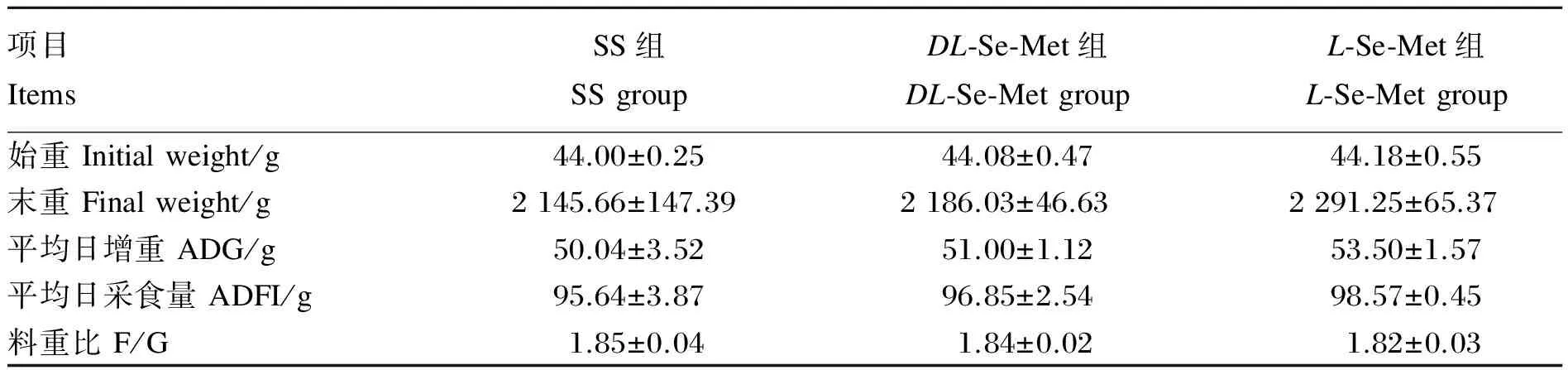
表2 不同构型Se-Met对肉鸡生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),肩标相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 不同构型Se-Met对肉鸡肉质的影响
由表3可见,与SS组相比,DL-和L-Se-Met组肉鸡宰后24和48 h胸肌滴水损失率分别降低了21.47%(P<0.05)和17.82%(P<0.05)、15.03%(P<0.05)和17.05%(P<0.05)。不同构型Se-Met之间肉鸡胸肌24和48 h滴水损失率无显著差异(P>0.05)。肉鸡宰后8和16 h胸肌的a*值与pH各组间差异不显著(P>0.05)。
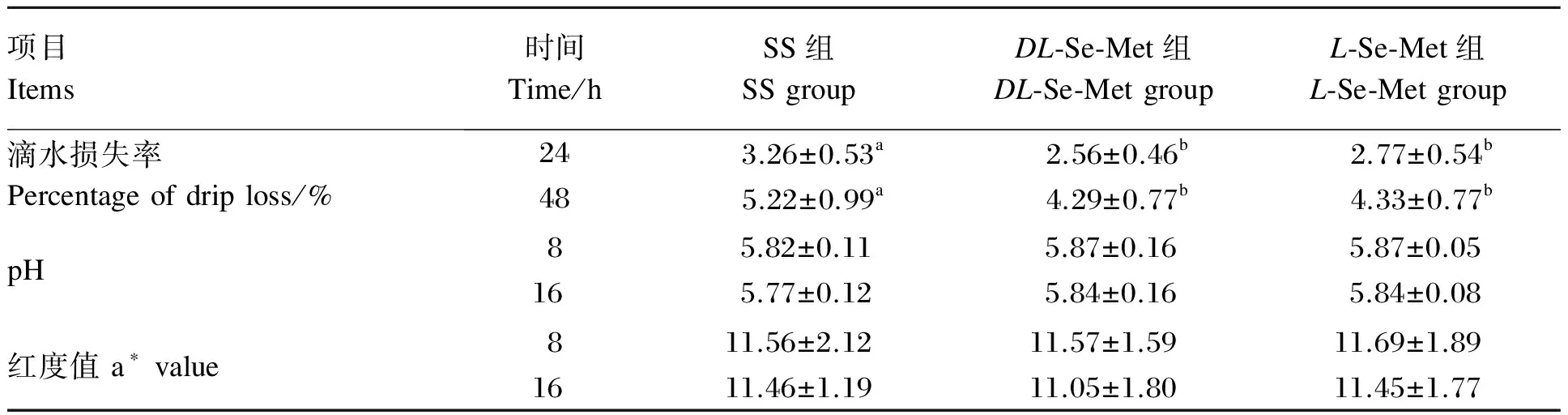
表3 不同构型Se-Met对肉鸡胸肌滴水损失率、a*值和pH的影响
2.3 不同构型Se-Met对肉鸡硒沉积的影响
由表4可见,与SS组相比,DL-Se-Met组血清、肝脏、肾脏、胰脏和肌肉硒含量分别提高了17.91%(P<0.05)、14.63%(P<0.05)、23.91%(P<0.05)、20.00%(P<0.05)和50.00%(P<0.05);L-Se-Met组血清、肝脏、肾脏、胰脏和肌肉硒含量分别提高了8.96%(P<0.05)、9.76%(P<0.05)、15.22%(P<0.05)、13.33%(P<0.05)和30.00%(P<0.05)。DL-Se-Met组血清、肾脏和肌肉硒含量较L-Se-Met组分别提高了8.22%(P<0.05)、7.55%(P<0.05)和15.38%(P<0.05)。
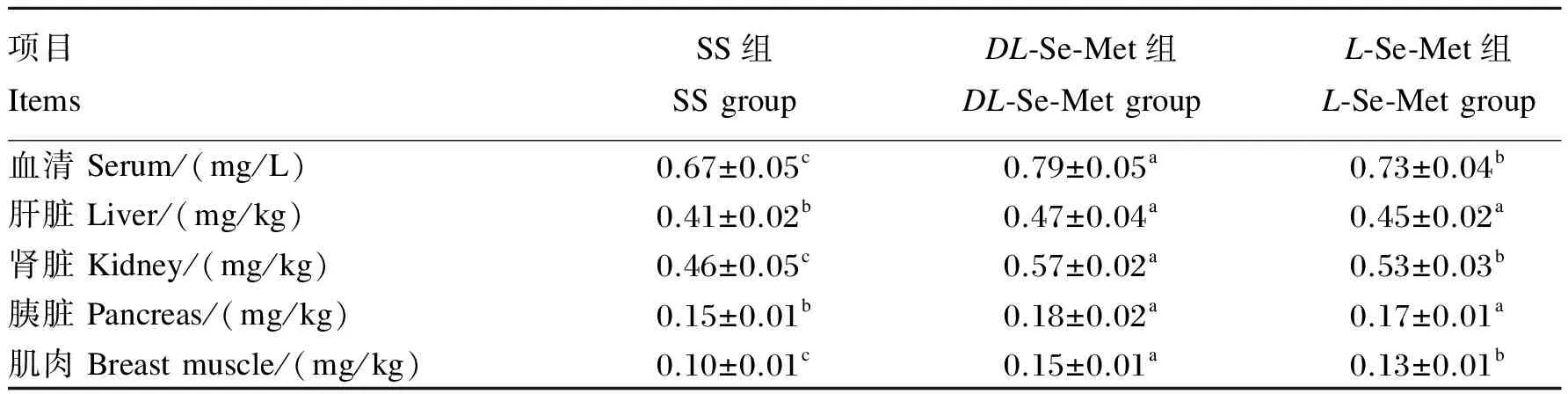
表4 不同构型Se-Met对肉鸡血清和组织硒含量的影响
2.4 不同构型Se-Met对肉鸡免疫功能的影响
由表5可见,与SS组相比,DL-Se-Met组血清IgA和IgG含量分别提高了51.16%(P<0.05)和42.31%(P<0.05);L-Se-Met组血清IgG含量提高了20.51%(P<0.05)。DL-Se-Met组血清IgA和IgG含量较L-Se-Met组分别提高了32.65%(P<0.05)和18.09%(P<0.05)。各组间脾脏指数、胸腺指数、法氏囊指数和血清IgM含量差异不显著(P>0.05)。
2.5 不同构型Se-Met对肉鸡激素分泌的影响
由表6可见,与SS组相比,L-与DL-Se-Met组血清T3含量分别提高了26.09%(P<0.05)和44.93%(P<0.05),血清T4/T3分别降低了25.38%(P<0.05)和26.69%(P<0.05)。Se-Met不同构型之间血清T3和T4含量及T4/T3均无显著差异(P>0.05)。
2.6 不同构型Se-Met对肉鸡消化酶活性的影响
由表7可见,与SS组相比,DL-Se-Met组胰脏脂肪酶和淀粉酶活性分别提高了24.03%(P<0.05)和24.49%(P<0.05);L-Se-Met组胰脏淀粉酶和蛋白酶活性分别提高了29.59%(P<0.05)和21.36%(P<0.05)。Se-Met不同构型之间胰脏脂肪酶、淀粉酶和蛋白酶活性均无显著差异(P>0.05)。
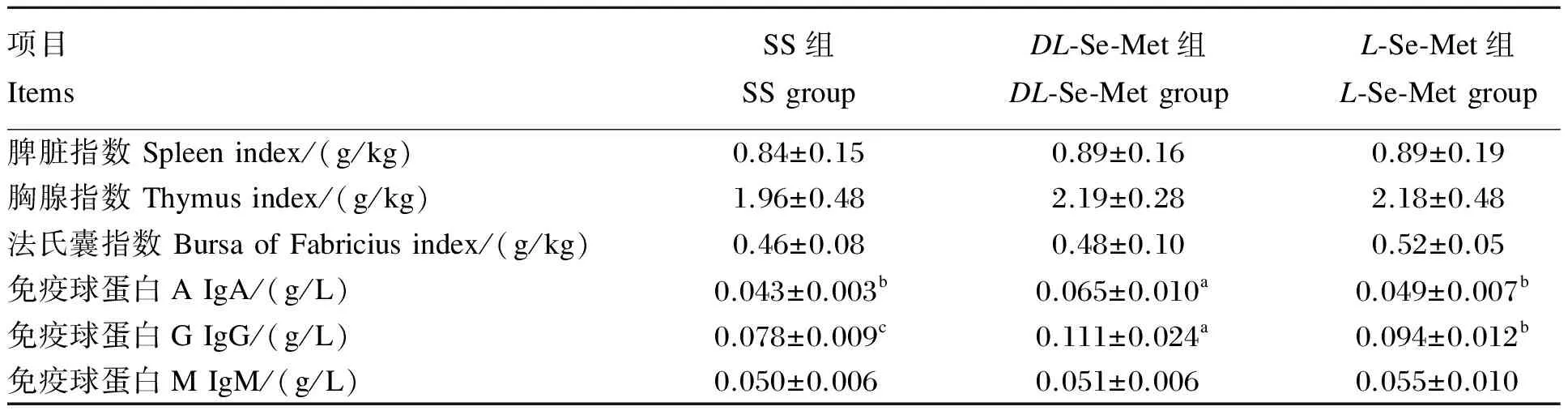
表5 不同构型Se-Met对肉鸡免疫器官指数和血清免疫球蛋白含量的影响
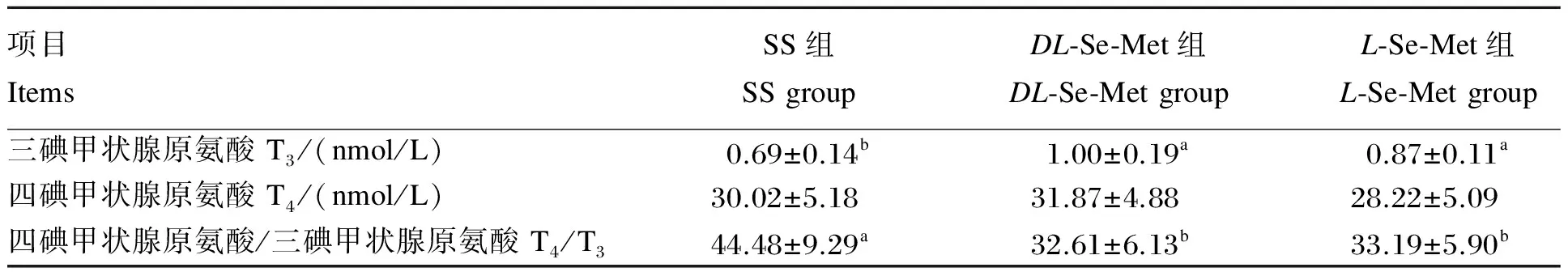
表6 不同构型Se-Met对肉鸡血清甲状腺激素的影响
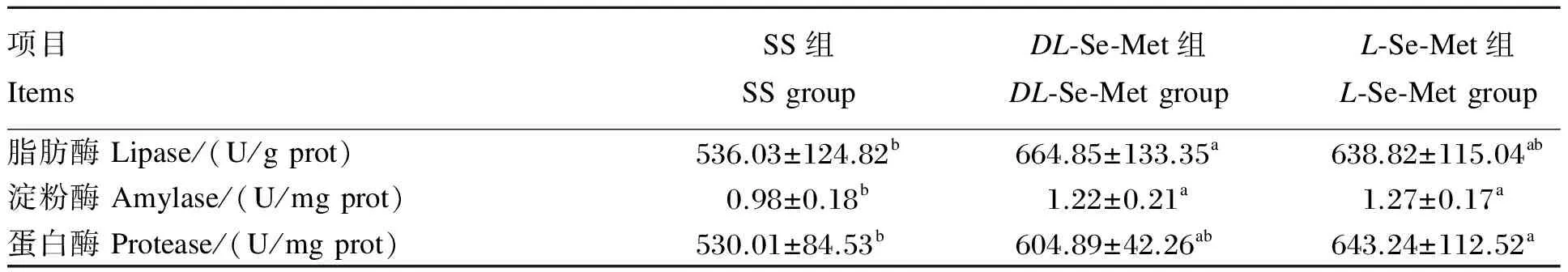
表7 不同构型Se-Met对肉鸡胰脏消化酶活性的影响
3 讨 论
3.1 SS与Se-Met比较
3.1.1 生长性能

3.1.2 肉质
滴水损失率是反映肉质的重要指标[15]。本试验结果显示,饲粮添加不同构型Se-Met同比SS均显著降低了肉鸡宰后24和48 h胸肌的滴水损失率。这与Choct等[16]、Zhan等[17]和Jiang等[13]的研究报道一致。研究表明,脂类氧化是影响肉质的主要因素。肌细胞脂质的氧化是从线粒体膜和微粒体膜(二者统称亚细胞膜)上富含不饱和脂肪酸的磷脂开始的[18]。膜磷脂的氧化导致生物膜流动性降低及正常膜结构和功能的破坏,从而使肌肉细胞完整性受损,导致细胞汁液外流、肌肉滴水损失增多及肉品质下降[19]。由此我们推测,Se-Met在改善肉质方面要强于SS,可能原因是Se-Met较SS显著提高了肌肉抗氧化能力,进而保持了肌细胞完整性。此外,Edens[20]的研究结果提示,有机硒自身并不能降低肉的滴水损失率,而是由于SS自氧化作用可提高肉的滴水损失率,由此导致两者在降低肌肉滴水损失率方面存在差异。对此,还有待进一步深入研究。
3.1.3 硒沉积
目前,国内外关于SS和Se-Met对机体血清和组织硒含量影响的报道很多,且结果均趋于一致。Cantor等[11]的研究表明,DL-Se-Met组肉鸡胰脏和血浆硒含量显著高于SS组。Butler等[21]研究显示,Se-Met比SS显著提高了猕猴肝脏、红细胞、毛发和肌肉中硒含量。Suomi等[22]试验表明,L-Se-Met较SS显著提高了生长猪背最长肌、血清和肝脏硒含量。本试验结果也表明,与SS比,不同构型Se-Met均显著提高了肉鸡血清、肝脏、肾脏、胰脏和肌肉组织硒含量,这与上述报道结果一致。
有机硒Se-Met在提高机体血清和组织硒含量方面优于无机硒SS,主要原因可能在于两者的吸收代谢机制不同。研究表明,SS在动物肠道中是被动吸收的,而Se-Met是类似于氨基酸形式的主动吸收[23],所以较之SS,Se-Met更易被肉鸡血液和组织吸收,进而提高其血液和组织硒含量。此外,虽然2种硒源在体内都可以通过转化为硒代半胱氨酸的形式合成硒蛋白,但由于tRNAMet无法区分蛋氨酸和Se-Met分子[6],因此只有Se-Met才能随机替代蛋氨酸非特异性的合成体蛋白,从而促进体内的硒沉积。因此,Se-Met较SS能显著提高肉鸡血清和组织中的硒含量。
3.1.4 免疫球蛋白分泌
硒在增强机体免疫系统功能方面发挥着重要作用[24-26]。硒对机体免疫系统功能的影响受饲粮中硒水平和添加形式的影响。Awadeh等[27]在研究不同硒源对母牛和后代犊牛免疫功能的影响中发现,母牛血清IgM含量同水平SY组显著高于SS组。淋巴细胞培养的试验中发现,培养液中添加Se-Met可显著提高细胞IgG产量;而添加相同水平SS却显著降低细胞IgG含量[28]。本试验结果显示,相比SS,DL-Se-Met显著提高了肉鸡血清IgA和IgG含量;L-Se-Met显著提高了肉鸡血清IgG含量;不同构型Se-Met均有提高肉鸡脾脏指数、胸腺指数、法氏囊指数和血清IgM含量的趋势,但未达到差异显著水平。由此提示Se-Met较SS可提高肉鸡的免疫功能。
Se-Met较SS可增强肉鸡免疫机能的机理有待于进一步探讨,推测与其在提高机体的抗氧化功能方面优于SS有关。因为当机体内活化的免疫细胞代谢增加时,产生的活性氧便会增多。而硒可通过促进抗氧化酶的产生而清除活性氧,减少脂质过氧化物的产生,从而保护细胞膜免受过氧化物的损害,促进淋巴细胞的增值和免疫器官的发育,增强机体的免疫功能[29]。
3.1.5 甲状腺激素分泌
T4和T3的主要作用是调节机体的物质和能量代谢[30-31],其中真正起甲状腺激素作用的只有T3,它的生物活性是T4的5~8倍[32]。正常情况下,甲状腺只提供小于20%的循环T3,人和动物大于80%的循环T3来源于甲状腺外组织的T4脱碘生成T3。本试验研究表明,不同构型Se-Met同比SS均显著提高了血清T3含量并降低了血清T4/T3,这与国内外的很多报道相一致。郭峰等[33]报道,SY组较SS组显著提高了49日龄肉鸡血清T3含量。Zhan等[34]报道,在怀孕母猪饲粮中添加同水平的DL-Se-Met和SS,DL-Se-Met组后代28日龄仔猪血清T3含量显著高于SS组;而血清T4/T3显著低于SS组。
硒对甲状腺激素的影响主要是通过对脱碘酶的调节来实现的。脱碘酶是一种含硒酶,能催化T4脱碘转变为T3[35]。由此我们推测,Se-Met在提高血清T3含量和降低血清T4/T3方面优于SS的可能原因在于Se-Met较SS显著提高了肉鸡血清和组织脱碘酶活性,进而促使T4脱碘成为T3,但具体的作用机理还有待进一步深入研究,因为本试验没有测定血清和组织脱碘酶活性。
3.1.6 消化酶分泌
本试验结果显示,同比SS,L-Se-Met显著提高了肉鸡胰脏淀粉酶和蛋白酶活性;DL-Se-Met显著提高了肉鸡胰脏脂肪酶和淀粉酶活性。由此说明肉鸡补充不同构型Se-Met较SS可增强营养物质代谢,促进其消化吸收。硒能提高胰脏消化酶活性与硒能保护胰脏,维持胰脏正常功能有关。Thompson等[36]证明,硒对维持雏鸡胰腺的外分泌机能具有专一作用。Cantor等[11]报道,DL-Se-Met在防止肉鸡胰脏纤维化方面显著优于SS。周晓蕾等[37]研究发现,同比SS,Se-Met可显著提高肉鸡胰腺消化酶活性。Se-Met较SS能提高胰脏消化酶活性的可能原因在于Se-Met较SS显著提高了肉鸡胰脏组织硒含量,进而能更好的保护胰脏,促进胰脏的分泌功能。
3.2 不同构型Se-Met比较
D-蛋氨酸可代替L-蛋氨酸而应用于畜禽生产中[38],它在生物体内的利用效率取决于其转化为L-蛋氨酸的效率。研究证明,在生物体内几乎所有的D-蛋氨酸都能转化为L-蛋氨酸[39-40]。Katz等[41]报道,D-蛋氨酸在肉鸡体内具有与L-蛋氨酸同等功效。L-Se-Met与L-蛋氨酸在动物体内的代谢过程是相同的且在代谢过程中没有L-Se-Met特异性的酶参与[42],由此我们推测D-Se-Met在动物体内的代谢与D-蛋氨酸的代谢也应该是类似的且对动物的作用效果取决于其转化为L-Se-Met的效率。本试验研究表明,不同构型Se-Met对肉鸡生长、肉质、免疫器官指数、血清IgA含量、血清甲状腺激素含量及胰脏消化酶活性的影响无显著差异;但DL-Se-Met较L-Se-Met显著提高了血清、肾脏和肌肉硒含量及血清IgA和IgG含量。这与武如娟等[43]在肉种鸡上的研究报道相似。武如娟等[43]的研究发现,在提高肉种鸡生产性能方面,DL-Se-Met与L-Se-Met效果相当;在提高血清和组织硒沉积量方面,DL-Se-Met显著优于L-Se-Met。由此我们推测:1)在肉鸡体内D-Se-Met或许可以转化为L-Se-Met而发挥生物学作用。Mcadam等[44]报道在大鼠体内D-Se-Met和L-Se-Met具有同等的毒性,且两者在骨骼肌、心脏、肝脏和红细胞中贮存硒的程度相似,由此他们推测在大鼠体内D-Se-Met或许可以转为L-Se-Met。但是在肉鸡体内D-Se-Met能否转为L-Se-Met我们尚不清楚,具体的作用机制仍有待进一步研究证实。2)在提高血清和组织硒沉积方面,D-Se-Met与L-Se-Met可能具有互作效应从而使DL-Se-Met较L-Se-Met能更有效提高血清和组织硒含量,但具体作用机理有待通过原子追踪法以及组织硒蛋白质组分分析进一步探讨。
4 结 论
不同构型Se-Met均是肉鸡有效的硒源补充剂。Se-Met较SS可显著增加机体组织硒沉积,具有改善肉品质、促进消化酶和甲状腺激素分泌及提高免疫力的功效,总体表现为DL-Se-Met优于L-Se-Met。
[1] RUAN H F,ZHANG Z W,WU Q,et al.Selenium regulates gene expression of selenoprotein W in chicken skeletal muscle system[J].Biological Trace Element Research,2012,145(1):59-65.
[2] ALIMOHAMADY R,ALIARABI H,BAHARI A,et al.Influence of different amounts and sources of selenium supplementation on performance,some blood parameters,and nutrient digestibility in lambs[J].Biological Trace Element Research,2013,154(1):45-54.
[3] NAVARRO-ALARCON M,CABRERA-VIQUE C.Selenium in food and the human body:a review[J].Science of Total Environment,2008,400(1/2/3):115-141.
[5] BARGER J L,KAYO T,PUGH T D,et al.Gene expression profiling reveals differential effects of sodium selenite,selenomethionine,and yeast-derived selenium in the mouse[J].Genes & Nutrition,2012,7(2):155-165.
[6] SCHRAUZER G N.The nutritional significance,metabolism and toxicology of selenomethionine[J].Advances in Food and Nutrition Research,2003,47:73-112.
[7] WANG Y X,ZHAN X A,ZHANG X W,et al.Comparison of different forms of dietary selenium supplementation on growth performance,meat quality,selenium deposition,and antioxidant property in broilers[J].Biological Trace Element Research,2011,143(1):261-273.
[9] LIAO X D,LU L,LI S F,et al.Effects of selenium source and level on growth performance,tissue selenium concentrations,antioxidation,and immune functions of heat-stressed broilers[J].Biological Trace Element Research,2012,150(1/2/3):158-165.
[10] JAMES B W,GOODBAND R D,UNRUH J A,et al.Effect of creatine monohydrate on finishing pig growth performance,carcass characteristics and meat quality[J].Animal Feed Science and Technology,2002,96(3/4):135-145.
[11] CANTOR A H,LANGEVIN M L,NOGUCHI T,et al.Efficacy of selenium in selenium compounds and feedstuffs for prevention of pancreatic fibrosis in chicks[J].The Journal of Nutrition,1975,105(1):106-111.
[12] CHOCT M,NAYLOR A J,REINKE N.Selenium supplementation affects broiler growth performance,meat yield and feather coverage[J].British Poultry Science,2004,45(5):677-683.
[13] JIANG Z Y,LIN Y C,ZHOU G L,et al.Effects of dietary selenomethionine supplementation on growth performance,meat quality and antioxidant property in yellow broilers[J].Journal of Agricultural and Food Chemistry,2009,57(20):9769-9772.
[14] WANG C L,LOVELL R T.Organic selenium sources,selenomethionine and selenoyeast,have higher bioavailability than an inorganic selenium source,sodium selenite,in diets for channel catfish (Ictaluruspunctatus)[J].Aquaculture,1997,152(1/2/3/4):223-234.
[16] CHOCT M,NAYLOR A J.The effect of dietary selenium source and vitamin E levels on performance of male broilers[J].Asian-Australasian Journal of Animal Sciences,2004,17(7):1000-1006.
[17] ZHAN X A,WANG M,ZHAO R Q,et al.Effects of different selenium source on selenium distribution,loin quality and antioxidant status in finishing pigs[J].Animal Feed Science and Technology,2007,132(3/4):202-211.
[18] BLASIG I E,GRUNE T,SCHÖNHEIT K,et al.4-Hydroxynonenal,a novel indicator of lipid peroxidation for reperfusion injury of the myocardium[J].The American Journal of Physiology,1995,269(1 Pt 2):H14-H22.
[19] NAKAYA H,TOHSE N,KANNO M.Electrophysiological derangements induced by lipid peroxidation in cardiac tissue[J].American Journal of Physiology,1987,253(5):1089-1097.
[20] EDENS F W.Involvement of Sel Plex in physiological stability and performance of broiler chickens[M]//LYONS T P,JACQUES K A.Science and technology in the feed industry.Nottingham:Nottingham University Press,2001:349-376.
[21] BUTLER J A,WHANGER P D,KANEPS A J,et al.Metabolism of selenite and selenomethionine in the rhesus monkey[J].The Journal of Nutrition,1990,120(7):751-759.
[22] SUOMI K,ALAVIUHKOLA T.Responses to organic and inorganic selenium in the performance and blood selenium content of growing pigs[J].Agricultural Science in Finland,1992,1(2):211-214.
[23] WOLFFRAM S,BERGER B,GRENACHER B,et al.Transport of selenoamino acids and their sulfur analogues across the intestinal brush border membrane of pigs[J].Journal of Nutrition,1989,119(5):706-712.
[24] MCKENZIE R C,RAFFERTY T S,BECKETT G J,et al.Effects of selenium on immunity and aging[M]//HATFIELD D L.Selenium:Its molecular biology and role in human health.Boston:Kluwer Academic Publishers,2001:257-272.
[25] ARSHAD M,SIDDIQUE M,ASHRAF M,et al.Effect of selenium supplementation on antibody titres against infectious bursal disease vaccine in broiler chicks[J].Pakistan Veterinary Journal,2005,25(4):203-204.
[26] BISWAS A,MOHAN J,SASTRY K V H.Effect of higher levels of dietary selenium on production performance and immune responses in growing Japanese quail[J].British Poultry Science,2006,47(4):511-515.
[27] AWADEH F T,KINCAID R L,JOHNSON K A.Effect of level and source of dietary selenium on concentrations of thyroid hormones and immunoglobulins in beef cows and calves[J].Journal of Animal Science,1998,76(4):1204-1215.
[28] BORELLA P,BARGELLINI A,MEDICI C I.Chemical form of selenium greatly affects metal uptake and responses by cultured human lymphocytes[J].Biological Trace Element Research,1996,51(1):43-54.
[29] 曹来福,闻芝梅.硒对免疫功能的影响[J].国外医学:卫生学分册,1987(3):132-135.
[30] SMITH J W,EVANS A T,COSTALL B,et al.Thyroid hormones,brain function and cognition:a brief review[J].Neuroscience & Biobehavioral Reviews,2002,26(1):45-60.
[31] ZHAN X A,WANG M,REN H,et al.Effect of early feed restriction on metabolic programming and compensatory growth in broiler chickens[J].Poultry Science,2007,86(4):654-660.
[32] 王自正.现代医学标记免疫学[M].北京:人民军医出版社,2000:139-145.
[33] 郭峰,李同树,苗朝华,等.日粮硒源及添加水平对肉鸡生产性能、肉质和甲状腺激素的影响[J].动物营养学报,2004,16(3):63-64.
[34] ZHAN X A,QIE Y Z,WANG M,et al.Selenomethionine:an effective selenium source for sow to improve se distribution,antioxidant status,and growth performance of pig offspring[J].Biological Trace Element Research,2011,142(3):481-491.
[35] SHINDE P L,DASS R S,GARG A K.Effect of vitamin E and selenium supplementation on haematology,blood chemistry and thyroid hormones in male buffalo (Bubalusbubalis) calves[J].Journal of Animal and Feed Sciences,2009,18:241-256.
[36] THOMPSON J N,SCOTT M L.Impaired lipid and vitamin E absorption related to atrophy of the pancreas in selenium-deficient chicks[J].The Journal of Nutrition,1970,100(7):797-809.
[37] 周晓蕾,袁缨,李建涛,等.硒代甲硫氨酸对肉仔鸡胰腺外分泌部的影响[J].中国畜牧杂志,2010,46(13):43-46.
[38] MAN E H,BADA J L.DietaryD-amino acids[J].Annual Review of Nutrition,1987,7:209-225.
[39] SUGIYAMA K,MURAMATSU K.Effects of excessD- andL-methionine diets on growth and hepatic enzyme activities in rats[J].Agricultural and Biological Chemistry,1987,51(12):3411-3413.
[40] HASEGAWA H,SHINOHARA Y,AKAHANE K,et al.Direct detection and evaluation of conversion ofD-methionine intoL-methionine in rats by stable isotope methodology[J].The Journal of Nutrition,2005,135(8):2001-2005.
[41] KATZ R S,BAKER D H.Efficacy ofD-,L-,andDL-methionine for growth of chicks fed crystalline amino acid diets[J].Poultry Science,1975,54(5):1667-1674.
[42] KAJANDER E O,HARVIMA R J,ELORANTA T O,et al.Metabolism,cellular actions,and cytotoxicity of selenomethionine in cultured cells[J].Biological Trace Element Research,1991,28(1):57-68.
[43] 武如娟,占秀安,赵茹茜,等.不同构型硒代蛋氨酸对岭南黄父母代肉种鸡生产性能和组织硒沉积的影响[J].动物营养学报,2010,22(1):151-156.
[44] MCADAM P A,LEVANDER O A.Chronic toxicity and retention of dietary selenium fed to rats asD- orL-selenomethionine,selenite,or selenate[J].Nutrition Research,1987,7(6):601-610.
*Corresponding author, professor, E-mail: xazan@zju.edu.cn
(责任编辑 武海龙)
Action Effects of Different Selenomethionine Forms on Broilers
WANG Yongxia1MAO Huiling1ZHAN Xiuan1,2*
(1.CollegeofAnimalScienceandTechnology,ZhejiangAgricultureandForestryUniversity,Lin’an311300,China; 2.KeyLaboratoryforMolecularAnimalNutritionofMinistryofEducation,CollegeofAnimalScience,ZhejiangUniversity,Hangzhou310029,China)
The objective of this experiment was to investigate the effects of different forms of dietary selenomethionine (Se-Met) supplementation on broilers. A total of 600 one-day-old Ross 308 broilers with similar body weight were randomly divided into 3 groups with 5 replicates per group and 40 birds per replicate. These 3 groups received the same basal diet containing 0.04 mg/kg selenium (Se), supplemented with 0.15 mg/kg Se from sodium selenite (SS) orL-Se-Met orDL-Se-Met. The experiment lasted for 42 days. The results showed as follows: compared with SS, different forms Se-Met significantly increased serum and tissue Se contents and serum triiodothyronine content (P<0.05), but significantly decreased the percentage of drip loss of breast muscle at 24 and 48 h after slaughter and the ratio of thyroxine to triiodothyronine in serum (P<0.05);L-Se-Met significantly increased serum immunoglobulin G (IgG) content and pancreas amylase and protease activities (P<0.05);DL-Se-Met significantly increased serum mmunoglobulin A (IgA) and IgG contents and pancreas lipase and amylase activities (P<0.05). The serum IgA and IgG contents and serum, kidney and breast muscle Se contents ofDL-Se-Met group were significantly higher than those ofL-Se-Met group (P<0.05). The results indicated that Se-Met is more effective than SS in increasing Se deposition and immunity, stimulating the secretion of digestive enzymes and thyroid hormones, thus providing an effective way to improve the meat quality of broilers. Besides, taking into account the overall effects,DL-Se-Met is superior toL-Se-Met.[ChineseJournalofAnimalNutrition, 2015, 27(12):3861-3870]
sodium selenite; selenomethionine; broilers; meat quality; digestive enzymes; thyroid hormones; immunity
10.3969/j.issn.1006-267x.2015.12.027
2015-06-09
国家自然科学基金青年基金(31402096);国家现代农业产业技术体系建设专项资金(CARS-42-G19);浙江农林大学人才启动项目(2013FR075)
王永侠(1982—),女,山东临沂人,讲师,博士,从事动物营养与调控研究。E-mail: rationalwang@163.com
*通信作者:占秀安,教授,博士生导师,E-mail: xazan@zju.edu.cn
S831
A
1006-267X(2015)12-3861-10
