一水肌酸对杜浙猪肉质性状、肌肉磷酸原代谢、纤维类型特征及蛋白质溶解度的影响
2015-05-09门小明齐珂珂徐子伟浙江省农业科学院畜牧兽医研究所杭州310021
门小明 邓 波 陶 新 齐珂珂 徐子伟(浙江省农业科学院畜牧兽医研究所,杭州310021)
一水肌酸对杜浙猪肉质性状、肌肉磷酸原代谢、纤维类型特征及蛋白质溶解度的影响
门小明 邓 波 陶 新 齐珂珂 徐子伟∗
(浙江省农业科学院畜牧兽医研究所,杭州310021)
摘 要:本文旨在研究饲粮添加一水肌酸(CMH)对杜浙猪肉质性状、肌肉磷酸原代谢、纤维类型特征及蛋白质溶解性的影响。试验选取体重70 kg左右杜浙猪30头,随机分为2组,每组5个重复,每个重复3头猪。对照组饲喂基础饲粮,试验组饲喂基础饲粮+0.5%CMH,试验期30 d。结果显示:与对照组相比,饲粮添加CMH对杜浙猪生长性能无显著影响(P>0.05),使背最长肌宰后24 h pH和剪切力显著增加(P<0.05),滴水损失和压榨损失显著降低(P<0.05),背最长肌的肌酸(Cr)总量、磷酸肌酸(PCr)储备量、肌酸激酶(CK)活性、白蛋白及肌原纤维蛋白溶解度显著增加(P<0.05),背最长肌肌球蛋白重链(MyHC)Ⅱa mRNA比例显著降低(P<0.05)。结果提示,饲粮添加CMH对杜浙猪肉质性状具有调控作用,对肌肉磷酸原代谢能力、蛋白质溶解度及肉品系水力产生显著影响。
关键词:一水肌酸;猪肉质性状;能量代谢;纤维类型组成;蛋白质溶解性
肌酸(creatine,Cr)最早由法国科学家Chev⁃reul发现[1],Harris等[2]首次报道了口服Cr可以提高肌肉总Cr含量、增强运动能力和缩短高强度运动后肌肉复原时间的作用。一水肌酸(creatine monohydrate,CMH)是一种重要的外源Cr补充形式,常被用来作为运动员肌肉力量的营养增强剂[3-7]。在畜禽生产领域,先后有人证明CMH具有改善胴体品质、提高肉品系水力的作用[8-13],其效果受动物品种[14-15]及其饲粮组成[16]影响。杜浙猪[Duroc×Zhongbai(DZ)crossed pigs]是以浙江中白猪为母本与杜洛克猪杂交形成的优质瘦肉型商品猪,肉质性状明显优于杜长大或杜大长猪,但生长速度和胴体品质存在不足[17]。能否从饲粮营养途径进一步优化改善杜浙猪产肉性能,具有重要生产实际意义,但相关研究工作尚未开展。本文旨在研究饲粮添加CMH对杜浙猪生长性能、胴体品质、背最长肌磷酸原代谢、肌肉纤维类型特征、蛋白质溶解度及肉质性状的影响,为提升杜浙猪产肉性能及其相关机理研究提供科学依据。
1 材料与方法
1.1 试验设计
选取70 kg左右(5月龄)杜浙猪阉公猪30头,随机分为2组,每组5个重复,每个重复3头猪。试验期30 d,自由采食和饮水,试验饲粮组成及营养水平见表1。试验结束时,每个重复选取1头,统一运至浙江大不同肉品有限公司屠宰场,严格按照《生猪屠宰操作规范》(GB/T 17236—1998)屠宰。测量宰后胴体性状,采集背最长肌样品用于测定肉质性状和相关生化及分子生物学指标。
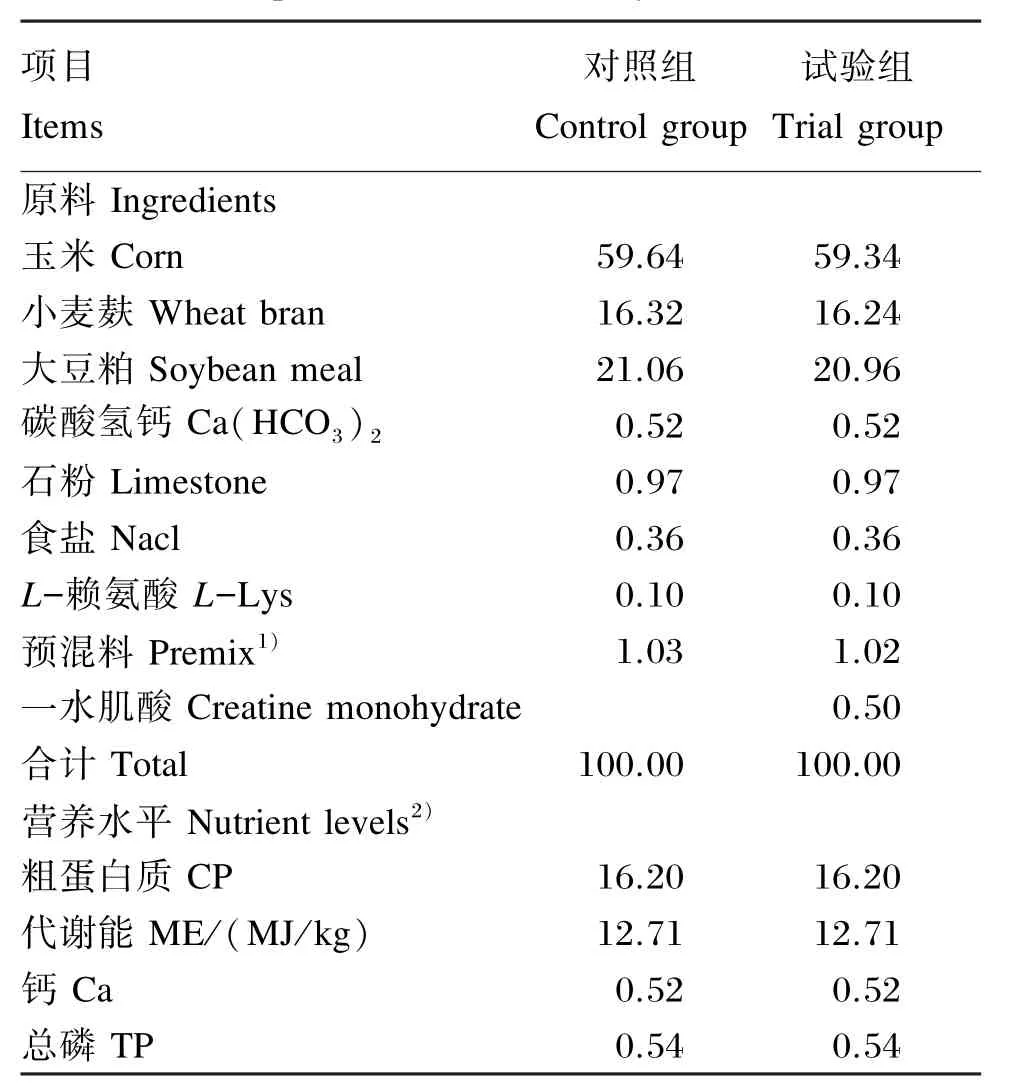
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air⁃dry basis) %
1.2 检测指标
1.2.1 生长性能与胴体性状测定
记录试验全期采食量、始末体重,计算日平均采食量和体增重及料重比;用游标卡尺测量左侧胴体第1胸椎、最后胸椎和腰椎处背膘厚度,计算3点平均背膘厚度;用直尺测量倒数第3、4肋骨处背最长肌截面长和宽,根据“长×宽×0.7“计算眼肌面积。
1.2.2 肉质性状的测定
取出熟化后背最长肌,参照《猪肌肉品质测定技术规范》(NY/T 821—2004)测定pH、肉色、剪切力、滴水损失和压榨损失。剪切力测6个重复/样,其他测3个重复/样。精确称取2 g左右肌肉风干样,采用索氏抽提法测定粗脂肪含量。参照文献[18]描述方法,测定肌肉总蛋白、肌浆蛋白和肌纤维蛋白的溶解度,蛋白质浓度采用微量法BCA试剂盒测定。
1.2.3 肌肉纤维类型特征分析
肌球蛋白重链(myosin heavy chain,MyHC)mRNA组成分析:按照文献[19]描述设计、合成实时荧光定量PCR(qPCR)引物,参照呼红梅等[20]描述方法测定MyHCⅠ、Ⅱa、Ⅱx和Ⅱb亚基的mRNA绝对拷贝数,计算每种MyHC mRNA拷贝数占4种MyHC mRNA拷贝数总和的百分比例(%)。
氧化代谢酶活性分析:准确称取200 mg冻存肌肉样品,加入9倍体积(1.8 mL)0.9%生理盐水,离心后收集上清液,参照试剂盒说明书测定琥珀酸脱氢酶(SDH)和苹果酸脱氢酶(MDH)活性,表示单位为U/mg prot。
1.2.4 肌肉磷酸原代谢指标分析
Cr和磷酸肌酸(PCr)含量分析:参照门小明等[21]描述,采用高效液相色谱外标法测定肌肉Cr 和PCr含量,表示单位为nmol/mg新鲜组织。色谱条件为:流动相为磷酸钾缓冲液(220 mmol/L,TBA调pH至6.5)∶甲醇=80∶20,流速为0.8 mL/min的等比洗脱,检测波长为210 nm;色谱柱为Eclipse XDB⁃C18色谱柱(5 μm,4.6 mm× 150 mm),进样体积为20 μL,柱温30℃。
肌酸激酶(CK)活性分析:准确称取200 mg冻存肌肉样品,加入9倍体积(1.8 mL)0.9%生理盐水,离心后收集上清液,参照试剂盒说明书测定活性,表示单位为U/mg prot。
1.3 数据处理与统计分析
利用SPSS 16.0的t⁃test对试验组和对照组各项指标进行差异比较,数据表示形式为“平均值±标准差”,差异显著水平为P<0.05。
2 结果与分析
2.1 CMH对生长性能、胴体及肉品质等表观性状的影响
如表2所示,试验组在平均日增重、平均日采食量、料重比、背膘厚度及眼肌面积指标上与对照组无显著差异(P>0.05),但在数值上背膘厚度表现降低,眼肌面积表现增加;与对照组相比,试验组背最长肌的pH45 min几乎无影响(P>0.05),pH24 h显著升高(P<0.05);宰后pH下降程度从0.84降到0.68,但无统计显著性(P>0.05);试验组背最长肌的滴水损失和压榨损失显著降低(P<0.05),剪切力值显著升高(P<0.05),肉色参数无显著差异(P>0.05),IMF含量下降近25%,但无统计显著性(P>0.05)。
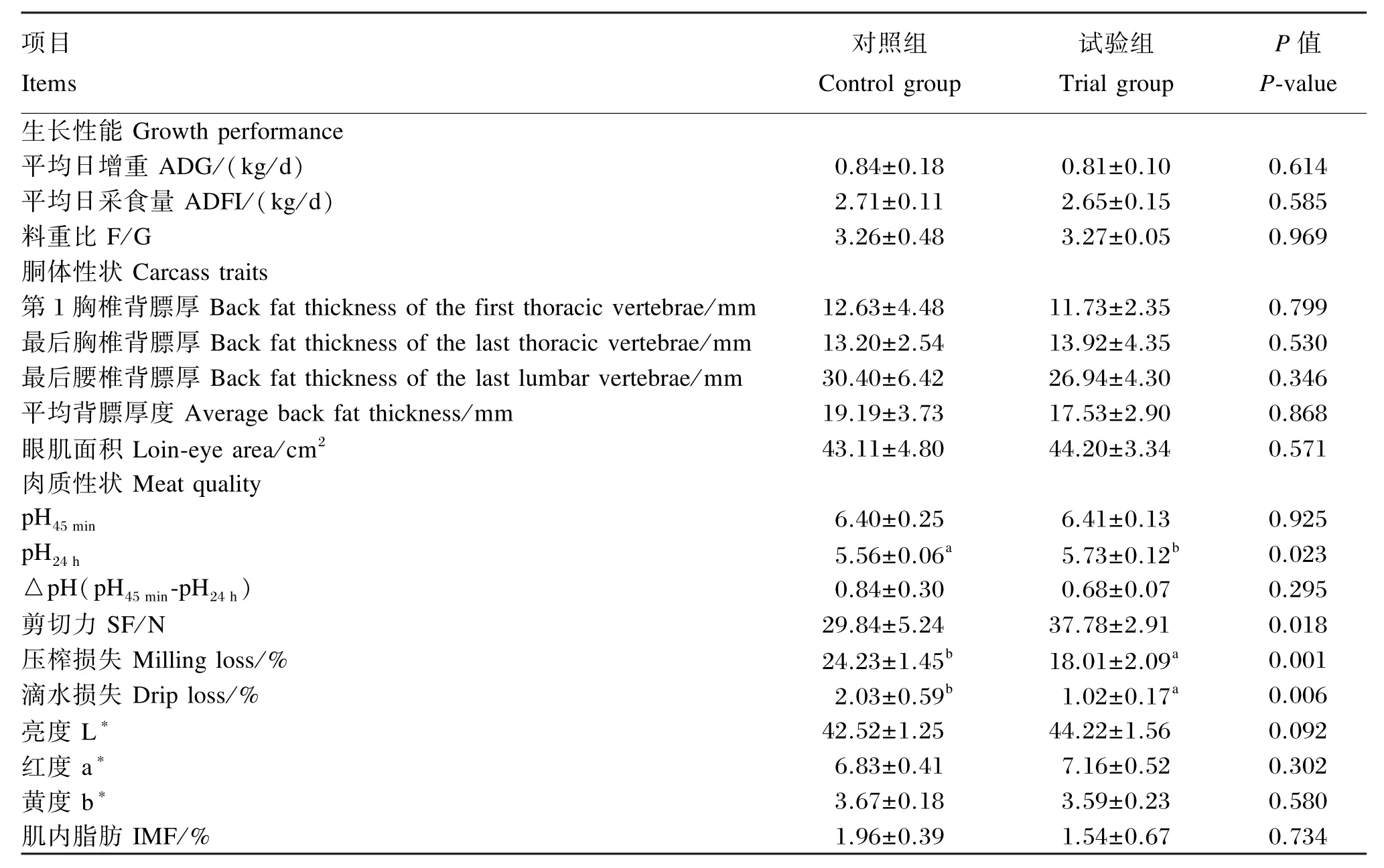
表2 CMH对杜浙猪生长性能、胴体与肉质性状的影响Table 2 Effects of CMH on growth performance,crass and meat quality of DZ crossed pigs
2.2 CMH对背最长肌纤维类型特征影响
如表3所示,试验组的MyHCⅡa mRNA比例显著降低于对照组(P<0.05),MyHCⅠ和Ⅱb mRNA比例及SDH和MDH活性均表现升高趋势(P>0.05)。
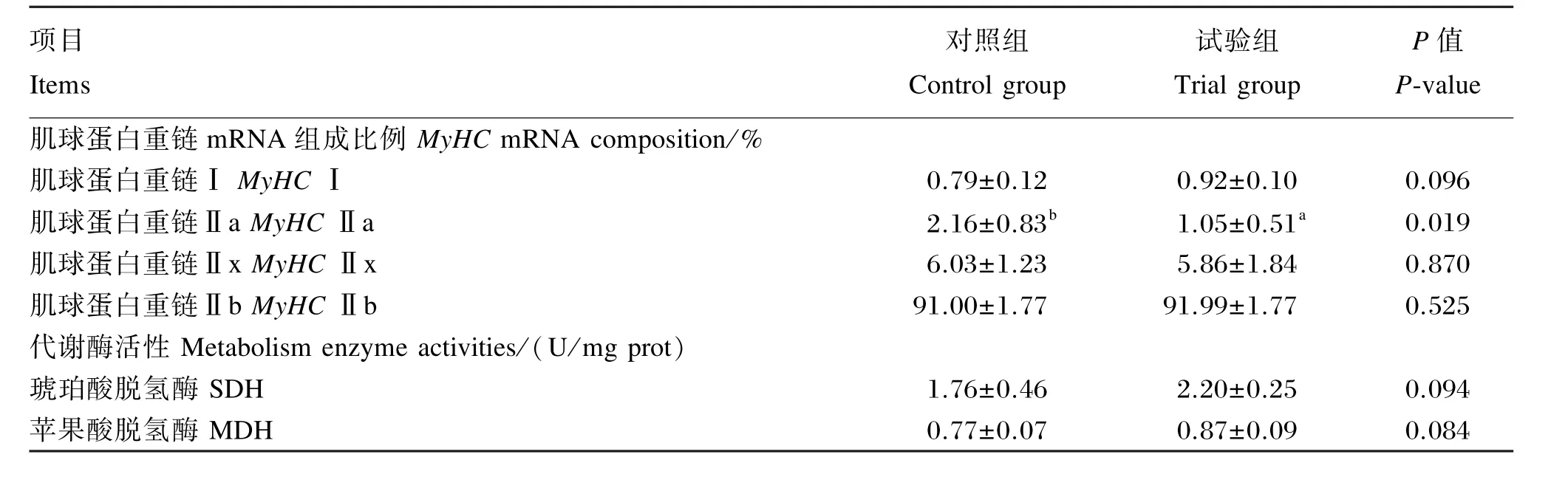
表3 CMH对杜浙猪背最长肌MyHC mRNA组成与氧化代谢酶活性的影响Table 3 Effects of CMH on MyHC mRNA composition and oxidative metabolism enzyme activities in longissimus dorsi muscle of DZ crossed pigs
2.3 CMH对猪背最长肌磷酸原代谢的影响
如表4所示,试验组背最长肌肌酸总量和PCr含量以及CK活性显著高于对照组(P<0.05),Cr含量没有达到差异显著水平(P>0.05)。
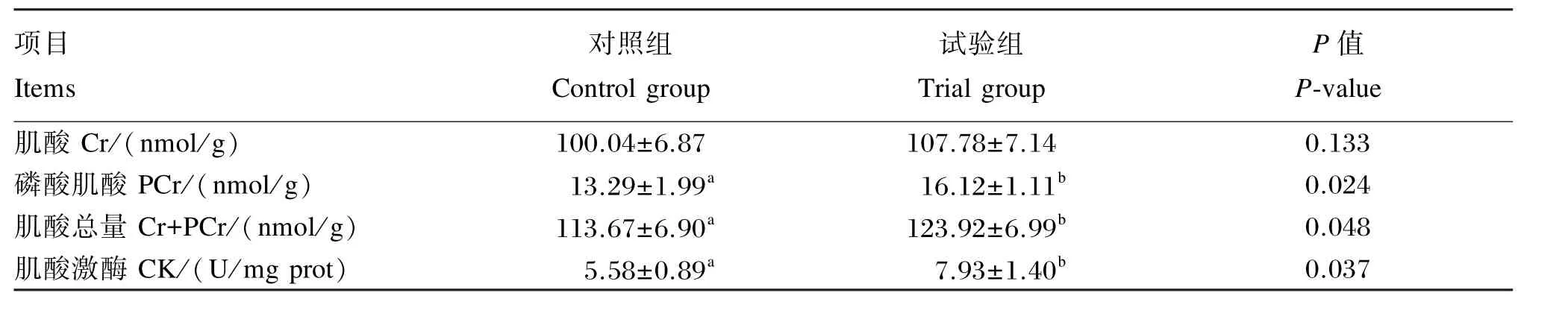
表4 CMH对杜浙猪背最长肌磷酸原代谢指标的影响Table 4 Effects of CMH on phosphagen metabolism indexes in longissimus dorsi muscle of DZ crossed pigs
2.4 CMH对猪背最长肌蛋白质溶解度的影响
如表5所示,试验组背最长肌的总蛋白及纤维蛋白溶解度显著高于对照组(P<0.05),肌浆蛋白溶解度也表现明显升高趋势(P>0.05)。
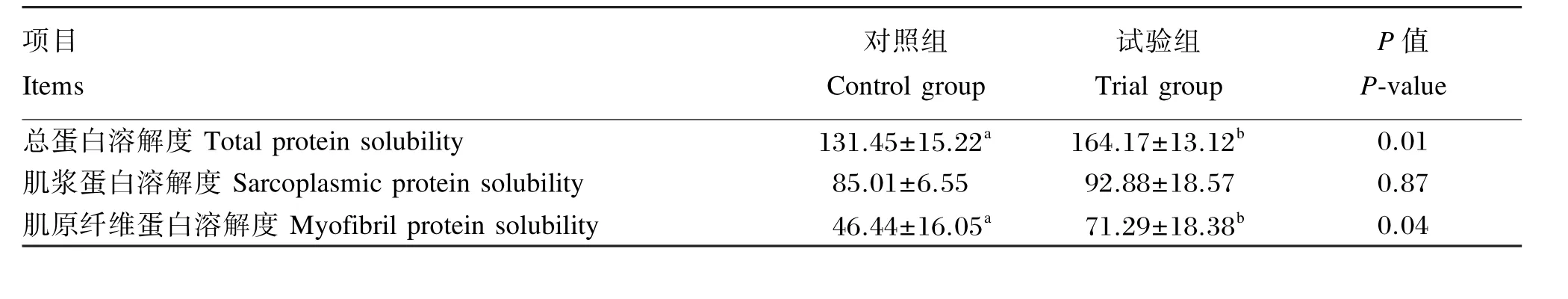
表5 CMH对杜浙猪背最长肌蛋白质溶解度的影响Table 5 Effects of CMH on protein solubality in longissimus dorsi muscle of DZ crossed pigs mg/g
3 讨 论
3.1 CMH对猪肉生长及胴体性状的影响
已有研究表明,CMH对动物生长性能、胴体组成及肉质性状及体重、水分及肌肉含量的影响存在明显品种特异性[14-15]或有效应答者和非应答者[3],还可能受蛋白质摄入量影响[16]。Young等[22]研究表明,纯种杜洛克猪为CMH应答者,纯种长白猪为CMH非应答者,丹麦长大杂交猪也表现CMH的不敏感性[15]。本研究在平均值上也表现出一致结果,试验动物样本量偏少,且来自不同血缘杂交亲本,可能是没有达到统计显著性的重要原因。细胞内Cr主要来自外源吸收[23-24],细胞转运吸收能力差异可能与品种特异性密切相关。Cr吸收转运机制已经清楚[25],肌酸转运蛋白(CrT)和CK等关键因子的遗传多态性研究可为CMH调控猪产肉性状的品种效应提供解释,将是本研究后续研究重点。
3.2 CMH对骨骼肌磷酸原代谢及宰后pH的影响
在活体动物,PCr在CK催化下可将二磷酸腺苷(ADP)转化成三磷酸腺苷(ATP)和Cr,即PCr+ADP+H+→Cr+ATP,简称ATP⁃CP[26]。ATP⁃CP是肌肉运动过程最早启动的能量代谢途径,具有快速和最大供能效率的特点。当PCr消耗殆尽,骨骼肌才顺次启动无氧糖代谢和有氧氧化。当无氧酵解乳酸积累过多或有氧氧化供能不足时,PCr还可以为ADP提供高能磷酸键生成ATP。正是这一周而复始、互补替代的能量代谢系统,为动物机体生长包括骨骼肌物质沉积提供了重要基础。有研究表明,通过补充外源Cr可增加体内Cr含量,进而提高CK活性和PCr储备含量[11]。本研究结果证实了这一观点,与夏伟光等[27]在肉鸡上的研究结果一致。即当外源Cr进入体内,在CK催化下吸收多余ATP的磷酸根基团,将高能化合键以PCr形式储存起来,进而增强了Cr代谢池的能量储备,为机体蛋白质沉积提供了保障。本研究中杜浙猪眼肌面积在数值上有所增加,背膘厚度有所降低,暗示了外源Cr调控机体物质沉积作用,但需要增加样本验证才能得出最终结论。
当动物被屠宰后,体内有氧能量代谢终止,ATP⁃CP供能被优先启动,PCr耗尽后开始通过无氧糖酵解过程提供ATP。无氧糖酵解的乳酸积累可导致宰后肌肉pH异常下降,进而使肌纤维蛋白变性,肌球蛋白头部收缩,粗细肌丝结合及肌浆蛋白析出,表现肉色苍白、水分渗出等肉品性状[28]。本研究中杜浙猪补充CMH后,机体PCr储备量和CK活性增加,必将为宰后肌肉快速提供更多ATP,推迟启动无氧糖酵解,减少乳酸积累,可能是宰后24 h pH升高、下降程度变小的直接原因,也是影响其他肉质性状的重要途径。
3.3 CMH对肌肉纤维类型特征的影响
根据收缩代谢特征,成年哺乳动物骨骼肌纤维可划分为慢速氧化型(Ⅰ型)、快速氧化型(Ⅱa型)、中间型(Ⅱx型)和快速酵解型(Ⅱb型)4种不同类型肌纤维,Ⅰ型纤维具有相对较低的ATP酶活性和糖原含量,丰富的血管,较小的纤维直径和较高的肌红蛋白和甘油三醋含量,倾向有氧能量代谢;Ⅱx与Ⅱb型纤维表现相对较高的收缩速度,较低的氧化代谢能力,Ⅱa型纤维的收缩速度和代谢特征处于Ⅰ型和Ⅱx型纤维之间[29]。
MyHC是动物骨骼肌主要的运动功能蛋白质,在猪中存在Ⅰ、ⅡaⅡx和Ⅱb 4种不同亚基,它们的收缩速度按照Ⅰ<Ⅱa<Ⅱx<Ⅱb增加,比例关系被用来对应表示不同肌纤维类型比例[30-31]。本研究发现,饲粮添加CMH显著降低了MyHCⅡa mRNA比例,对MyHCⅠmRNA比例的增加趋势,反映氧化代谢能力的SDH和MDH活性也有增加趋势。由于不同类型肌纤维可以按照“Ⅰ↔Ⅱa↔Ⅱx↔Ⅱb”转化[32],结果中同时降低MyHC Ⅱa mRNA比例和升高MyHCⅠmRNA比例,可能意味着肌纤维类型有向Ⅰ型转化趋势。有研究发现,大鼠比目鱼肌(红肌纤维为主)的Cr吸收能力和CrT含量均高于其他以白肌纤维为主的肌肉[33],可为本研究结果提供部分解释。
改变肌肉纤维类型组成是调控肉质形成的重要途径。本研究通过添加CMH同时提高了猪肉系水力和蛋白质溶解度,与先前很多研究报道一致[12,34]。这一改变与肌肉纤维类型组成改变存在密切关系。因为氧化型肌肉纤维表现相对较高蛋白质溶解度[35-37],而蛋白质溶解度是蛋白质水合作用重要标志,决定着肉品系水力大小[38-39]。影响肉品系水力的另一因素———宰后pH同样与肌纤维类型组成有关,即氧化型肌纤维因具有较弱无氧糖酵解能力,表现较低的宰后pH下降程度[29]。因此,肌肉纤维类型组成的改变可能是外源CMH调控肉质性状形成的潜在机制,值得深入研究。
4 结 论
①饲粮中添加CMH显著提高了杜浙猪背最长肌宰后24 h pH、肉品系水力及蛋白质溶解度。
②饲粮中添加CMH显著提高了背最长肌中Cr总量和CK活性,增强了ATP⁃CP代谢能力。
参考文献:
[1] TURNER C E,GANT N.The biochemistry of creatine [M].[s.l.]:Magnetic Resonance Spectroscopy,2014:91-103.
[2] HARRIS R C,SÖDERLUND K,HULTMAN E.Ele⁃vation of creatine in resting and exercised muscle of normal subjects by creatine supplementation[J].Clini⁃cal Science,1992,83(3):367-374.
[3] KRAEMER W J,LUK H Y,LOMBARD J R,et al.Physiological basis for creatine supplementation in skeletal muscle[M]//BAGCHI D,NAIR S,SEN C K.Nutrition and enhanced sports performance:muscle building,endurance,and strength.New York:Academ⁃ic Press,2013:385-394.
[4] YILDIZ A,OZDEMIR E,GULTURK SERDAL S.The effects of creatine long⁃term supplementation on muscle morphology and swimming performance in rats [J].Journal of Sports Science and Medicine,2009,8 (4):516-522.
[5] AZIZI M.The effect of a short⁃term creatine supple⁃mentation on some of the anaerobic performance and sprint swimming records of female competitive swim⁃mers[J].Procedia⁃Social and Behavioral Sciences,2011,15:1626-1629.
[6] ATASHAK S,JAFARI A.Effect of short⁃term creatine monohydrate supplementation on indirect markers of cellular damage in young soccer players[J].Science&Sports,2012,27(2):88-93.
[7] VATANI D S,FAEAJI H,SOORI R,et al.The effects of creatine supplementation on performance and hor⁃monal response in amateur swimmers[J].Science&Sports,2011,26(5):272-277.
[8] SCHEFFLER T L,KASTEN S C,ENGLAND E M,et al.Contribution of the phosphagen system to postmor⁃tem muscle metabolism in AMP⁃activated protein ki⁃nase γ3 R200Q pig longissimus muscle[J].Meat Sci⁃ence,2014,96(2):876-883.
[9] CHEN J,HUANG J Z,DEN J,et al.Use of comparative proteomics to identify the effects of creatine pyruvate onlipid and protein metabolism in broiler chickens[J].The Veterinary Journal,2012,193(2):514-521.
[10] CHEN J,MA H T,WANG M,et al.Creatine pyruvate enhances lipolysis and protein synthesis in broiler chicken[J].Agricultural Sciences in China,2011,10 (12):1977-1985.
[11] 程灵豪,高峰,温若竹,等.一水肌酸对肉鸭胴体组成及肌肉系水力的影响[J].浙江大学学报:农业与生命科学版,2010,36(6):635-640.
[12] SCHEFLER T L,ROSSER A L,KASTEN S C,et al.Use of dietary supplementation with β⁃guanidinopropi⁃onic acid to alter the muscle phosphagen system,post⁃mortem metabolism,and pork quality[J].Meat Sci⁃ence,2013,95(2):264-271.
[13] 吴娟,程灵豪,高峰,等.一水肌酸对肉鸭胴体组成及肉品质的影响[J].南京农业大学学报,2011,34 (4):100-104.
[14] YOUNG J F,BERTRAM H C,ROSENVOLD K,et al.Dietary creatine monohydrate affects quality attrib⁃utes of Duroc but not Landrace pork[J].Meat Sci⁃ence,2005,70(4):717-725.
[15] ROSENVOLD K,BERTRAM H C,YOUNG J F.Di⁃etary creatine monohydrate has no effect on pork qual⁃ity of Danish crossbred pigs[J].Meat Science,2007,76(1):160-164.
[16] BERG E P,STAH C A,SHANNON M S,et al.The influence of dietary protein on market barrows and gilts supplemented creatine monohydrate in conjunc⁃tion with a high glycemic carbohydrate[J].Meat Sci⁃ence,2011,88(3):429-433.
[17] 门小明.肌肉纤维类型组成对猪肉品质的影响及其机理研究[D].博士学位论文.无锡:江南大学,2007:32-39.
[18] LIU J,RUUSUNEN M,PUOLANNE E,et al.Effect of pre⁃rigor temperature incubation on sarcoplasmic protein solubility,calpain activity and meat properties in porcine muscle[J].LWT⁃Food Science and Tech⁃nology,2014,55(2):483-489.
[19] TANABE R,MUROYA S,CHIKUNI K.Expression of myosin heavy chain isoforms in porcine muscle de⁃termined by multiplex PCR[J].Journal of Food Sci⁃ence,1999,64(2):222-225.
[20] 呼红梅,朱荣生,张印,等.莱芜猪和杜洛克猪背最长肌肌球蛋白重链组成[J].中国农业科学,2008,41 (11):3754-3759.
[21] 门小明,邓波,徐子伟,等.猪宰后肌肉非乳酸供能特点及其与肉质性状相关性[J].中国农业科学,2011,44(7):1457-1465.
[22] YOUNG J F,BERTRAM H C,THEIL P K,et al.In vitro and in vivo studies of creatine monohydrate sup⁃plementation to Duroc and Landrace pigs[J].Meat Science,2007,76(2):342-351.
[23] CARDUCCI C,CARDUCCI C,SANTAGATA S,et al.In vitro study of uptake and synthesis of creatine and its precursors by cerebellar granule cells and astro⁃cytes suggests some hypotheses on the physiopatholo⁃gy of the inherited disorders of creatine metabolism [J].BMC Neuroscience,2012,13:41.
[24] MILLER D W,AUGUSTINE S,ROBINSON D H,et al.Oral bioavailability of creatine supplements:insights into mechanism and implications for improved absorp⁃tion[M]//BAGCHI D,NAIR S,SEN C K.Nutrition and enhanced sports performance:muscle building,en⁃durance,and strength.New York:Academic Press,2013:395-403.
[25] 袁建琴,刘承宜,徐晓阳.骨骼肌肌酸转运及其分子机制[J].中国运动医学杂志,2009,29(3):345-348.
[26] EGAN B,ZIERATH J R.Exercise metabolism and the molecular regulation of skeletal muscle adaptation[J].Cell Metabolism,2013,17(2):162-184.
[27] 夏伟光,左建军,冯定远.肉鸡饲粮中添加一水肌酸对骨骼肌肌酸吸收和代谢的影响[J].动物营养学报,2013,25(2):372-381.
[28] BREWER M S.Chemical and physical characteristics of meat:water⁃holding capacity[M]//DEVINE C,DIKEMAN M.Encyclopedia of Meat Sciences.2nd ed.New York:Academic Press,2014:274-282.
[29] LEFAUCHEUR L.A second look into fibre typing⁃Re⁃lation to meat quality[J].Meat Science,2010,84(2):257-270.
[30] KIM G D,RYU Y C,JO C,et al.The characteristics of myosin heavy chain⁃based fiber types in porcine longissimus dorsi muscle[J].Meat Science,2014,96 (2):712-718.
[31] GUO Y Y,LI J,SHANG J,et al.Development of muscle⁃related genes and their effects on meat quality [J].Energy Procedia,2012,16:229-233.
[32] BALDWIN K M,HADDAD F.Effects of different ac⁃tivity and inactivity paradigms on myosin heavy chain gene expression in striated muscle[J].Journal of Ap⁃plied Physiology,2001,90(1):345-357.
[33] BRAULT J J,TERJUNG R L.Creatine uptake and creatine transporter expression among rat skeletal mus⁃cle fiber types[J].American Journal of Physiology⁃Cell Physiology,2003,284(6):C1481-C1489.
[34] 韩剑众,顾振宇,吴劲松,等.一水肌酸对肥育猪胴体组成和肉质的影响及机理研究[J].中国粮油学报,2007,22(3):101-106.
[35] PEARCE K L,ROSENVOLD K,ANDERSEN H J,et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the im⁃pacts on fresh meat quality attributes—a review[J].Meat Science,2011,89(2):111-124.
[36] CHOI Y M,LEE S H,CHOE J H,et al.Protein solu⁃bility is related to myosin isoforms,muscle fiber types,meat quality traits,and postmortem protein changes in porcine longissimus dorsi muscle[J].Live⁃stock Science,2010,127(2/3):183-191.
[37] CHOI Y M,RYU Y C,KIM B C.Influence of myosin heavy⁃and light chain isoforms on early postmortem glycolytic rate and pork quality[J].Meat Science,2007,76(2):281-288.
[38] WARNER R.Measurement of meat quality of water⁃holding capacity and color:objective and subjective [M]//DEVINE C,DIKEMAN M.Encyclopedia of Meat Sciences.2nd ed.New York:Academic Press,2014:164-171.
[39] XIONG Y L.Chemical and physical characteristics of meat[M]//DEVINE C,DIKEMAN M.Encyclope⁃dia of meat sciences.2nd ed.New York:Academic Press,2014:267-273.
(责任编辑 武海龙)
Effects of Creatine Monohydrate on Meat Quality,Phosphagen Metabolism,Myofiber Types and Protein Solubility in Longissimus
Muscle of Duroc×Zhongbai(DZ)Crossed Pigs
MEN Xiaoming DENG Bo TAO Xin QI Keke XU Ziwei∗
(Institute of Animal Husbandry and Veterinary Science,Zhejiang Academy of Agricultural Science,Hangzhou 310021,China)
Abstract:This experiment was conducted to investigate the effects of dietary creatine monohydrate on meat quality,phosphagen metabolism,myofiber types and protein solubility in longissimus muscle of Duroc×Zhong⁃bai(DZ)crossed pigs.Thirty DZ crossbred pigs(about 70 kg bodyweight)were divided into two groups with five replicates per group and three pigs per replicate.Pigs in the control group were fed the basal diet,and the others were fed the basal diet+0.5%creatine monohydrate(CMH).The experiment lasted for 30 days.The re⁃sults showed that compared with the control group,dietary CMH had no influence on growth performance of DZ crossed pigs(P>0.05),the pH at 24 h postmortem and shear force of longissimus muscle were significant⁃ly increased(P<0.05),the drip loss and milling loss of longissimus muscle were significantly decreased(P<0.05),the creatine(Cr)and phosphocreatine(PCr)content,creatine kinase(CK)activity,total protein and myofibrilla protein solubilities of longissimus muscle were significantly increased(P<0.05),the myosin heavy chain(MyHC)Ⅱa mRNA ratio of longissimus muscle was significantly decreased(P<0.05).In conclusion,dietary CMH can regulate meat quality,and it has significant effect on phosphagen metabolism capacity,pro⁃tein solubility and water hold capacity of longissimus muscle.[Chinese Journal of Animal Nutrition,2015,27 (5):1527⁃1533]
Key words:creatine monohydrate;meat quality;energy metabolism;muscle fiber types;protein solubility
Corresponding author∗,professor,E⁃mail:zjsnkyxzw@163.com
通信作者:∗徐子伟,研究员,博士生导师,E⁃mail:zjsnkyxzw@163.com
基金项目:国家自然基面上项目(31172220);国家现代农业产业技术研究体系(CARS⁃36);浙江省科技厅资助项目(2012C12906⁃4,2010R50027⁃21)
收稿日期:2014-12-03
doi:10.3969/j.issn.1006⁃267x.2015.05.024
中图分类号:S828
文献标识码:A
文章编号:1006⁃267X(2015)05⁃1527⁃07
作者简介:门小明(1979—),男,吉林扶余人,助理研究员,博士,从事动物生产与产品质量调控。E⁃mail:menxiaoming@126.com
